卡瑞利珠单抗联合白蛋白结合型紫杉醇+顺铂化疗用于局部晚期食管癌术前的效果及对PD-1、PD-L1 水平的影响研究
2023-10-12陈仙芳郭庆森
陈仙芳 郭庆森
食管癌发病率、致死率高, 初期症状并不明显,多数患者确诊时已进展至局部晚期[1]。局部晚期指局部淋巴结转移或食管癌变侵犯周围组织, 但未转移至远端或侵及重要器官。局部晚期食管癌患者采用单一手术治疗的效果不理想, 一般临床多以手术联合术后辅助治疗, 但研究发现[2]术后辅助疗效有限, 还需寻找新的辅助治疗方式。术前辅助治疗指在肿瘤切除手术前先采用化疗减小肿瘤体积, 降低肿瘤病理分期,再结合手术实现治疗效果的提升。然而, 放疗的疗效虽然十分确切, 但是仍然有患者会产生一定的不良反应, 出现免疫力不足、难以耐受的情况, 影响后续的治疗进展。所以, 临床对此提出了免疫治疗的概念,希望能改善患者的机体耐受性。其中, 程序性死亡受体-1(programmed death receptor-1, PD-1)抑 制 剂 卡 瑞利珠单抗在肺癌、肝癌的辅助治疗中均有较好表现,有研究显示其能够加强机体抗肿瘤免疫力[3]。但需要注意的是, 卡瑞利珠单抗面世时间并不长, 还存在许多需要临床实际检验的部分。鉴于此, 本研究中局部晚期食管癌患者采用卡瑞利珠单抗联合白蛋白结合型紫杉醇+顺铂化疗, 观察其应用效果, 总结如下。
1 资料与方法
1.1 一般资料 从本院肿瘤内科2019 年1 月~2022 年9 月收治的局部晚期食管癌患者中随机抽取73 例, 采用电脑系统随机分为对照组(36 例)和研究组(37 例)。对照组中男29 例, 女7 例;年龄58~65 岁, 平均年龄(60.22±3.45)岁;分期:Ⅲ期30 例, Ⅳ期6 例;食管肿瘤位置:上段12 例, 中段11 例, 下段13 例。研究组中男30 例, 女7 例;年龄59~66 岁, 平均年龄(61.10±3.26)岁;分期:Ⅲ期32 例, Ⅳ期5 例;食管肿瘤位置:上段14 例, 中段11 例, 下段12 例。两组患者一般资料比较, 差异无统计学意义(P>0.05), 具有可比性。见表1。本研究方案已通过本院伦理委员会批准, 所有患者及家属均对本次研究的目的、意义、研究步骤和风险有所了解。
表1 两组患者一般资料比较(n, ±s)

表1 两组患者一般资料比较(n, ±s)
注:两组比较, P>0.05
组别 例数 性别 平均年龄(岁)分期 食管肿瘤位置男女Ⅲ期 Ⅳ期 上段 中段 下段对照组 36 29 7 60.22±3.45 30 6 12 11 13研究组 37 30 7 61.10±3.26 32 5 14 11 12 χ2/t 0.003 1.112 0.142 0.180 P 0.955 0.270 0.707 0.914
1.2 纳入及排除标准 纳入标准:①符合《中国食管癌放射治疗指南(2019 年版)》[4]中食管癌的相关诊断标准, 并确诊为Ⅲb~Ⅳ期;②预计生存期≥3 个月;③意识清醒;④病灶可以经由医学影像学技术手段测量;⑤签署知情同意书。排除标准:①预计生存期<3 个月;②重要脏器功能受损;③合并全身性感染;④合并血液系统疾病;⑤有相关药物过敏史;⑥参与研究前已具有化疗史。
1.3 方法 对照组术前采用白蛋白结合型紫杉醇+顺铂化疗治疗:每个疗程第1、8 天为患者静脉滴注白蛋白结合型注射用紫杉醇(商品名:艾越, 江苏恒瑞医药股份有限公司, 国药准字H20183378, 规格:100 mg),滴注剂量为125 mg/(m2·次)。每个疗程第1、2、3 天为患者静脉滴注顺铂注射液(江苏豪森药业有限公司, 国药准字 H20040813, 规格:30 mg), 滴注剂量为25 mg/(m2·次)。研究组术前在对照组基础上加用卡瑞利珠单抗治疗:每个疗程第1 天为患者静脉滴注注射用卡瑞利珠单抗(苏州盛迪亚生物医药有限公司, 国药准字S20190027, 规格:200 mg), 200 mg/次。以21 d 为1 个疗程, 两组患者均持续治疗2 个疗程。
1.4 观察指标及判定标准 比较两组患者PD-1、PD-L1 水平, 免疫功能指标, 疗效, 不良反应发生情况。①PD-1、PD-L1:于治疗前和治疗2 个疗程后采集患者晨起空腹静脉血4 ml, 离心(半径8 cm、速率3500 r/min)分离后取血清, 使用酶联免疫法测定PD-1、PD-L1。②免疫功能指标:以上述方式采集患者静脉血4 ml, 采用血细胞分析仪(上海光电医用电子仪器有限公司, 沪械注准20212220160, 型号:MEK-9100)测定CD3+、CD4+、CD4+/CD8+水平。③疗效判定标准:根据《实体瘤疗效评价标准简介》[5]评估疗效, 以影像学显示病灶消失并持续4 周以上为完全缓解;以影像学显示肿瘤体积缩小≥30%, 持续4 周以上为部分缓解;以影像学显示肿瘤体积缩小<30%或增大<20%,持续4 周以上为病情稳定;以影像学显示肿瘤增大≥20%为病情进展。总有效率=(完全缓解+部分缓解+病情稳定)/总例数×100%。④不良反应:记录所有患者治疗期间所产生的腹泻、胃肠道反应、骨髓抑制、肝功能损伤情况, 并采用美国国立肿瘤研究所抗癌药物急性与亚急性不良反应与分级标准进行归类。
1.5 统计学方法 采用SPSS23.0 统计学软件对数据进行处理。计量资料以均数±标准差(±s)表示,采用t 检验;计数资料以率(%)表示, 采用χ2检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 两组患者PD-1、PD-L1 水平比较 治疗前, 两组患者的PD-1、PD-L1 水平比较差异无统计学意义(P>0.05);治疗后, 两组患者的PD-1、PD-L1 水平均低于本组治疗前, 研究组患者的PD-1、PD-L1 水平均低于对照组, 差异具有统计学意义(P<0.05)。见表2。
表2 两组患者PD-1、PD-L1 水平比较( ±s, ng/L)
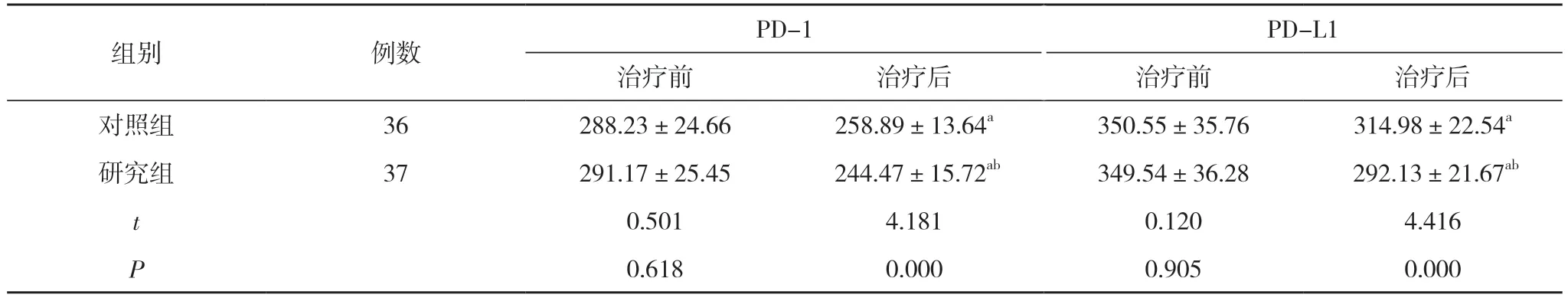
表2 两组患者PD-1、PD-L1 水平比较( ±s, ng/L)
注:与本组治疗前比较, aP<0.05;与对照组治疗后比较, bP<0.05
组别 例数 PD-1 PD-L1治疗前 治疗后 治疗前 治疗后对照组 36 288.23±24.66 258.89±13.64a 350.55±35.76 314.98±22.54a研究组 37 291.17±25.45 244.47±15.72ab 349.54±36.28 292.13±21.67ab t 0.501 4.181 0.120 4.416 P 0.618 0.000 0.905 0.000
2.2 两组患者免疫功能指标比较 治疗前, 两组患者CD3+、CD4+、CD4+/CD8+比较差异无统计学意义(P>0.05);治疗后, 研究组CD3+、CD4+、CD4+/CD8+均高于对照组, 差异具有统计学意义(P<0.05)。见表3。
表3 两组患者免疫功能指标比较( ±s)

表3 两组患者免疫功能指标比较( ±s)
注:与对照组治疗后比较, aP<0.05
组别 例数 CD3+(%) CD4+(%) CD4+/CD8+治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 36 53.22±5.20 55.46±4.63 33.24±3.15 36.58±3.21 1.40±0.21 1.13±0.44研究组 37 52.69±5.14 58.75±4.52a 32.13±3.21 39.02±3.34a 1.38±0.31 1.56±0.35a t 0.438 3.072 1.491 3.181 0.322 4.628 P 0.663 0.003 0.140 0.002 0.749 0.000
2.3 两组患者疗效比较 研究组患者的总有效率为89.19%, 显著高于对照组的69.44%, 差异具有统计学意义(P<0.05)。见表4。

表4 两组患者疗效比较[n(%)]
2.4 两组患者不良反应发生情况比较 两组患者胃肠道反应、腹泻、骨髓抑制、肝功能损伤的发生率比较差异均无统计学意义(P>0.05)。见表5。
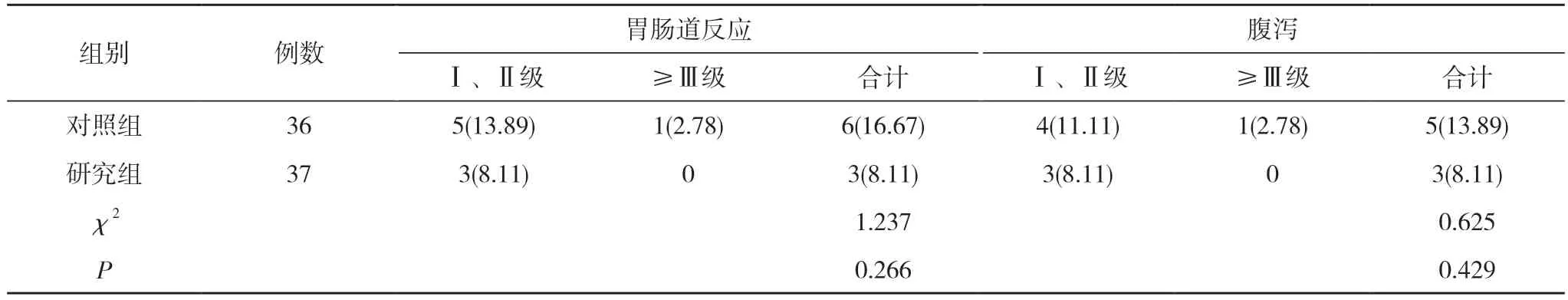
表5 两组患者不良反应发生情况比较[n(%)]
3 讨论
晚期食管癌的治疗中, 紫杉醇联合顺铂化疗的方式较为常见。白蛋白结合型紫杉醇有可溶性好、靶向性高的特点, 可显著提升肿瘤吸收药物的效率[6]。顺铂可通过与肿瘤DNA 结合来破坏肿瘤细胞, 抑制细胞复制。两种化疗药物均有较好的肿瘤细胞杀伤性, 但也会一定程度损伤正常细胞[7]。临床研究显示, 晚期食管癌患者5 年内的生存率通常仅为10%, 加之其患病部位特殊, 因此营养、热量的摄入都会深受影响, 机体处于高消耗状态。患者在这一情况之下, 对化疗药物的敏感性较差, 所以寻找到一种既能够提高化疗效果又能够改善患者体质的辅助治疗方法尤为重要。
研究发现[8], T 细胞膜上的PD-1 与肿瘤细胞膜上的PD-L1 结合, 可导致肿瘤细胞逃避人体免疫杀伤作用, 局部晚期食管癌肿瘤细胞中PD-1 表达较高, 易导致不良后果。卡瑞利珠单抗是PD-1 人源化单克隆抗体, 可辅助提升人体免疫功能, 促进抗肿瘤作用[9]。本次研究结果中, 研究组治疗后PD-1、PD-L1 水平均低于对照组(P<0.05)。分析原因为, 卡瑞利珠单抗作为一种PD-1 抑制剂, 可有效阻碍PD-1 和PD-L1的结合, 阻止肿瘤细胞逃避免疫, 从而促使T 细胞活化, 发挥肿瘤细胞杀伤作用。研究结果还显示, 研究组CD3+、CD4+、CD4+/CD8+及治疗总有效率均高于对照组(P<0.05), 该结果表明卡瑞利珠单抗与白蛋白结合型紫杉醇+顺铂联用可取得更为明显的疗效。白蛋白结合型紫杉醇+顺铂能够对肿瘤细胞的小管聚合产生抑制的效果, 从而降低小管的形成数量, 使其成为稳定的微管[10,11];同时, 该治疗方式还能够发挥抗肿瘤作用,其作用机制是破坏微管网状结构。卡瑞利珠单抗抑制PD-1 具有独特的亲和力与选择性[12], 该品能对PD-1通路所介导的T 细胞产生阻断的效果, 从而达到免疫抑制的作用, 进而活化T 细胞, 恢复免疫细胞功能[13],解除免疫抑制状态, 进一步加强机体对肿瘤的监测作用, 更为有效地杀灭肿瘤细胞, 降低肿瘤对人体产生的负荷[14]。卡瑞利珠单抗能够助力白蛋白结合型紫杉醇联合顺铂化疗稳定并缩小病灶, 对患者恢复免疫能力、提升生活质量有积极作用[15-22]。本研究还显示, 两组患者的胃肠道反应、腹泻、骨髓抑制、肝功能损伤的发生率比较差异均无统计学意义(P>0.05), 该结果说明卡瑞利珠单抗安全性良好, 将其与白蛋白结合型紫杉醇+顺铂联用并不会增加药物风险。值得注意的是,在本次研究当中, 采用了卡瑞利珠单抗抑制的患者即便出现不良反应, 也均为Ⅰ、Ⅱ级, 且总发生率也略低于对照组, 这在一定程度上提示该药有可能降低化疗的不良反应风险或严重程度, 但由于本次研究的样本数量较少, 因此并未能对这项问题作更为深入的探讨,未来可将其作为一个重点的研究方向。此外, 卡瑞利珠单抗的面世时间较短, 虽然其已经在临床广泛使用,但关于其不良反应的报道相对较少。有研究显示[15],采用卡瑞利珠单抗的人群中, 男性以及中老年人发生不良反应的几率更高, 且在第1 个用药周期与第4 个用药周期更容易出现不良反应。因此在用药过程中临床应注意加强这方面的药学监护。
综上所述, 卡瑞利珠单抗联合白蛋白结合型紫杉醇+顺铂化疗用于局部晚期食管癌术前化疗有较好的临床效果, 可有效降低PD-1、PD-L1 水平, 提升患者免疫能力。
