SLC7A11表达与双硫死亡、铁死亡及肿瘤关系的研究进展
2023-10-11赵琪琪杜雪芹刘松华刘斌王彦泽杨晓军
赵琪琪, 杜雪芹, 刘松华, 刘斌, 王彦泽, 杨晓军,4,5,6
(1. 宁夏医科大学临床医学院肝胆外科, 宁夏 银川 750004; 2. 甘肃省人民医院普外科, 甘肃 兰州 730000; 3. 甘肃医学院临床医学院, 甘肃 平凉 744000; 4. 兰州大学第一临床医学院普外科, 甘肃 兰州 730000; 5. 甘肃省外科肿瘤分子诊断与精准治疗重点实验室, 甘肃 兰州 730000; 6. 甘肃省消化道恶性肿瘤防控工程研究中心, 甘肃 兰州 730000)
1982年,Shiro Bannai和Emi Kitamura发现胱氨酸-谷氨酸反向转运体(System Xc-)是摄取胱氨酸的反向转运蛋白,而胱氨酸是合成谷胱甘肽的重要氨基[1]。研究表明,溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11)在各种实体瘤中呈高表达,肿瘤细胞可通过上调SLC7A11表达维持高水平的谷胱甘肽,从而抵消自身代谢速率增加所致的氧化应激;同时由于其抗氧化的功能,致SLC7A11表达与各种癌症的进展趋于正相关[2],并调节肿瘤生长、增殖、转移、微环境和治疗耐药性等[3]。2023年2月6日,由甘波谊和陈俊杰教授团队发表的文章鉴定了一种新的细胞死亡类型——双硫死亡(disulfidptosis)[4],该研究发现,SLC7A11高表达的肿瘤细胞在葡萄糖饥饿条件下,胞内胱氨酸等二硫化物发生异常积累,诱发二硫化物应激,使肌动蛋白调控的细胞骨架中二硫键含量升高,造成细胞骨架显著收缩且与细胞膜分离,并破坏细胞骨架结构,最终造成细胞死亡。本文针对双硫死亡的发现及近年来SLC7A11表达与肿瘤的相关性作一简要综述。
1 SLC7A11与双硫死亡
研究表明,在葡萄糖饥饿时,SLC7A11基因高表达的肿瘤细胞死亡更迅速[5],这是由于NADPH供应不能满足细胞将胱氨酸还原成为半胱氨酸所需,造成二硫化物应激,诱导肌动蛋白细胞骨架蛋白二硫键交联和细胞骨架收缩,从细胞质膜上剥离,并最终导致细胞死亡[6]。该细胞死亡形式与目前已知的细胞死亡形式均不相同,且不能被铁死亡、凋亡、坏死性凋亡和自噬抑制剂等所逆转,但可以被硫醇类还原性试剂三(2-羧乙基)膦[tris(2-carboxyethyl)phosphine,TCEP]抑制。为进一步明确该死亡是否受到其他细胞死亡方式的干扰,在细胞中分别敲除铁死亡另一关键通路蛋白酰基辅酶A合成酶长链家族成员4和凋亡关键诱导蛋白BAX/BAK,结果显示,可抑制葡萄糖充足条件下的细胞死亡,但依然无法逆转葡萄糖饥饿条件下的细胞死亡。由于葡萄糖与能量代谢有关,研究者还关注了ATP在该死亡方式中的作用,结果显示,在葡萄糖饥饿条件下,SLC7A11过表达细胞ATP水平显著高于SLC7A11非过表达细胞,敲除SLC7A11可恢复葡萄糖饥饿下二酰胺诱导的细胞死亡,由此表明这种新型死亡方式与二硫化物应激有关,与ATP水平无关。由此定义双硫死亡,即一种新型的细胞死亡方式,独立于现存的凋亡、铁死亡和铜死亡等细胞程序性死亡,是由细胞内过量胱氨酸积累引起的二硫化物应激导致的快速死亡方式。双硫死亡通常在葡萄糖饥饿的条件下发生,SLC7A11高表达细胞由于NADPH供应不足致胱氨酸还原成为半胱氨酸受限,进而造成二硫化物应激,最终导致细胞死亡,具体机制见图1。

System Xc-:胱氨酸-谷氨酸反向转运体;SLC3A2:溶质载体家族3成员2;SLC7A11:溶质载体家族7成员11;NADPH:还原型辅酶Ⅱ;NADP+:氧化型辅酶Ⅱ图1 细胞双硫死亡机制示意图
2 SLC7A11调控细胞铁死亡
铁死亡是一种独特的细胞死亡方式,是一种由脂质过氧化驱动的,依赖于铁的、受调控的,活性氧自由基大量累积所致的细胞死亡模式[7]。SLC7A11在细胞中的主要作用是参与胱氨酸的胞外摄取和谷氨酸释放,促进谷胱甘肽的合成来阻止过氧化氢等氧自由基引发的氧化应激,从而维持细胞氧化还原状态的平衡,并阻止细胞因脂质过氧化而导致的细胞死亡;SLC7A11生物功能与铁死亡机制相抗衡。由此表明,SLC7A11过表达可通过抑制铁死亡促进肿瘤生长[8]。研究发现,System Xc-是细胞铁死亡的重要调节因子,而SLC7A11是System Xc-的关键组成部分[8],抑制此系统的活性将抑制胱氨酸的吸收。SLC7A11作为System Xc-亚基之一,其下调可抑制半胱氨酸代谢通路,影响谷胱甘肽合成,导致膜脂修复酶GPX4活性降低(谷胱甘肽是谷胱甘肽过氧化物酶GPX4的还原性辅因子),继而细胞抗氧化能力降低,进一步造成脂质过氧化物堆积,最终诱导细胞发生铁死亡[9]。换言之,SLC7A11可通过介导胱氨酸转运促进谷胱甘肽合成,从而抑制脂质过氧化产物积累,阻碍铁死亡程序的启动。研究认为,SLC7A11参与诸多铁死亡相关的信号通路[10],例如,p53是一种抑癌因子,近年来许多研究发现其可通过抑制SLC7A11表达驱动癌细胞的铁死亡[11-13],抑制SLC7A11/谷胱甘肽/GPX4轴可触发血管平滑肌细胞的铁死亡,GDF15敲低可通过减弱SLC7A11表达促进Erastin诱导的铁死亡[14]。
3 肿瘤中SLC7A11的异常表达
多项研究表明,SLC7A11在胶质瘤[15]、乳腺癌[16]和肝癌[17]等多种肿瘤中呈高表达,并影响肿瘤细胞的新陈代谢、肿瘤的发生发展以及患者的治疗和预后[18]。为探究SLC7A11基因表达与肿瘤的相关性,检索肿瘤基因组图谱(TCGA)数据库(https://portal.gdc.cancer.gov/)来源的数据集,统计分析发现,SLC7A11mRNA在头颈部肿瘤、呼吸系统肿瘤、消化系统肿瘤、乳腺肿瘤及泌尿生殖系统肿瘤等大多数肿瘤组织中相对表达水平均明显高于癌旁组织(P均<0.05)。见图2和图3。由此表明,SLC7A11在多种肿瘤中可能发挥重要的作用。
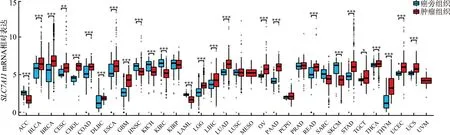
*:P<0.05;**:P<0.01;***:P<0.001;ACC:肾上腺皮质癌;BLCA:膀胱尿路上皮癌;BRCA:乳腺浸润癌;CESC:宫颈鳞状细胞癌及宫颈内腺癌;CHOL:胆管癌;COAD:结肠腺癌;DLBC:淋巴样肿瘤弥漫性大B细胞淋巴瘤;ESCA:食管癌;GBM:多形性胶质母细胞瘤;HNSC:头颈部鳞状细胞癌;KICH:肾嫌色细胞癌;KIRC:肾透明细胞癌;KIRP:肾乳头状细胞癌;LAML:急性髓系白血病;LGG:低级别胶质瘤;LIHC:肝细胞癌;LUAD:肺腺癌;LUSC:肺鳞状细胞癌;MESO:恶性间质瘤;OV:卵巢浆液性囊腺癌;PAAD:胰腺癌;PCPG:嗜铬细胞瘤及副神经节瘤;PRAD:前列腺腺癌;READ:直肠腺癌;SARC:肉瘤;SKCM:皮肤黑色素瘤;STAD:胃腺癌;TGCT:睾丸生殖细胞肿瘤;THCA:甲状腺癌;THYM:胸腺瘤;UCEC:子宫内膜癌;UCS:子宫癌肉瘤;UVM:葡萄膜黑色素瘤图2 相关肿瘤组织和配对癌旁组织中SLC7A11 mRNA相对表达水平比较
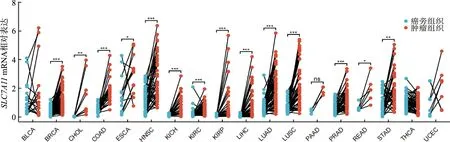
*:P<0.05;**:P<0.01;***:P<0.001;BLCA:膀胱尿路上皮癌;BRCA:乳腺浸润癌;CHOL:胆管癌;COAD:结肠腺癌;ESCA:食管癌;HNSC:头颈部鳞状细胞癌;KICH:肾嫌色细胞癌;KIRC:肾透明细胞癌;KIRP:肾乳头状细胞癌;LIHC:肝细胞癌;LUAD:肺腺癌;LUSC:肺鳞状细胞癌;PAAD:胰腺癌;PRAD:前列腺腺癌;READ:直肠腺癌;STAD:胃腺癌;THCA:甲状腺癌;UCEC:子宫内膜癌图3 相关肿瘤组织和非配对癌旁组织中SLC7A11 mRNA相对表达水平比较
3.1 头颈部肿瘤
在口腔鳞癌中,miR-375靶向SLC7A11基因调控口腔鳞癌细胞增殖和侵袭,miRNA-375过表达可靶向抑制SLC7A11表达,进而抑制口腔鳞癌细胞生长和浸润,表明SLC7A11高表达可促进口腔鳞癌的发生发展[19]。
研究表明,在胶质瘤细胞中,SLC7A11过表达与疾病进展和患者不良预后相关,其介导胶质瘤细胞的增殖、侵袭和放疗、化疗抵抗[20-21]。研究发现,SLC7A11在人脑胶质瘤组织中表达上调,且高级别胶质瘤中SLC7A11表达高于低级别胶质瘤[22]。神经胶质瘤中SLC7A11过表达的肿瘤细胞生长速度更快,且患者总生存期更短;SLC7A11在维持胶质瘤细胞氧化还原稳态方面发挥关键作用,抑制SLC7A11表达可增强抗癌药物的作用[23]。SLC7A11高表达的胶质瘤细胞呈现出葡萄糖依赖性[24]:当葡萄糖缺乏时,SLC7A11过表达促进活性氧积累,致Eph受体酪氨酸激酶A2磷酸化,促进胶质瘤细胞存活;与之相反,mTOR抑制剂处理胶质瘤细胞后,可通过溶酶体降解SLC7A11,进而抑制葡萄糖缺乏引起的细胞死亡。SLC7A11高表达的细胞对放疗敏感性降低,例如,胶质瘤中替莫唑胺抵抗与SLC7A11过表达有关[25]。SLC7A11过表达与肿瘤细胞中谷胱甘肽合成增加相关,谷胱甘肽可保护肿瘤细胞免受氧化损伤,进而产生放疗、化疗抵抗[26]。抑制SLC7A11表达可增强胶质瘤细胞对放疗的敏感性[27]。
另有研究表明,SLC7A11参与恶性胶质瘤细胞的增殖和血管生成,例如,SLC7A11可作为转录激活因子4的靶标,在人胶质母细胞瘤U87和U251细胞中,过表达转录激活因子4致SLC7A11表达增加,进而抑制肿瘤细胞发生铁死亡,促进血管生成,促进胶质母细胞瘤增殖等[28]。
3.2 呼吸系统肿瘤
研究表明,SLC7A11在多种肺癌亚型中均有表达,SLC7A11通过调节胞内胱氨酸-谷氨酸代谢、免疫细胞浸润,在肺癌发生、进展和治疗中发挥重要作用。与正常肺组织相比,SLC7A11在肺腺癌组织中表达显著升高,且SLC7A11高表达与患者总体生存期较差相关[29]。研究表明,has-mir-373和has-mir-372通过竞争结合上调SLC7A11表达,从而调节肺腺癌的免疫浸润[30]。抑制SLC7A11表达可选择性杀死KRAS突变的肺腺癌细胞和抑制体内肿瘤生长,并且SLC7A11可作为PD-L1低表达、EGFR野生型非小细胞肺癌的潜在药物靶标,但这也不能排除可能还有其他机制的参与[31]。Iida等[32]研究发现,SLC7A11可作为中医药治疗肺癌的有效靶点。
3.3 消化系统肿瘤
研究发现,SLC7A11可通过调节β-catenin通路,减弱肿瘤细胞与细胞外基质的黏附,进而促进食管癌细胞转移[22,33]。SLC7A11过表达可导致肿瘤干细胞样表型的上调,进而导致肿瘤复发[34]。一般而言,SLC7A11过表达赋予癌细胞生存优势,而抑制SLC7A11表达则会阻碍肿瘤进展,并为抗癌治疗提供替代方案。因此,抑制SLC7A11表达可减弱胃癌细胞中CD44(一种干细胞主要的调节因子)诱导的5-氟尿嘧啶的化疗耐药性[35]。
研究发现,SLC7A11基因在肝癌组织中的表达水平明显升高,且其高表达与肝细胞癌患者的预后不良相关[36]。由此可见,干预SLC7A11表达可抑制体内外肝癌细胞的生长与增殖。SLC7A11表达下降可致细胞内活性氧水平升高,进而导致肝癌细胞凋亡和自噬死亡[37]。由此表明,SLC7A11可能是肝细胞癌潜在的药物治疗靶点和预后基因之一[17]。
张萌等[38]研究发现,SLC7A11在胰腺癌组织和细胞中的表达分别较癌旁组织和正常细胞显著升高,且与胰腺癌细胞死亡、增殖、转移和侵袭等多种生物学过程密切相关[39-40]。SLC7A11高表达可激活PI3K/Akt通路,进而促进胰腺癌细胞的迁移和侵袭[41]。胰腺癌细胞高度依赖SLC7A11介导的胱氨酸摄取,从而维持细胞内的氧化还原稳态,而SLC7A11高表达致细胞内谷胱甘肽维持高水平,进而抵抗细胞因恶性增殖导致的氧化应激[5]。SLC7A11过表达可增强胰腺癌细胞对顺铂、吉西他滨等化疗药物的耐药性[42]。因此,基于靶向SLC7A11抑制剂的联合用药,可有助于逆转胰腺癌细胞对吉西他滨等的耐药[43]。
此外,王建国等[44]研究发现,肝内胆管细胞癌组织中SLC7A11表达与患者淋巴结转移及预后密切相关,SLC7A11可能在肝内胆管细胞癌侵袭、转移、化疗耐药过程中起重要作用。另有研究表明,SLC7A11蛋白在结直肠癌中表达水平明显升高,并与结直肠癌的分化程度和脉管侵犯相关,低分化且脉管侵犯的患者SLC7A11蛋白表达水平更高,由此提示SLC7A11蛋白高表达可促进结直肠癌的发生发展及增强癌细胞的侵袭能力[45]。System Xc-的另一种抑制剂柳氮磺胺吡啶可通过消耗细胞内谷胱甘肽进而增强结直肠癌细胞对顺铂的敏感性,从而导致活性氧显著积累[46],这可能成为结直肠癌的重要分子靶点。
3.4 乳腺肿瘤和泌尿生殖系统肿瘤
研究表明,SLC7A11在乳腺癌组织中的高表达在介导乳腺癌细胞铁死亡方面起重要作用[47],SLC7A11可促进雌激素受体阳性乳腺癌细胞增殖,并且乳腺癌中SLC7A11高表达预示患者预后不良。Lee等[48]研究发现,GPX4在乳腺癌组织中表达明显上调且与SLC7A11高表达密切相关。此外,SLC7A11与宫颈癌和卵巢癌的发生发展密切相关[49],在卵巢癌中,奥拉帕利通过p53依赖的方式降低SLC7A11蛋白的表达水平,促进细胞铁死亡,抑制肿瘤进展。杜红飞等[50]研究发现,与正常膀胱组织及癌旁组织相比,SLC7A1l在膀胱癌组织中呈高表达,其表达水平与膀胱癌患者的临床T分期密切相关。在膀胱癌中,下调SLC7A11表达致耐药细胞对顺铂的敏感性明显增强[51]。SLC7A11在肾癌中的研究尚浅,部分报道表明SLC7A11在肾癌中呈高表达,而在正常肾组织呈低表达[52],这为SLC7A11作为新的肾癌诊断标志物提供了一定的理论依据。
综上所述,非凋亡形式的细胞死亡方式可能会促进肿瘤细胞被选择性清除,也可能使肿瘤细胞在特定的病理状态下被激活。双硫死亡的发现不仅让人们深层次地认识了新型细胞死亡方式,加深了对细胞稳态的基本理解,还为治疗肿瘤等多种疾病的研究提供了重要思路。大量研究表明SLC7A11是一种潜在的癌基因,参与肿瘤细胞的增殖、迁移、侵袭和凋亡的调控。总结SLC7A11基因在癌症药物治疗方面的应用手段,大致可归纳为三种方式:其一,可通过某些靶向药物阻断剂的干预以阻断胱氨酸转运体的活性,进而减少胱氨酸的补充从而诱导脂质过氧化和细胞死亡,比如细胞铁死亡机制就包含其中;其二,在葡萄糖抑制剂抑制葡萄糖摄取的前提下造成SLC7A11高表达的细胞葡萄糖缺乏,以此耗竭还原型NADPH并造成二硫化物应激状态诱导细胞快速死亡,譬如双硫死亡的发生源自于此;其三,通过使用一些谷氨酰胺酶类抑制剂以减少谷氨酸衍生物的摄取,阻滞细胞生长,有效地提高癌症患者的治疗效果和预后。SLC7A11已成为肿瘤诊断及治疗中潜在的生物标志分子和治疗靶点,双硫死亡概念的提出及调控因子的不断探究,将为高度表达二硫键的蛋白质及具有葡萄糖依赖的肿瘤疾病提供新的研究方向。
4 总结与展望
近年来,调节性细胞死亡方式如双硫死亡、铁死亡及铜死亡等新型细胞死亡方式接连被发现,其中,SLC7A11作为一种热点分子,直接介导双硫死亡、铁死亡等的发生,且已证实其在多种实体肿瘤中广泛过表达并影响肿瘤的发生发展过程。然而,SLC7A11表达在肿瘤中选择性上调涉及多个调控机制,其是否参与特定的细胞死亡方式来调控各肿瘤的发生发展尚未完全明确。此外,多种新型细胞死亡方式的信号通路和主要转录调控因子还需要深入探索,各种细胞死亡方式之间是否独立或是相互联系,以及有无旁路替代等还需要进一步验证。
