胃癌患者外周血miR-34a甲基化的检测及临床意义
2023-10-11李庆妍王自全王丙武王保庆
刘 东,李庆妍,王自全,王丙武,王保庆*
徐州医科大学第二附属医院 1.肿瘤内科;2.药学部,江苏 徐州 221000
胃癌(gastric cancer,GC)是世界上第四大常见的恶性肿瘤之一,在中国胃癌发病率和病死率较高,发现时多为晚期,预后及治疗效果差。因此寻找非侵入性的生物标志物早期发现胃癌,可达到早期预防和诊治的作用。有研究发现表观遗传特别是DNA甲基化的改变在胃癌发生、发展中发挥重要的作用[1]。近年来研究报道microRNA-34(miR-34a/b/c)是TP53基因下游靶标基因,发挥抑癌基因的作用,在多种肿瘤中表达降低,且多为高甲基化沉默[2-3]。目前关于miR-34a基因的甲基化与胃癌的相关研究很少,且未见有关胃癌发生具体CpG甲基化位点的研究报道。基质辅助激光解析电离飞行时间质谱(matrix-assisted laser desorption/ionisation-time-of-flight mass spectrometry,MALDI-TOF MS)技术是国际新兴的甲基化定量检测技术,可完成全基因组甲基化水平和特定CpG位点的甲基化水平定量检测,本文利用MALDI-TOF MS技术筛选与胃癌发生以及与临床特征相关的差异性甲基化CpG位点,为胃癌的早期筛查诊断、预后预测及精准治疗靶点选择提供依据。
1 材料与方法
1.1 对象
1.1.1 一般资料:本研究选取2020年12月至2022年11月由徐州医科大学第二附属医院收治的胃镜确诊胃癌患者31例,其中男性21例,女性10例,年龄范围44~81岁,中位年龄63岁。手术治疗前采集外周血,手术后切除胃癌组织均做HE染色,经光镜观察所有病例均为胃腺癌,由2名以上病理学专家进行组织学复诊,并收集患者详细的临床资料。选择健康体检人群24 例作为对照组,男性14 例,女性10例,20岁~70岁,中位年龄54 岁。所有研究对象包括对照组和胃癌患者组在本课题实施前均签署知情同意书,经徐州医科大学第二附属医院伦理委员会批准(批准文号:[2020]121401)后实施。
1.1.2 主要试剂:引物合成(Thermo Fisher Scientific公司);甲基化DNA亚硝酸盐处理试剂盒(Zymo公司);EpiTYPERTMReagent Kit(Agena公司)。
1.2 方法
1.2.114C尿素呼气试验(urea breath test,UBT)检测幽门螺旋菌(Helicobacterpylori,HP)感染:检查前空腹,UBT检测HP感染情况,严格按照操作要求。检测结果判读:<100 dpm为HP感染阴性,≥100 dpm为HP感染阳性。
1.2.2 MALDI-TOF MS技术甲基化检测步骤
1.2.2.1 DNA提取及亚硫酸氢盐修饰:空腹8 h后,采集静脉血,运用酚/氯仿法提取两组研究对象的外周血DNA。使用Nanodrop ND-2000紫外分光光度仪检测DNA浓度和纯度,确保纯度(A260/A280比值)在1.5~2.2之间,浓度大于50 mg/L。之后进行亚硫酸氢盐修饰,具体操作严格按照试剂盒操作说明,并将其保存在-80 ℃备用。
1.2.2.2 miR-34a基因甲基化引物设计:查询miR-34a基因序列位于1号染色体,位置:9150778~9156777(数据来源:NCBI,GRCh38.p13版本),本研究选取距离转录起始位点-5 000 bp~1 000 bp范围为靶向区域,采用EpiDesigner程序对靶向区域进行引物设计,选择#33引物进行扩增(图1)。正向引物的5′端添加序列aggaagagag(10 bp)。同时,在反向引物的5′端添加T7启动子序列cagtaatacgactcactataggg agaaggct(31 bp)用于后续体外转录,PCR 扩增产物长度为481 bp。正向引物:5′-aggaagagagATTAATAGG TGTTGGGGAGAGGTAG-3′(F),反向引物:5′-cagtaat acgactcactatagggagaaggctCAATACTTAAAACAAACCTTCCTACA-3′(R),扩增引物具体信息见(表1)。
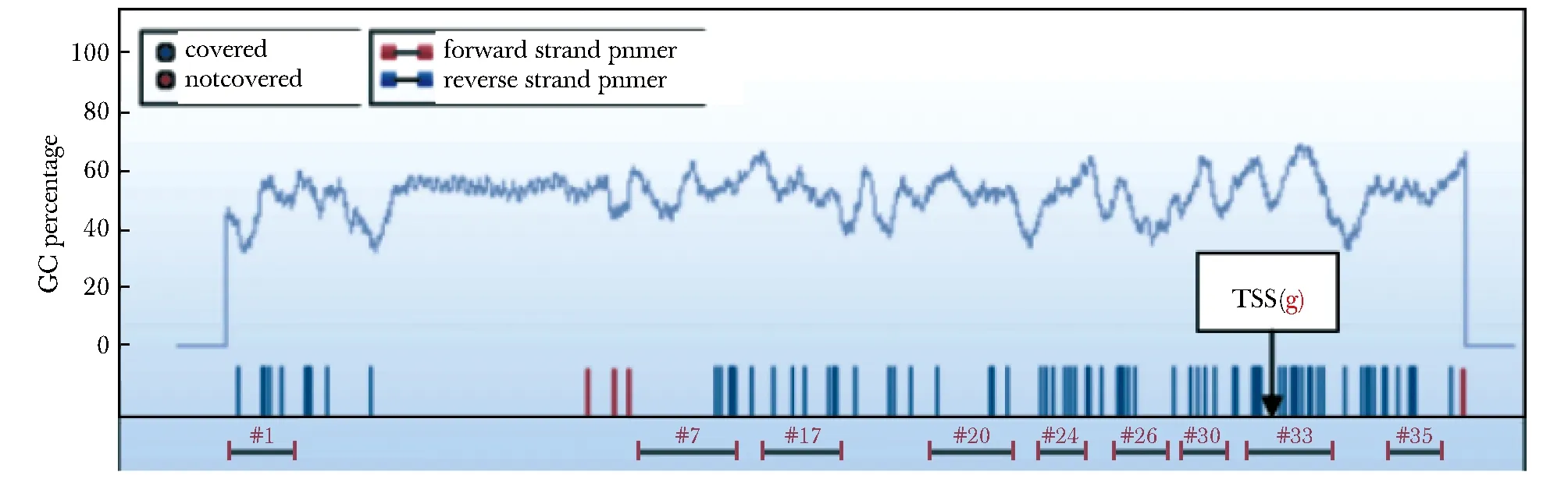
TSS.the transcription starting site图1 miR-34a基因CpG岛靶向区域引物设计Fig 1 Primers design for miR-34a gene CpG island target region
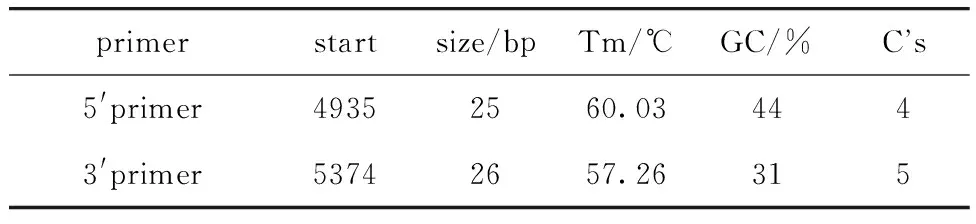
表1 miR-34a甲基化PCR扩增引物信息Table 1 Information about primers used for miR-34a PCR amplification
1.2.2.3 MassARRAY EPI-TYPER DNA甲基化定量分析:采用的MALDI TOF-MS技术基于MassARRAY平台,可实现低至5%的甲基化定量检测。亚硫酸氢盐修饰后DNA经PCR扩增、虾碱性磷酸酶处理、体外转录、酶切等步骤,由MassARRAY Nanodispenser 点样机进行384孔芯片点样。MassARRAY Analyzer 4.0质谱仪对样本进行质谱检测收集质谱图,最后经MassARRAY EpiTYPERTM软件分析质谱图得出具体CpG位点甲基化数据。以上具体检测步骤严格按照制造商的操作要求。
1.3 统计学分析

2 结果
2.1 miR-34a基因甲基化PCR扩增结果
外周血基因组DNA浓度和纯度均达标的样品方可用于亚硫酸氢盐修饰。基因组DNA经亚硫酸氢盐修饰后,PCR扩增产物经琼脂糖凝胶电泳,在目的区域出现扩增片段(图2)。
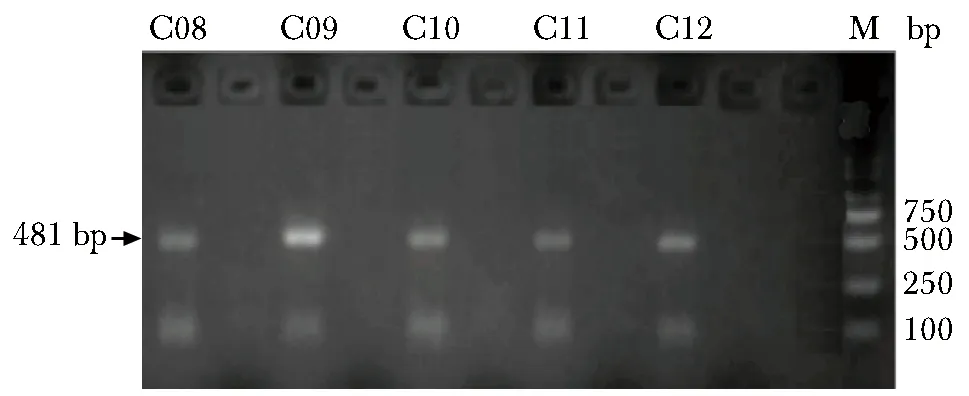
C08-C12.gastric cancer group; M.DNA marker.图2 琼脂糖凝胶电泳检测miR-34a甲基化PCR扩增产物Fig 2 Detection of amplification products of miR-34a methyation PCR by agarose gel electrophoresis
2.2 miR-34a基因甲基化在胃癌与对照组的比较
miR-34a 基因CpG岛#33扩增子经酶切后包含14个CpG单位(15个CpG位点),3个单位CpG_6、CpG_14、CpG_15不能用于分析,因此11个CpG单位可分析,总共包含12个CpG位点,覆盖率达80%(12/15)。miR-34a 11个CpG单位在对照及胃癌患者外周血中呈现不同程度的甲基化,且在胃癌组中甲基化水平均高于对照组。其中miR-34a 2个CpG单位CpG_5、CpG_12.13在胃癌中的平均甲基化率显著高于对照组(51.7%±5.9%vs.37.8%±7.8%,84.61%±8.2%vs.68.1%±12.1%,P<0.01)(图3)。
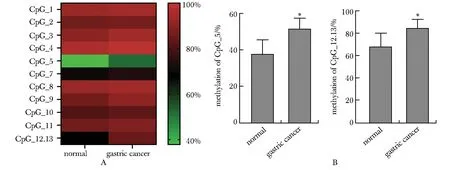
A.heatmap of methylation level of 11 CpG units in miR-34a promoter; B. methylation rate of miR-34a CpG_5 and CpG_12.13 in gastric cancer and normal group.图3 比较胃癌及正常组miR-34a 启动子区11 个CpG单元甲基化水平Fig 3 Comparison of methylation level of 11 CpG units in miR-34a promoter in gastric cancer and normal group
2.3 miR-34a基因甲基化与胃癌患者临床特征及HP感染的相关性
miR-34a CpG_5、CpG_12.13高甲基化与胃癌患者患者年龄、分化程度、发病位置、HP感染均无相关性。miR-34a CpG_5在淋巴结转移组中的甲基化水平要明显高于无淋巴结转移组(P<0.01),CpG_5在Ⅱ期+Ⅲ期中甲基化水平高于Ⅰ期(P<0.05) (表2)。
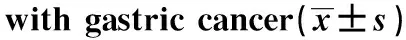
表2 miR-34a基因差异性甲基化CpG位点与胃癌患者临床特征及HP感染的相关性分析Table 2 Correlation analysis of differentially methylated CpG sites of miR-34a gene with clinicopatho- logical features and HP infection in patients
3 讨论
胃癌在组织病理学、发病部位和分子水平上存在广泛的异质性,导致患者的临床管理和预后较为复杂。而针对胃癌的异质性,目前无有效对策,因此需要筛选靶点实施精准医疗策略。越来越多的证据表明DNA甲基化可能与肿瘤的异质性有关[4-5]。既往胃癌表观遗传学研究多集中于蛋白编码基因的甲基化[6]。而microRNA作为一类保守、短序列、单链的非编码小分子RNA,可靶向调控下游多达上百种蛋白质编码基因的表达,在细胞的分化、增殖、凋亡等生物学过程中发挥重要的作用,参与肿瘤的发生和发展[7-8]。miR-34a是miR-34家族的一员,在正常人体组织中普遍表达,是TP53基因的直接下游靶基因,辅助TP53发挥强大抑癌基因作用[9]。目前研究认为miR-34a作为一种肿瘤抑制miRNA,可调控多达700 个下游基因,包括细胞增殖、细胞凋亡、衰老、肿瘤干细胞样细胞表型、迁移或免疫逃避等[10]。miR-34a高甲基化沉默可能导致下游靶标基因的异常,参与实体肿瘤[11]和血液肿瘤[12]的发生和发展。
miR-34a在多种实体肿瘤中表达且呈现一定的组织特异性,而胃癌属于异质性较强的肿瘤。miR-34a高甲基化与胃癌的相关报道较少[13-14],而与胃癌发生、发展相关的差异性甲基化CpG位点也未见报道。MALDI-TOF MS技术可完成基因组甲基化和特定CpG位点的甲基化的检测。本文利用该技术检测胃癌患者及对照组外周血中miR-34a基因甲基化,发现2个CpG单位胃癌中甲基化水平高于对照组,推测miR-34a在胃癌中发挥抑癌基因作用,且高甲基化改变可能与胃癌的发生有关。miR-34a CpG_5在淋巴结转移组以及中晚期(Ⅱ+Ⅲ)TNM分期中甲基化水平均高于无淋巴结转移组和Ⅰ期TNM分期,推测出现miR-34a CpG_5高甲基化的患者更易出现转移风险。这与报道[14]类似,同时也进一步验证了miR-34a在抑制癌细胞侵袭、转移及上皮细胞间充质转化中的调控作用[15]。
本文运用MALDI-TOF MS技术检测胃癌患者及对照人群外周血中miR-34a启动子区域CpG位点甲基化状态,筛选出与胃癌发生和发展相关的CpG位点。限于样本量的原因,研究结果可能有一定的局限性,需要扩大样本进一步证实,而与胃癌预后、miR-34a及其下游靶标基因的相关差异性甲基化位点的探讨,也是课题组后续的研究方向。DNA甲基化是可逆的过程,随着各种去甲基化的新型药物的出现, 虽然将其用于临床治疗仍有一定难度与风险[16],但针对胃癌发生发展相关的特异性CpG位点甲基化进行药物干预,并开展相应的临床试验,也是值得我们去深入研究的方向。
