敲减抗增殖蛋白2促进非小细胞肺癌细胞系A549凋亡
2023-10-11杨自更韦红梅宁海虹薛茜茜
张 婧,杨自更,韦红梅,宁海虹,薛茜茜,金 玲,吴 宾*
新疆军区总医院 1.营养科;2.核医学科;3.卫勤训练中心;4.老年医学科,新疆 乌鲁木齐 830000
肺癌是一种日益严重的公共健康问题,全球每年有220万人被诊断为肺癌,有180万人死于肺癌[1-3]。非小细胞肺癌(non-small cell lung cancer,NSCLC)占所有肺癌病例的85%以上[4]。目前影响NSCLC恶性表型关键分子的相关研究仍然有限,亟需寻找新靶点以改善NSCLC的诊疗现状。
抗增殖蛋白2(prohibitin 2,PHB2)是一种高度保守的胚胎蛋白,参与了细胞生存、代谢和凋亡等许多重要的细胞生物学过程[5]。前期研究发现,敲低PHB2可促进NSCLC细胞系的凋亡[6],然而敲低PHB2诱发细胞凋亡的机制尚不清楚。在人宫颈癌细胞系HeLa细胞中,敲低PHB2可通过诱导线粒体断裂促进HeLa细胞凋亡[7],而PHB2是否通过调控线粒体动力学进一步影响NSCLC细胞系的凋亡尚不清楚。本研究通过慢病毒感染A549细胞建立敲减PHB2的稳转细胞株,探索抑制PHB2促进A549细胞凋亡的新机制。
1 材料与方法
1.1 材料
非小细胞肺癌细胞系A549(上海细胞库);胎牛血清、细胞培养基(RPMI 1640)(BI公司);RIPA裂解液、5×loading buffer、蛋白酶/磷酸酶抑制剂、BCA试剂盒、ATP含量检测试剂盒(上海碧云天生物技术有限公司);蛋白Marker(北京普利莱生物技术有限公司);TUNEL试剂盒(Roche公司);MitoTracker荧光探针(Thermo Fisher Scientific公司);柠檬酸合酶检测试剂盒(Sigma-Aldrich生物科技公司);细胞色素c定量检测试剂盒(R&D生物公司);PHB2抗体(武汉三鹰生物技术有限公司);动力相关蛋白1(dynamin-related protein 1,DRP1)抗体(Santa Cruz公司);p-DRP1(Thr183/Thr185)抗体、HRP标记的二抗(CST公司)。
1.2 方法
1.2.1 慢病毒感染建立敲减PHB2的稳转细胞株:依托吉玛公司设计合成了两个敲减PHB2的慢病毒(分别为shPHB2#1和shPHB2#2)及对照病毒(shCtrl),常规进行慢病毒感染。按预实验摸索的MOI值,嘌呤霉素筛选稳转细胞株。
1.2.2 细胞的分组及处理:慢病毒感染A549细胞,实验分组:对照组(shCtrl),PHB2敲减组#1(shPHB2#1), PHB2敲减组#2(shPHB2#2);DRP1抑制剂Mdivi-1(25 μmol/L)处理敲减PHB2的A549稳转细胞株,实验分为:shCtrl组、shCtrl+Mdivi-1组,shPHB2#1组,shPHB2#2组,shPHB2#1+Mdivi-1组,shPHB2#2+Mdivi-1组。
1.2.3 TUNEL测定细胞凋亡:细胞用4%的甲醛固定,加入通透液,作用10 min。加入TUNEL工作液,避光,37 ℃孵育1 h,DAPI染核。甘油封片,镜下观察,拍照并保存图片。
1.2.4 MitoTracker染色观察线粒体形态:按照说明书配置荧光探针工作液,37 ℃的条件下孵育30 min,镜下观察各组细胞的线粒体形态。
1.2.5 Western blot测定蛋白质表达量:常规提取蛋白质,BCA法定量。按照每孔40 μg蛋白质上样,浓缩胶电泳条件:60~70 V,30 min;分离胶电泳条件:120~130 V,90 min。转膜条件:200~280 mA,1.5~2.5 h。牛奶封闭,孵一抗过夜,次日孵二抗,ECL发光,保存图片。
1.2.6 Annexin V-FITC/PI双染流式实验检测细胞凋亡:取对数增殖期的细胞,用含EDTA的胰蛋白酶消化,1 000 r/min,离心,倒到培养基。预冷的PBS缓冲液洗3遍。细胞重悬,计数,加入适量的FITC标记的annexin V和PI染色液孵育20 min。上机,选取通道,分析细胞凋亡率。
1.2.7 ATP含量、柠檬酸合酶活性及细胞色素c含量的测定:按说明书步骤进行操作,检测相应指标。
1.3 统计学分析
2 结果
2.1 慢病毒感染A549细胞建立稳转细胞株
与shCtrl组相比,shPHB2组PHB2的蛋白表达显著降低(P<0.05)(图1)。
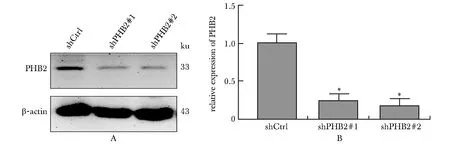
A, B.representative immunoblots and densitometric quantification for PHB2 and β-actin in A549 cells with stable knockdown of PHB2; *P<0.05 compared with shCtrl.图1 各组PHB2蛋白表达的比较Fig 1 Comparison of PHB2 expression among different groups n=3)
2.2 敲低PHB2促进A549细胞凋亡
与shCtrl组相比,shPHB2组TUNEL阳性的细胞数量显著增加(P<0.05)(图2B),annexin V/PI染色显示凋亡率显著增加(P<0.05)(图2D)。
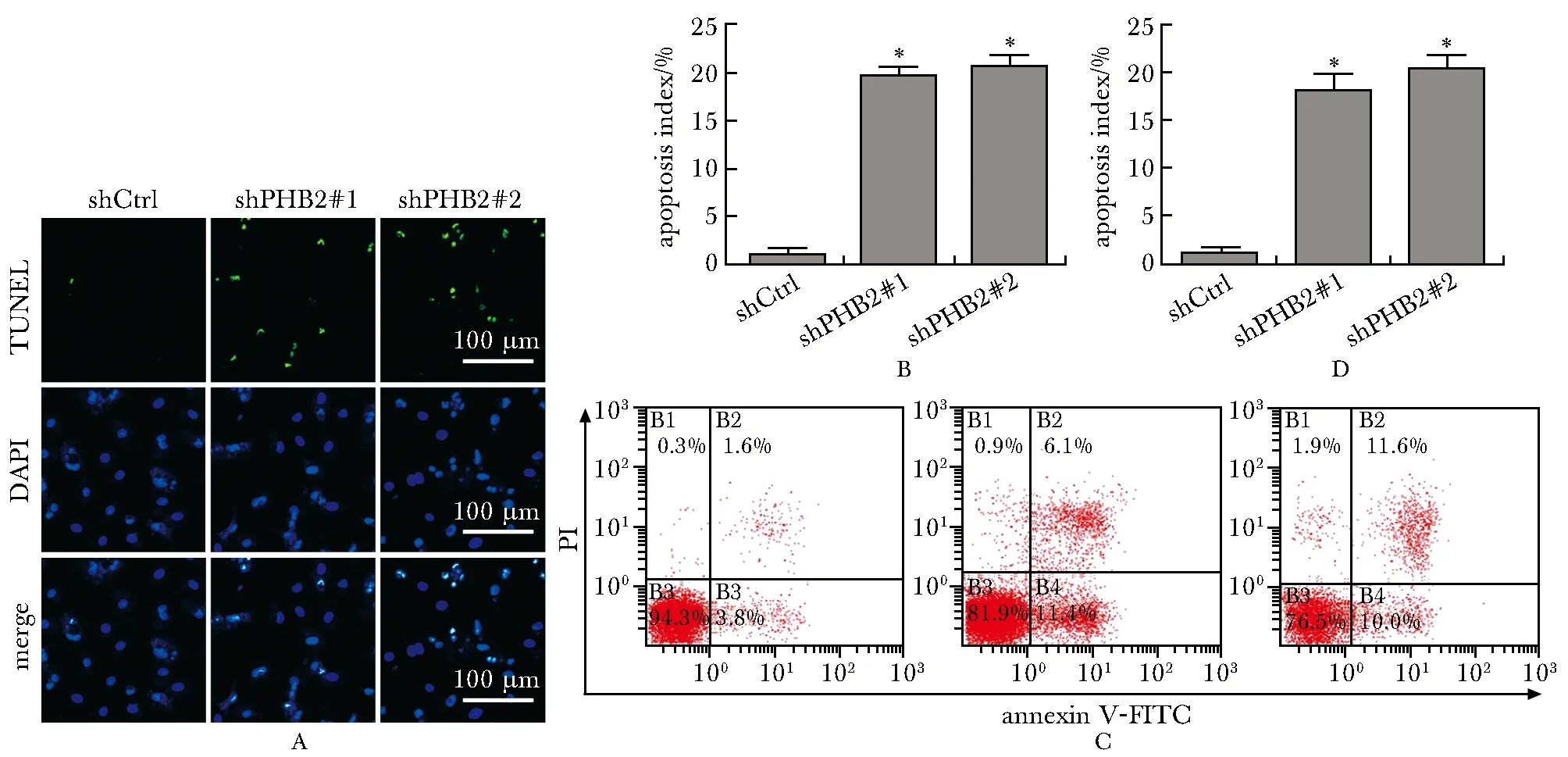
A, B.representative images of the TUNEL assay and quantitative analysis of the apoptotic index for A549 cells with stable PHB2 knockdown;C, D.representative flow cytometry plots of annexin V and PI double staining and quantification of apoptosis for A549 cells with stable PHB2 knockdown; *P<0.05 compared with shCtrl.图2 各组细胞凋亡情况的比较Fig 2 Comparison of apoptotic index among different groups n=3)
2.3 敲低PHB2引发A549细胞线粒体功能受损
与shCtrl组相比,shPHB2组ATP含量减少(P<0.05),柠檬酸合酶活性降低(P<0.05),线粒体内细胞色素c减少(P<0.05),细胞质内细胞色素c增加(P<0.05)(图3)。
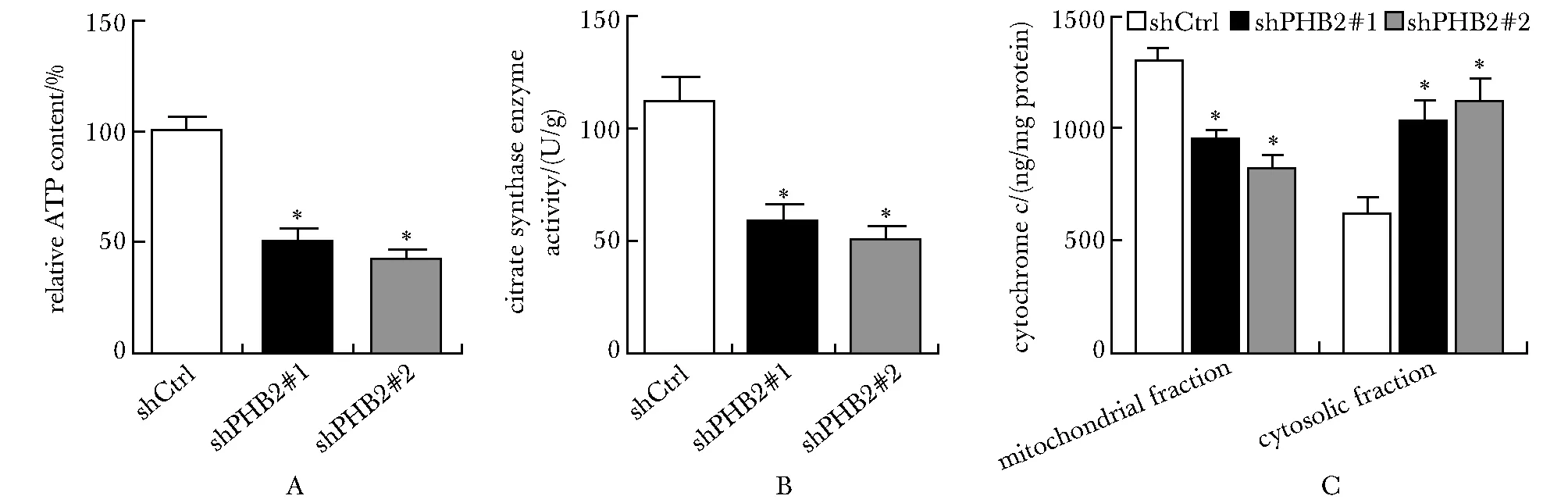
A, B.ATP content and citrate synthase (CS) in mitochondria isolated from A549 cells from the respective groups;C.levels of cytochrome c in cytosolic and mitochondrial fractions from the respective groups; *P<0.05 compared with shCtrl group.图3 各组ATP含量、柠檬酸合酶活性、细胞色素c水平的比较Fig 3 Comparison of ATP content, CS activity and cytochrome c content among different groups n=3)
2.4 敲低PHB2促进A549细胞线粒体分裂
与shCtrl组相比,shPHB2组线粒体长度变短(P<0.05),线粒体分裂显著增加,p-DRP1表达显著增加(P<0.05)(图4)。
2.5 Mdivi-1可减轻敲低PHB2引发的A549细胞线粒体分裂
与shPHB2组相比,shPHB2+Mdivi-1组线粒体长度显著增加(P<0.05),线粒体分裂程度减轻(图5)。
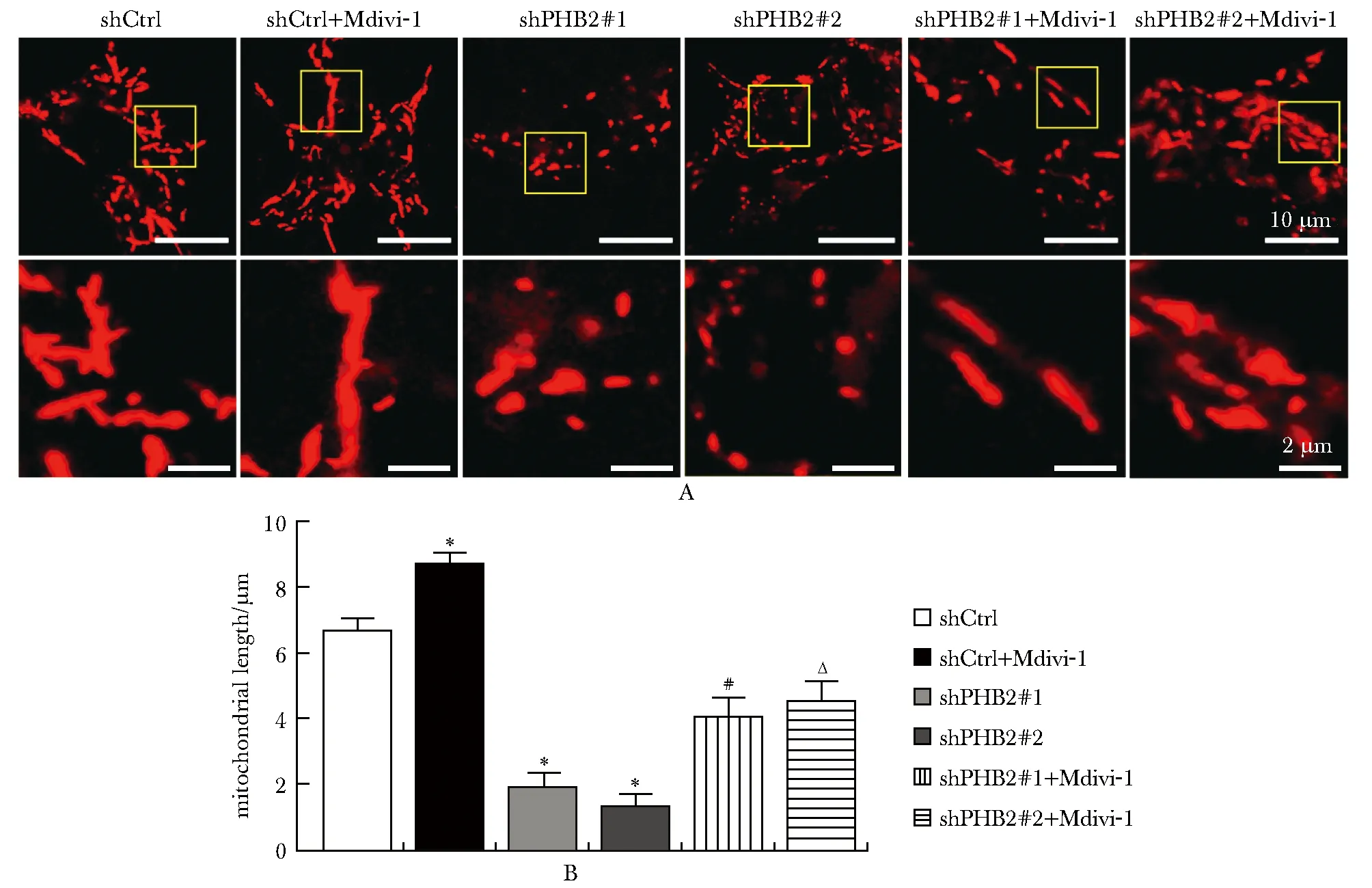
A.representative confocal images of mitochondrial morphology subjected to different treatments were detected by MitoTrackerTM Red CMXRos probe in A549 cells.B.quantification of mitochondrial length in A549 cells from the respective groups reflecting the levels of mitochondrial division; *P<0.05 compared with shCtrl; #P<0.05 compared with shPHB2#1; ΔP<0.05 compared with shPHB2#2.图5 各组线粒体形态的比较Fig 5 Comparison of mitochondrial morphology among different groups n=3)
2.6 Mdivi-1可减轻敲低PHB2引发的A549细胞凋亡
与shPHB2组相比,shPHB2 +Mdivi-1组TUNEL阳性的细胞数量显著减少,凋亡率显著降低(P<0.05)(图6)。
2.7 Mdivi-1可减轻敲低PHB2引发的A549细胞线粒体功能受损
与shPHB2组相比,shPHB2+Mdivi-1组ATP含量增加(P<0.05),柠檬酸合酶活性增加(P<0.05),线粒体内细胞色素c增加(P<0.05),细胞质内细胞色素c的减少(P<0.05)(图7)。
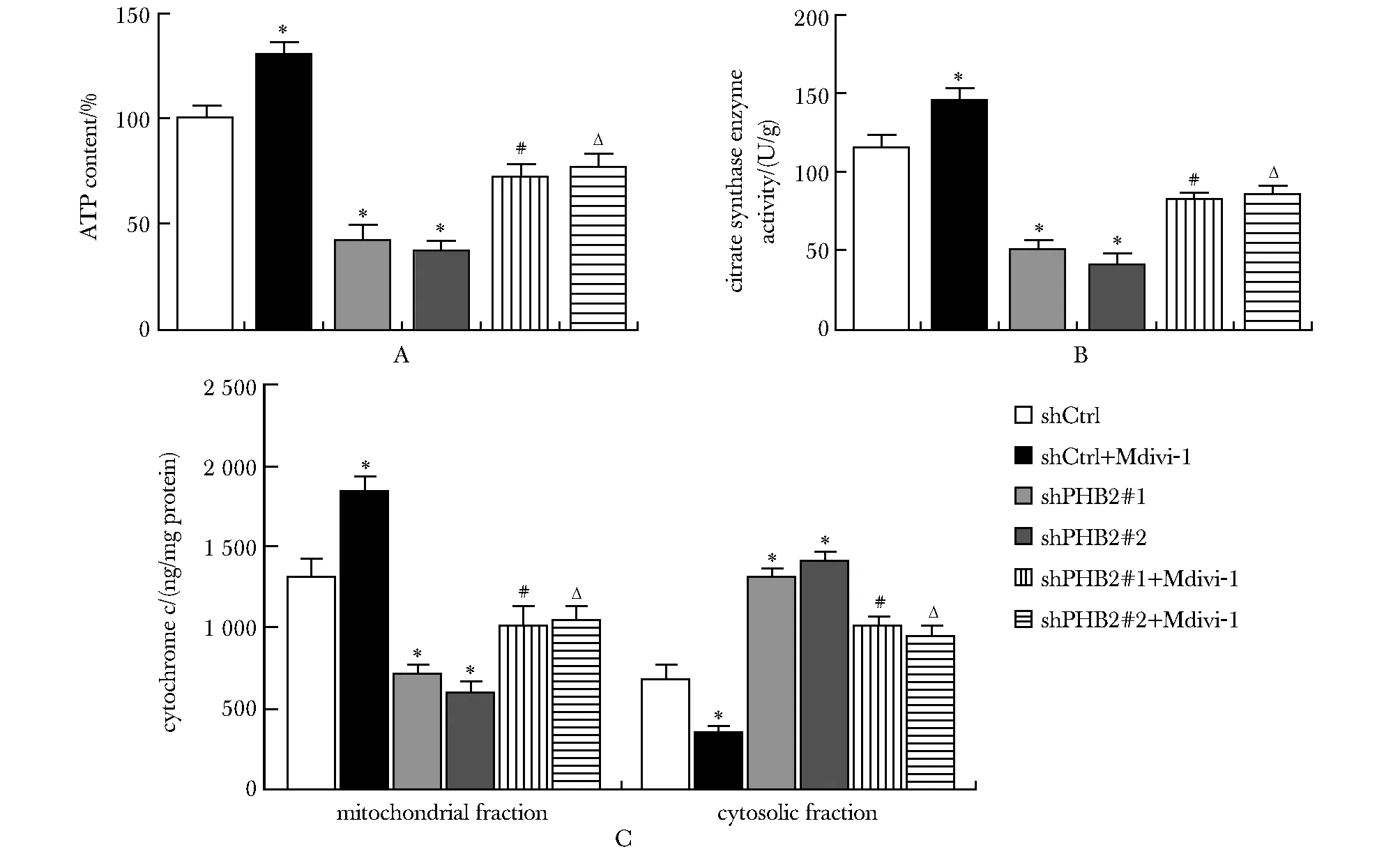
A, B.ATP content and citrate synthase (CS) in mitochondria isolated from A549 cells from the respective groups;C.levels of cytochrome c in cytosolic and mitochondrial fractions from the respective groups; *P<0.05 compared with shCtrl; #P<0.05 compared with shPHB2#1; ΔP<0.05 compared with shPHB2#2.图7 各组ATP含量、柠檬酸合酶活性、细胞色素c水平的比较Fig 7 Comparison of ATP content, CS activity and cytochrome c content among different groups n=3)
3 讨论
越来越多的证据显示,PHB2作为促癌因子通过不同途径参与肿瘤增殖和诱发凋亡的病理生理过程[8-10]。前期研究发现,PHB2表达与NSCLC肿瘤分化、淋巴结转移和临床分期具有相关性,同时PHB2的蛋白表达影响NSCLC的生物学行为。过表达PHB2可促进NSCLC细胞的增殖、迁移和侵袭,而敲低PHB2可抑制NSCLC细胞的增殖、迁移和侵袭及促进细胞凋亡[6]。本研究发现,敲减PHB2可促进A549细胞凋亡,这与前期研究结论相一致[6]。
在HeLa细胞中,敲低PHB2可通过下调抗凋亡因子Hax-1和诱导线粒体断裂,从而诱发caspase依赖的凋亡[7],这提示PHB2可能通过调控线粒体动力学进而诱发内源性的细胞凋亡。线粒体动力学是线粒体裂变和融合的重要过程,融合和裂变必须平衡才能实现有效的内容交换,而异常的线粒体动力学已被证明与癌、衰老、糖尿病等密切相关[11-13]。 特别是线粒体分裂已经被认为是肿瘤中线粒体介导凋亡的重要调控上游因子[12]。线粒体分裂可导致早期线粒体功能障碍,进一步引发线粒体生物学紊乱、细胞色素c释放、caspase酶激活和凋亡级联反应[11]。本研究发现,敲低PHB2导致线粒体分裂增加,同时ATP含量减少,柠檬酸合酶活性降低,细胞色素c由线粒体向细胞质内转移,说明敲低PHB2可促进线粒体分裂进一步引发线粒体生物学紊乱和凋亡级联反应,这与文献报道相一致[11]。
DRP1是线粒体分裂的一个主要调控因子,它由高度保守的鸟苷三磷酸酶(guanylate triphos-phatase,GTPases)调控[14]。DRP1主要存在于细胞质中,DRP1(Ser616)磷酸化导致DRP1激活,DRP1由细胞质转位到线粒体表面,进一步介导线粒体分裂[15]。本研究发现,敲低PHB2导致DRP1磷酸化增加,而Mdivi-1可逆转敲PHB2引发的A549细胞凋亡,提示Mdivi-1可能通过抑制DRP1介导的线粒体分裂来改善线粒体生物学紊乱,抑制线粒体途径的凋亡级联反应,这与文献报道相一致[14]。
综上所述,抑制PHB2促进非小细胞肺癌A549细胞凋亡,其机制可能与激活了DRP1介导的线粒体分裂有关。PHB2/DRP1信号通路可能是NSCLC治疗的重要新靶点,本研究为PHB2用于NSCLC治疗药物研发提供了一定的实验依据。
