IL-6促进小鼠小胶质细胞系BV2坏死性凋亡
2023-10-11郑建滨吴少华黄玉景
郑建滨,吴少华,黄玉景
宁德师范学院附属宁德市医院 麻醉科,福建 宁德 352100
神经炎性反应常导致神经损伤和死亡,并驱动多种神经退行性疾病(如阿尔茨海默病和帕金森病)的进展和恶化,以及视网膜变性[1],因此调控神经炎性反应成为神经退行性疾病的一种有希望的策略,因为它有可能阻止神经损伤的持续发生。
小胶质细胞存在于脑和脊髓中,参与中枢神经系统的炎性反应过程[2],并且在体内平衡和疾病的交叉路口发挥细胞毒性和细胞保护作用[3-5]。脂多糖 (lipopolysaccharide,LPS) 诱导的M1小胶质细胞通过产生促炎介质来增强炎性反应[3]。坏死性凋亡是一种会引发炎性反应的坏死细胞死亡的形式,活化的小胶质细胞/巨噬细胞也诱导慢性炎性反应部位的坏死性凋亡,从而形成正反馈环[4]。
1 材料与方法
1.1 材料
1.1.1 细胞:小鼠小胶质细胞系BV2(中国典型培养物保藏中心)。
1.1.2 试剂:RPMI 1640培养基(Hyclone公司),胎牛血清(Gibco公司),LPS (Sigma-Aldrich公司),IL-6拮抗剂siltuximab(Selleck Chemicals公司),CCK-8反应试剂(碧云天生物技术公司),Trizol试剂(Invitrogen公司),PrimerScript RT Master Mix,SYBR Premix Ex Taq (Takara公司),BCA蛋白质测定试剂盒与ABI 7500荧光定量PCR仪(Thermo Fisher Scientific公司)。蛋白抗体(p-STAT3、STAT3、p-JAK、JAK、RIP1、RIP3、GAPDH一抗和羊抗兔二抗IgG)(Abcam公司)。
1.2 方法
1.2.1 BV2细胞的分组与处理:BV2细胞培养于RPMI 1640培养基添加10%胎牛血清的培养其中,每24 h更换1次培养基,当达到70%~80%汇合时,对细胞进行传代培养或冷冻保存。为建立小胶质细胞神经炎性反应体外模型,使用1 μg/mL LPS处理BV2细胞24 h,进一步使用1 μg/mL 的IL-6拮抗剂siltuximab处理细胞24 h[5]。
1.2.2 CCK-8法检测细胞增殖:将细胞接种到96孔板中(3×103个细胞/孔)并在37 ℃下培养。分别培养0、24、48和72 h后,向每个孔中加入10 μL CCK-8反应试剂。37 ℃孵育4 h后,检测450 nm处的吸光度,绘制细胞增殖曲线。
1.2.3 流式细胞测量术检测细胞凋亡:调整细胞浓度为5×108/L,加入5 μL annexin V-APC and 5 μL 7-AAD,在室温避光孵育15 min,用流式细胞仪检测细胞凋亡。
1.2.4 RT-qPCR检测mRNA表达水平:按照说明书,使用Trizol试剂从培养的细胞中分离出总RNA。用PrimerScript RT Master Mix将1 μg RNA反转录为cDNA。然后根据说明书用SYBR Premix Ex Taq在 ABI 7500上进行RT-qPCR实验,Gapdh作为内参,通过2-ΔΔCt[6]法分别计算基因的相对表达量。PCR引物(表1)。

表1 RT-qPCR引物序列Table 1 Primer sequence of RT-qPCR
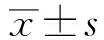
1.3 统计学分析
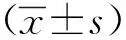
2 结果
2.1 LPS诱导建立小胶质细胞炎性反应模型
LPS诱导后,BV2细胞的增殖活力显著降低(P<0.01)(图1A),而BV2细胞凋亡显著增加(P<0.01)(图1B)。此外,促炎因子IL-6与TNF-α均含量增加(P<0.01)(图1C)。
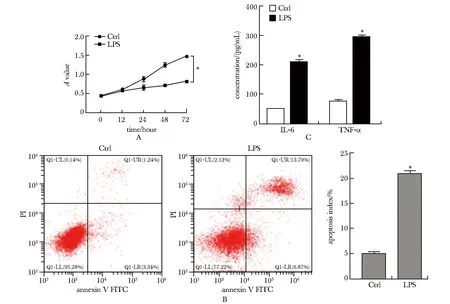
A.the cell proliferation was detected by CCK-8 assay; B.flow cytometry was used to detect cell apoptosis; C.ELISA assay was used to detect the content of pro-inflammatory cytokines IL-6 and TNF-α; *P<0.01 compared with Ctrl.图1 LPS诱导建立小胶质细胞炎性反应模型Fig 1 LPS-induced microglial inflammation model n=3)
2.2 LPS诱导小胶质细胞M1极化
LPS诱导后,M1极化标志物IL-1β和IFN-γ表达上调,而M2极化标志物CD206和Arg-1表达下调(P<0.01)(图2)。
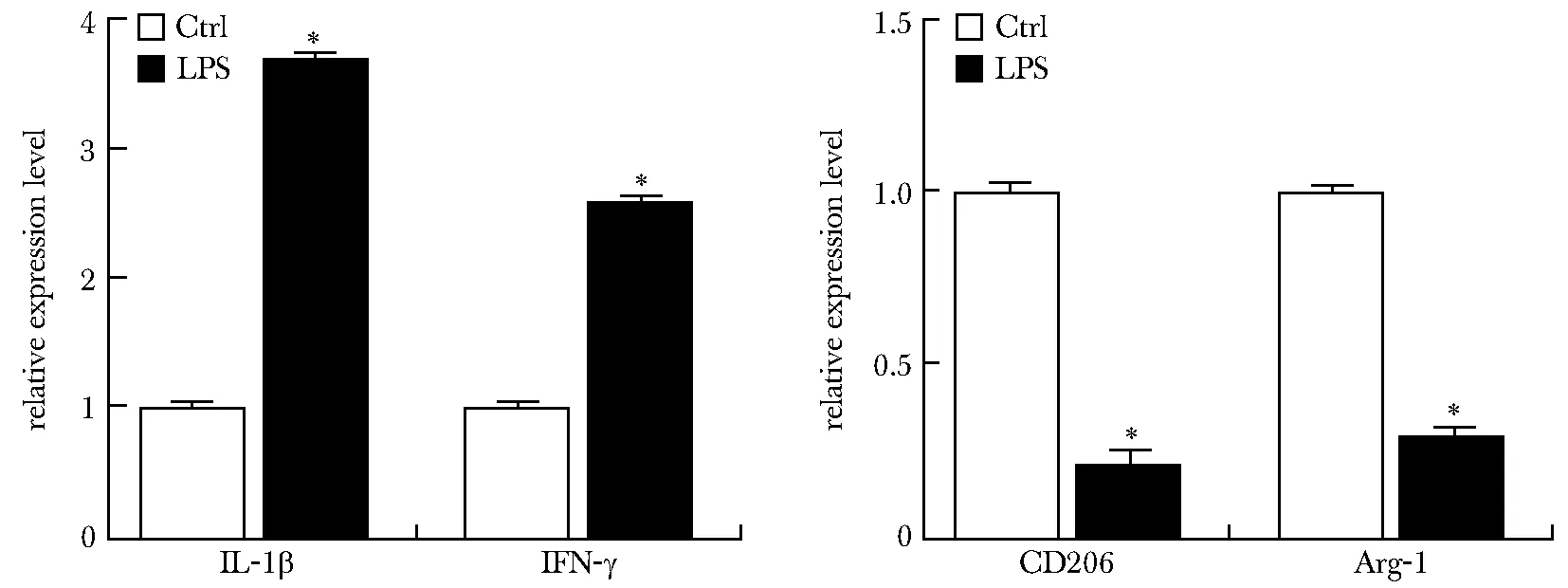
The expression of M1 polarization markers IL-1β and IFN-γ and M2 polarization markers CD206 and Arg-1 in BV2 cells was detected by *P<0.01 LPS compared with Ctrl.图2 LPS诱导小胶质细胞M1极化Fig 2 LPS induced microglia M1 polarization n=3)
2.3 IL-6激活JAK-STAT3通路调节神经炎性反应中小胶质细胞坏死性凋亡
LPS诱导促进了JAK-STAT3信号通路的磷酸化,上调坏死性凋亡相关蛋白RIP1和RIP3(P<0.01);但使用IL-6拮抗剂塞妥昔单抗处理后,上述蛋白表达变化均被部分逆转(P<0.01)(图3)。
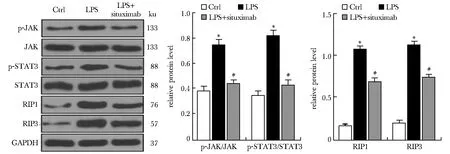
LPS-induced BV2 cells were treated with IL-6 antagonist siltuximab, and the phosphorylation of key proteins in the JAK-STAT3 pathway and the expression of necroptosis-related proteins RIP1 and RIP3 were detected by Western blot; *P<0.01 compared with Ctrl; #P<0.01 compared with LPS.图3 IL-6激活JAK-STAT3通路调节神经炎性反应中小胶质细胞坏死性凋亡Fig 3 IL-6 activated JAK-STAT3 pathway to regulate necroptosis of microglia in neuroinflammatory response
3 讨论
与其他中枢神经系统的细胞不同,小胶质细胞来源于卵黄囊中的造血干细胞,是对中枢神经系统病原体或损伤做出反应的初级细胞。类似于巨噬细胞, 小胶质细胞可极化为M1表型(例如被LPS诱导)以产生促炎介质[7]。相反, 抗炎细胞因子IL-4在鼠卒中模型中引起保护性M2小胶质细胞群的形成[8]。控制小胶质细胞的M1/M2极化的介质有望调节神经炎性反应。
在神经炎性反应条件下,小胶质细胞释放炎性细胞因子,如TNF-α、IL-6和IL-1β,导致神经炎性反应患者的突触功能障碍和神经元死亡[9]。IL-6是神经血管功能障碍、神经退行性变和(或)神经炎性反应的重要介质。JAK/STAT3的早期激活主要由小胶质细胞中的IL-6诱导,并有助于疾病的发展[10]。STAT3是JAK/STAT信号家族的成员,在中枢神经系统中表达,其活性磷酸化形式在中枢神经系统损伤后上调,并参与小胶质细胞炎性反应[10]。这与本实验中所探究的结果相一致。
坏死细胞的死亡也可以是一个受调控的过程,这就是所谓的坏死性凋亡[11]。坏死性凋亡由含坏死体的受体相互作用蛋白1(receptor-interacting protein 1,RIP1)、RIP3和混合谱系激酶结构域样蛋白 (MLKL) 介导。在某些病理条件下,RIP1将被激活,并通过RIP同型相互作用基序 (RIP homotypic interaction motif, RHIM) 与RIP3结合,形成淀粉样蛋白复合物,称为复合物IIb。复合物IIb中活化的RIP3进一步磷酸化下游分子MLKL,在质膜上形成寡聚体和聚集体,通过质膜破裂和细胞溶解引起坏死性凋亡。随后,大量的细胞内容物如损伤相关分子模式(dam-age-associ-ated molecular patterns, DAMPs) 被释放,引起继发性炎性反应加重组织损伤[12-13]。而本研究观察到拮抗IL-6后,可以抑制小胶质细胞的坏死性凋亡。
本研究仅仅只在细胞层面探究了IL-6介导的JAK/STAT3通路可以影响小胶质细胞的坏死性凋亡。在今后研究中,将进一步在动物实验中验证该通路调控机制,以期为临床上小胶质细胞相关疾病的治疗提供新的思路。
