PPARα缺失加重乙醇诱导的小鼠胃黏膜慢性损伤
2023-10-11张旭光
胡 晓,郭 然,张旭光
1.河北医科大学 基础医学院 病理生理学教研室,河北 石家庄 050017;2.河北医科大学附属第二医院 普外三科,河北 石家庄 050004;3.日本信州大学医学部 代谢调控学研究室,日本 松本 390-0803
乙醇是各类饮用酒的主要成分,进入体内后部分通过胃黏膜扩散吸收,但浓度过大或停留时间过长均可导致胃黏膜屏障功能受损[1]。长期摄入乙醇会刺激黏膜下血管内皮损伤和中性粒细胞的活化,引起胃黏膜内炎性介质和细胞因子的释放水平升高,促进胃内慢性炎性反应的发生[2]。近年来中国酒类产量和饮酒人群的比例逐年增加,酒精相关性胃炎的发病率也是居高不下[3]。
过氧化物酶体增殖物激活受体α(peroxisome proliferator-activating receptor α, PPARα)属于核受体转录因子超家族的成员,在脂质氧化、细胞信号转导等过程中发挥着重要的生物学功能[4]。有文献指出PPARα的激活在调节肠道炎性反应、提高肠黏膜抗氧化能力等方面发挥了显著的调控作用[5]。在PPARα基因敲除小鼠构建的慢性酒精性肝损伤模型研究中发现,PPARα缺失可导致乙醇诱导的肝内脂肪蓄积程度加重,造成更严重的肝内炎性损伤[6]。PPARα在胃黏膜内也有表达,但在酒精持续损伤胃黏膜的过程中,PPARα是否能够发挥抗损伤效应尚不清楚。因此,长期摄入乙醇的情况下,通过观察PPARα的缺失是否会加重胃黏膜损伤,有助于阐明PPARα在胃内是否发挥保护作用。
1 材料与方法
1.1 材料
1.1.1 试剂及试剂盒:Lieber-DeCarli液体饲料(日本东方酵母工业株式会社);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白介素-1β(interleukin-1β, IL-1β)ELISA检测试剂盒,丙二醛(malondialdehyde, MDA)比色法定量检测试剂盒(OxisResearch公司);总RNA提取试剂盒、cDNA第一链合成试剂盒和RT-PCR(SYBR Green)Pre-Mix试剂(Takara公司);抗NF-κB-p65抗体(Cell Signaling Technology公司);Histone H1抗体(Santa Cruz Biotechnology公司);碱性磷酸酶标记的IgG二抗(Jackson ImmunoResearch公司);细胞核蛋白提取试剂盒,BCA蛋白定量试剂盒和1-StepTMNBT/BCIP 底物溶液(Thermo Fisher公司)。
1.1.2 动物:SPF级Sv129品系的野生型小鼠和PPARα敲除型小鼠各10只[7],饲养于日本信州大学医学部实验动物中心。
1.2 方法
1.2.1 动物的分组及处理:将小鼠分为野生型对照饮食组(WT-Con,n=4)、野生型乙醇饮食组(WT-EtOH,n=6)、PPARα敲除型对照饮食组(KO-Con,n=4)和PPARα敲除型乙醇饮食组(KO-EtOH,n=6)。WT-EtOH组和KO-EtOH组给予含4%乙醇的Lieber-DeCarli液体饲料,WT-Con组和KO-Con组则同时给予对照Lieber-DeCarli液体饲料。对于小鼠的饲养和实验方式遵循美国国立卫生研究院颁布的《实验动物护理和使用指南》,经日本信州大学医学部动物实验指导方针研究委员会批准。饲养期间各组小鼠自由摄食,无意外死亡情况。饲养16周后,取胃组织。
1.2.2 HE染色检查胃组织病理学:采用5%多聚甲醛固定小鼠胃组织,24 h后常规石蜡包埋,制作厚度为5 μm的切片。采用常规HE染色,使用中性胶封片,制成病理切片。通过光学显微镜观察胃组织形态学病理变化。
1.2.3 ELISA检测血清的TNF-α和IL-1β水平:取小鼠腹主动脉血液样本1.5 mL,在4 ℃、3 000 r/min离心15 min,取上清液。按照制造商的说明,用ELISA试剂盒测定血清中TNF-α和IL-1β的水平。
1.2.4 血清及胃组织中MDA的检测:取小鼠腹主动脉血液样本1.5 mL,在4 ℃、3 000 r/min离心15 min,取上清液。取小鼠胃组织称重,按质量(g)∶体积(mL)=1∶9加入预冷生理盐水,机械匀浆后,3 500 r/min离心15 min,吸取上清液制备成组织匀浆。制造商的试剂盒说明,测定血清及组织匀浆中MDA的含量。MDA在血清中的含量表示为μmol/L,在胃组织匀浆中的含量表示为nmol/g。
1.2.5 实时荧光定量PCR(RT-qPCR)检测胃组织内炎性相关基因,TNF-α、IL-1β和细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)的表达:取小鼠胃组织在液氮条件下研磨成组织匀浆。采用TRIzol法提取组织匀浆内总RNA,并测定RNA浓度和纯度。按照反转录试剂盒的说明书严格操作,进行反转录PCR反应合成cDNA。实时荧光定量PCR反应严格按照试剂说明书配置反应体系,充分混匀放入实时荧光定量PCR仪,扩增条件为:95 ℃变性15 s,60 ℃退火/延伸30 s,延伸阶段采取荧光值,于40个循环后进行熔解曲线分析。GADPH作为内参基因,采用2-ΔΔCt法分析各个检测基因的相对表达量。引物序列GADPH正向: 5′-TGCACCACCAACTGCTTAG-3′,反向:5′-GGATGCAG GGATGATGTTCTG-3′; TNF-α正向:5′-CCACCACGC TCTTCTGTCTAC-3′,反向:5′-AGGGTCTGGGCCATA GAACT-3′; IL-1β正向:5′-TGAAGCAGCTATGG CAACTG-3′,反向:5′-AGGTCAAAGGTTTGGAAGC A-3′;ICAM-1正向:5′-ACCCAC CTCACAGGGTACT T-3′,反向:5′-CCAGGTGAGGAC CATATAGCAC-3′。
1.2.6 Western blot法检测胃组织内NF-κB通路相关蛋白的表达:在液氮条件下,取小鼠胃组织制备成组织匀浆。使用试剂盒提取组织匀浆中的核蛋白,并采用BCA法对蛋白浓度进行定量分析。每孔加入30 μg蛋白进行SDS-PAGE后并转移至PVDF膜上,用5%的脱脂奶粉进行封闭,之后分别加入兔源抗p65一抗在4 ℃孵育过夜。经TBST洗涤3次,加入碱性磷酸酶标记的山羊抗兔二抗,室温孵育1 h。经TBST洗涤3次,使用NBT/BCIP底物溶液显影并得到蛋白条带。Histone H1作为内参蛋白,使用Image J软件对各个条带的吸光度值进行分析,计算蛋白的相对表达水平。
1.3 统计学分析
2 结果
2.1 PPARα缺失加重乙醇饮食组小鼠的胃黏膜组织损伤
WT-Con组和KO-Con组小鼠的胃黏膜上皮完整,腺体规则。WT-EtOH组小鼠偶可见上皮细胞丢失和少量炎性细胞浸润。但KO-EtOH组小鼠的胃黏膜上皮层出现明显缺损和水肿,胃小凹消失,固有层内腺体结构异常,出现大量肿胀透明的退化细胞,黏膜全层均出现大量的炎性细胞浸润(图1)。

图1 各组小鼠胃组织病理学改变(HE染色)Fig 1 Changes of mouse gastric tissue pathology in each group (HE staining)
2.2 PPARα缺失增加乙醇饮食组小鼠血清中TNF-α和IL-1β的水平
KO-Con组与WT-Con组小鼠相比, TNF-α和IL-1β的含量无显著变化;与WT-Con组相比,WT-EtOH组小鼠血清中TNF-α和IL-1β的含量显著增高(P<0.001);与KO-Con组相比,KO-EtOH组小鼠血清中TNF-α和IL-1β的含量显著增高(P<0.001);相较于WT-EtOH组,KO-EtOH组小鼠血清中TNF-α和IL-1β的含量进一步显著升高(P<0.05)(图2)。
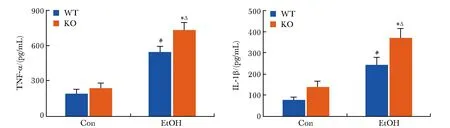
#P<0.001 compared with WT-Con group; *P<0.05 compared with WT-EtOH group;ΔP<0.001 compared with KO-Con group.图2 KO-EtOH组小鼠血清中TNFα和IL-1β的含量增多Fig 2 Increased content of TNFα and IL-1β in serum of PPARα-knockout mice in ethanol-diet group
2.3 PPARα缺失增强乙醇饮食组小鼠胃组织内的脂质过氧化水平
KO-Con组与WT-Con组小鼠相比,MDA水平无明显变化;与WT-Con组相比,WT-EtOH组小鼠血清和胃组织中MDA的含量明显增高(P<0.01);与KO-Con组相比,KO-EtOH组小鼠血清和胃组织中MDA的含量明显增高(P<0.001);相较于WT-EtOH组,KO-EtOH组小鼠血清和胃组织中的MDA含量均进一步明显升高(P<0.05)(图3)。
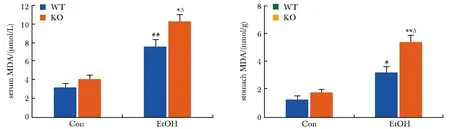
#P<0.01, ##P<0.001 compared with WT-Con group; *P<0.05,**P<0.01 compared with WT-EtOH group;ΔP<0.001compared with KO-Con group.图3 KO-EtOH组小鼠血清和胃组织中MDA的含量增多Fig 3 Increased content of MDA in serum and stomach of PPARα-knockout mice in ethanol-diet group
2.4 PPARα缺失上调乙醇饮食组小鼠胃组织内的炎性相关因子的mRNA表达水平
KO-Con组与WT-Con组相比,小鼠胃组织中炎性相关因子的mRNA表达水平无明显变化;与WT-Con组相比,WT-EtOH组小鼠胃组织中TNF-α、IL-1β和ICAM-1的mRNA表达水平显著增高(P<0.01);与KO-Con组相比,KO-EtOH组小鼠胃组织中TNF-α、IL-1β和ICAM-1的mRNA表达水平显著增高(P<0.001);相较于WT-EtOH组,KO-EtOH组小鼠胃组织中TNF-α、IL-1β和ICAM-1的mRNA表达水平均进一步显著增高(P<0.05)(图4)。

#P<0.01, ##P<0.001 compared with WT-Con group; *P<0.05, **P<0.01 compared with WT-EtOH group;ΔP<0.001 compared with KO-Con group.图4 KO-EtOH组小鼠胃组织中炎性相关因子的mRNA表达水平上调Fig 4 Elevated mRNA expression levels of inflammatory factors in gastric tissue of PPARα-knockout mice in ethanol-diet group
2.5 PPARα缺失引起乙醇饮食组小鼠胃组织NF-κB通路相关蛋白的表达水平升高
与WT-Con组相比,KO-Con组和WT-EtOH组小鼠的胃组织中的胞核p65蛋白表达水平均明显上调(P<0.05;P<0.01); KO-EtOH组与KO-Con组相比,小鼠胃组织中的胞核p65蛋白表达水平无明显变化;相较于WT-EtOH组,KO-EtOH组小鼠胃组织中的胞核p65蛋白的表达水平进一步明显升高(P<0.01)(图5)。

#P<0.05, ##P<0.01 compared with WT-Con group; *P<0.01 compared with WT-EtOH group.图5 KO-EtOH组小鼠胃组织中的核p65蛋白表达水平上调Fig 5 Elevated protein expression levels of nuclear p65 in gastric tissue of PPARα-knockout mice in ethanol-diet group
3 讨论
在长期喂饲乙醇的PPARα敲除小鼠模型中观察到,缺失PPARα的小鼠胃黏膜出现更为严重的组织学改变及炎性浸润,血中和胃组织中的炎性因子TNF-α、IL-1β及ICAM-1的转录和释放增多,胃内脂质过氧化反应增强,其机制可能与PPARα的缺失引起胃内NF-κB信号通路激活有关。上述实验结果证明,缺失PPARα会加重乙醇诱导的胃黏膜慢性损伤。
长期频繁接触乙醇可破坏胃黏膜屏障,诱导炎性细胞的聚集和活化,引发炎性反应[2,8]。既往研究发现,TNF-α、IL-1β和ICAM-1可通过诱导炎性细胞的活化和迁移,介导中性粒细胞在血管内皮的黏附等方式促进乙醇诱导的胃黏膜炎性反应启动和放大[9-10]。PPARα在诸多病理模型中的抗炎性损伤作用已被证实。在酒精性肝病小鼠模型中,小鼠肝内仅部分表达PPARα即可下调TNF-α和IL-1β的表达水平,肝脏病理损伤也相对减轻[11];PPARα激动剂可抑制血管内皮细胞过表达ICAM-1[12]。根据实验结果显示,长期摄入乙醇引起小鼠血中TNF-α含量明显增多,而缺失PPARα则引起血中TNF-α和IL-1β进一步增多,并引起胃组织中TNF-α、IL-1β和ICAM-1的转录水平进一步增强。有文献指出,PPARα能够抑制NF-κB亚单位RelA(p65)的转导活性从而抑制NF-κB信号通路,降低下游炎性因子的表达[4]。上述机制在实验结果中也得以体现:缺失PPARα引起细胞核内p65的表达明显上调。这些结果说明,缺失PPARα可导致胃内NF-κB信号通路活化,进而引起TNF-α、IL-1β和ICAM-1的表达和释放增多。
乙醇刺激氧自由基生成过多,进而诱导脂质过氧化损伤也是发病的关键因素[13-14]。而PPARα可以通过增强线粒体能量代谢的方式对抗过氧化损伤[15]。通过实验结果可见,乙醇喂养的PPARα敲除组小鼠的血中和胃内MDA含量明显升高,提示PPARα的缺失引起胃黏膜脂质过氧化反应增强。
综上所述,缺少PPARα引起乙醇诱导的胃黏膜慢性损伤加重,其机制可能与缺少PPARα导致NF-κB信号通路激活,进而激活炎性反应和脂质过氧化反应有关。这些研究为后续探讨PPARα外源性激动剂治疗酒精性胃黏膜损伤的可能性提供了理论基础和实验依据。
