低温胁迫下漯麦163的生理生化变化及抗寒基因表达分析
2023-10-11曹燕燕葛昌斌廖平安崔江宽郭春强卢雯瑩
曹燕燕,葛昌斌,廖平安,崔江宽,黄 杰,郭春强,王 君,卢雯瑩
(1.漯河市农业科学院,河南漯河 462300; 2.河南农业大学植物保护学院,河南郑州 450002)
目前全球气候逐渐变暖,促使小麦幼穗分化进程加快,拔节期提前,进而导致春季低温(倒春寒)来临时小麦更易受到冻害。同时随着倒春寒天气发生频率和强度增加,也严重影响了小麦的产量和品质。因此,倒春寒已成为限制小麦高产的主要气象灾害之一。
黄淮麦区作为中国小麦主产区之一,每年小麦播种面积和产量约占全国小麦播种总面积和产量的58%和67%[1]。目前倒春寒已成为该地区重要的农业气象灾害之一,主要发生在春季3月下旬至4月上中旬,此时小麦正处于拔节至开花期,幼穗分化正处于雌雄蕊分化期至四分体时期,处于低温敏感期[2],连续3 d以上的低温就会对小麦造成巨大的伤害。2004-2005年黄淮麦区发生了大规模的倒春寒,其中仅河南省的受灾面积就超过1.33×106hm2,绝收面积高达2.67×105hm2左右[3];2009年再次遭遇倒春寒,使该地区小麦大面积减产,损失严重[4];2012-2013年,黄淮麦区遭受60年一遇的特重倒春寒,仅3月下旬到4月下旬就发生了10次,受灾面积达总播种面积的41.8%[1]。倒春寒的频繁发生、不规律性和不可控性,加上灾前预防不及时,灾后补救措施难实施,都会对小麦产量造成巨大的损失[5],因此倒春寒已成为黄淮麦区小麦生产中急需解决的关键问题。开展倒春寒对小麦品种生长发育及其产量形成的影响研究,为提高小麦抗寒性提供理论和技术支撑,并对保障黄淮麦区小麦的高产、稳产具有重要的理论和实践意义。
小麦抗寒性是由多个因素共同作用的的结果,是一个复杂的生物性状[6]。研究表明,小麦的抗寒性与叶绿素含量、抗氧化酶活性、丙二醛含量、可溶性蛋白含量[1,7-11]等密切相关。小麦在受到低温胁迫时,体内会发生一系列适应低温的生理生化变化,这也是植物抗寒能力最基本的反映,同时低温会诱导小麦体内抗寒相关基因的表达。小麦抗寒性是由多个微效基因控制,目前,在小麦苗期低温驯化过程中已分离鉴定出超过450个抗寒基因,但春季低温下的表达情况研究较少[12]。
为深入研究小麦响应倒春寒的生理生化及抗寒基因的表达情况,本研究选取在田间春季拔节期抗寒性表现较好的小麦品种漯麦163及其母本漯麦6010为研究对象,于拔节期在人工智能低温室进行低温胁迫,分析低温胁迫对小麦体内叶绿素、脯氨酸含量、超氧化物歧化酶(SOD)活性以及抗寒相关基因(SOD、WCS120、LEA和P5CS)表达量的影响,以期为小麦品种抗寒性评价方法的建立以及抗寒性遗传改良提供理论依据。
1 材料与方法
1.1 试验材料
供试小麦材料为国审品种漯麦163及其母本漯麦6010,均为弱春性品种,由漯河市农业科学院提供。
1.2 试验方法
试验于2020-2021年在漯河市农业科学院试验基地采用盆栽法进行。用内径30 cm、高60 cm的无底花盆,花盆底部用网袋扎紧,表面与地表持平。花盆内根据大田0~20 cm、20~40 cm、40~60 cm土层分层填土压实,浇透水沉实土壤后于10月18日播种,每个品种种植12盆,其中9盆用于低温胁迫处理,用于取样;其余3盆进行常温处理,作为对照,共计24盆。于3叶期进行定苗,每盆留苗10株。根据土壤墒情决定浇水量,每盆浇水量一致。
1.2.1 低温胁迫处理
于拔节期,将18盆小麦(每个品种9盆)移入人工智能低温室进行低温(-5 ℃)胁迫处理,分别于低温处理1 d、2 d和3 d时取主茎最上部展开叶,用于生理生化指标测定和抗寒基因表达分析。每个品种取3盆,3次重复,以常温处理为对照。
1.2.2 生理生化指标的测定
叶绿素、脯氨酸含量以及SOD活性的测定均利用酶联免疫分析(ELISA)试剂盒说明书进行。
1.2.3 抗寒基因的表达模式分析
用RNA提取试剂盒提取小麦叶片总RNA,用Prime Script RT reagent Kit with gDNA Eraser(TaKaRa,大连)将总RNA反转录为cDNA第一链。用Primer Premier 5.0设计引物,由上海派森诺基因科技有限公司合成(表1)。以小麦Actin为内参基因,以cDNA为模板,在CFX96 Real Time PCR Detection System(Bio-Rad,美国) 上进行qRT-PCR,分析抗寒相关基因(SOD、WCS120、LEA和P5CS)的表达模式。PCR反应体系为20 μL,包括2×SYBR real-time PCR premixture 10 μL,上、下游引物(10 μmol·L-1) 各0.4 μL,模板cDNA 1 μL,RNase free dd H2O补足至20 μL。PCR反应程序:95 ℃预变性5 min,95 ℃变性15 s,60 ℃退火30 s,40个循环;熔解曲线:95 ℃变性5 s,60 ℃退火30 s,95 ℃变性15 s。每个样品3个生物学重复。采用2-ΔΔCT法计算目标基因的相对表达量。

表1 qRT-PCR分析所用的引物Table 1 Primers used for qRT-PCR
1.3 数据处理
利用WPS Office进行数据统计和作图,用DPS 15.10的Duncan’s新复极差法进行差异显著性分析。
2 结果与分析
2.1 低温胁迫对小麦叶片叶绿素含量的影响
从表2可以看出,随着低温处理时间的延长,漯麦163和漯麦6010的叶绿素含量总体上均呈下降趋势。低温处理1~2 d后两个品种的叶绿素含量与对照均无显著差异,处理3 d后与对照均差异显著。低温处理0~3 d后漯麦163的叶绿素含量均明显高于漯麦6010。说明低温胁迫严重阻碍了叶绿素的合成,但在两个品种中的表现略有不同。
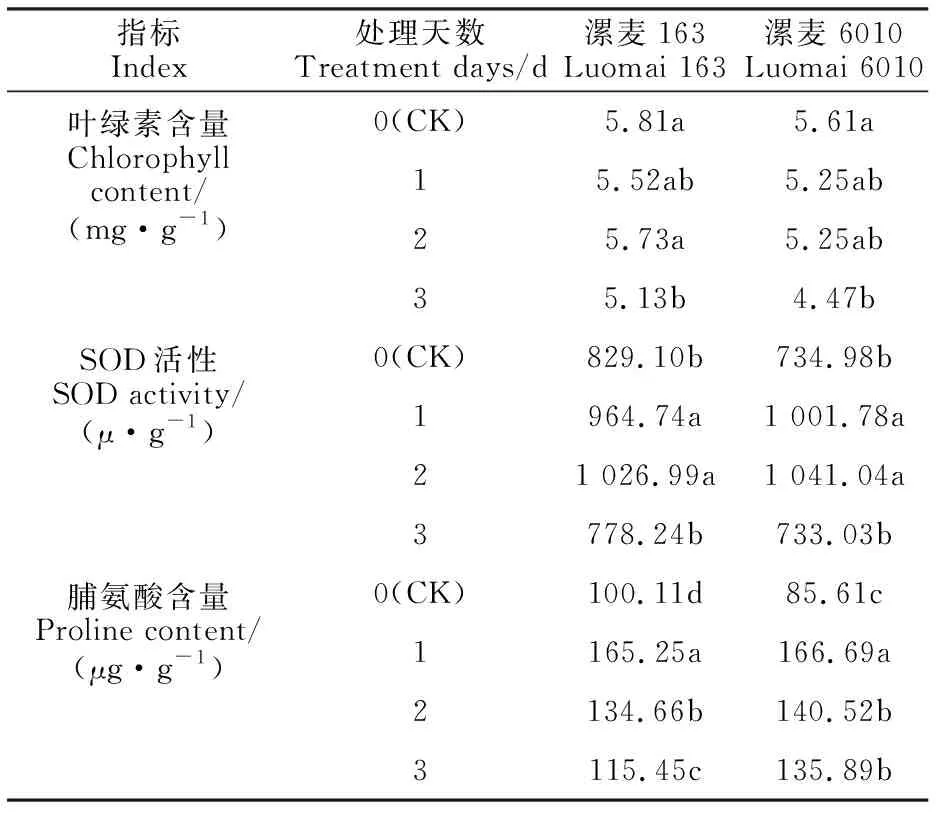
表2 低温胁迫下两个品种叶片的叶绿素含量、SOD活性和脯氨酸含量的变化Table 2 Changes of chlorophyll content, SOD activity and proline content in leaves ofthe two varieties under low temperature stress
2.2 低温胁迫对小麦叶片SOD活性的影响
从表2可以看出,随着低温处理时间的延长,漯麦163和漯麦6010的SOD活性均呈先升后降的变化趋势。处理2 d后两个品种的SOD活性达到最高,均显著高于对照,但与处理1 d后的SOD活性无显著差异;处理3 d后两品种的SOD活性最低,与对照均无显著差异。对照和低温处理3 d后漯麦163的SOD活性均明显高于漯麦6010;而低温处理1~2 d后漯麦163的SOD活性均明显低于漯麦6010。说明在低温处理初期,漯麦6010和漯麦163通过提高叶片中的SOD活性,清除活性氧自由基,维持细胞膜系统的稳定性;随着低温处理时间的延长,SOD活性下降,植株表现出对低温逆境的适应性,但在两个品种中的表现略有不同。
2.3 低温胁迫对小麦叶片脯氨酸含量的影响
从表2可以看出,随着低温处理时间的延长,漯麦163和漯麦6010的脯氨酸含量均呈先升后降的变化趋势。低温处理后两个品种的脯氨酸含量均显著高于对照,说明两个品种均可通过提高脯氨酸含量来适应低温逆境。处理1 d后两个品种的脯氨酸含量达到最高,且均显著高于对照及其他低温处理;低温处理2 d后与低温处理3 d后漯麦163的脯氨酸含量差异显著,而漯麦6010的脯氨酸含量在两个时间点无显著差异。两个品种间的脯氨酸含量在低温处理1 d后无明显差异,而在对照中漯麦163的脯氨酸含量明显高于漯麦6010,在低温处理2~3 d后漯麦163的脯氨酸含量明显低于漯麦6010。
2.4 低温胁迫对小麦叶片抗寒相关基因表达量的影响
从表3可以看出,随着低温胁迫处理时间的延长,漯麦163和漯麦6010叶片中SOD基因的表达量均表现为“降-升-降”的变化趋势。低温处理1~3 d后,两个品种叶片中SOD基因的表达量均显著低于对照。除对照外,低温处理下漯麦163叶片中SOD基因的表达量均低于漯麦6010。
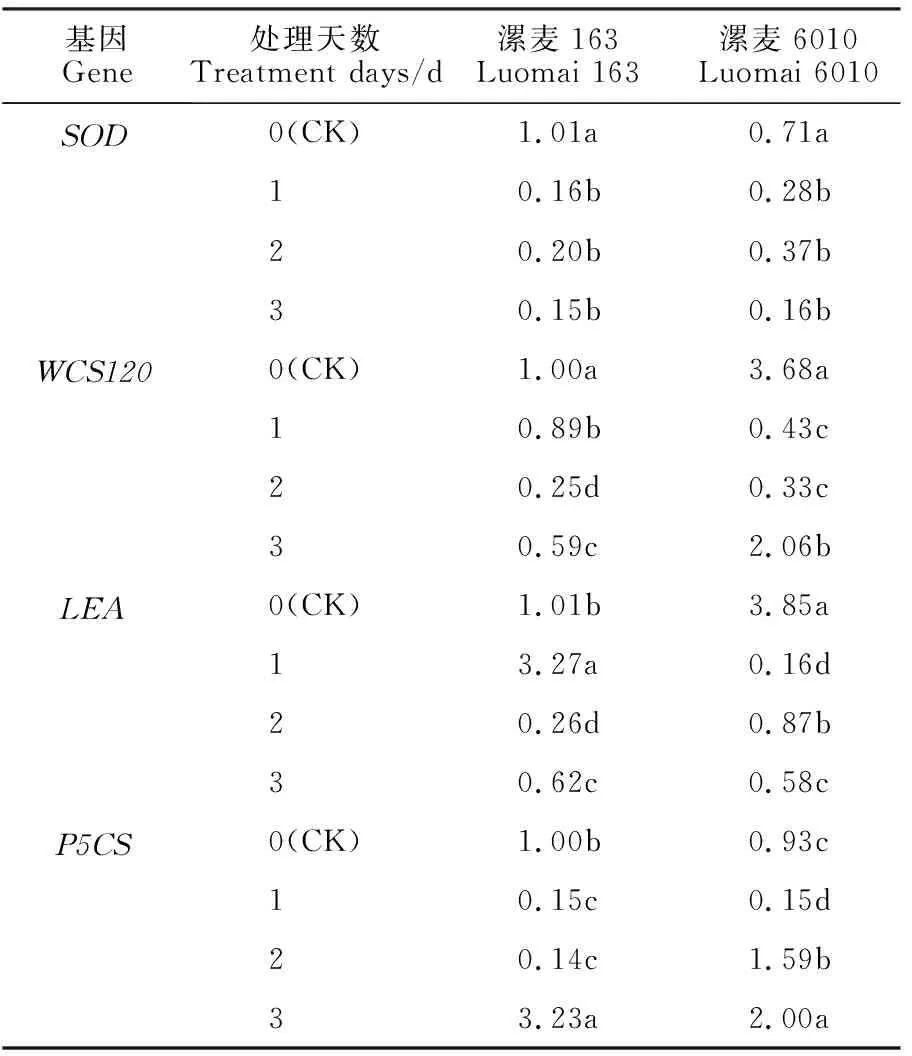
表3 低温胁迫下小麦叶片抗逆相关基因的相对表达量Table 2 Relative expression levels of cold tolerance related genes in wheat leaves under low temperature treatments
随着低温处理时间的延长,漯麦163和漯麦6010叶片中WCS120基因的表达量均表现为先降后升的变化趋势。低温处理1~3 d后,两个品种叶片中WCS120基因的表达量均显著低于对照。除低温处理1 d后外的其他时间点,漯麦163叶片中WCS120基因的表达量均低于漯麦6010。
随着低温处理时间的延长,漯麦163叶片中LEA基因的表达量表现为“升-降-升”的变化趋势,于处理1 d 后达到最大值,显著高于其他低温处理和对照;而漯麦6010表现为“降-升-降”的变化趋势,对照为最大值,显著高于其他低温处理。对照和低温处理2 d后漯麦163叶片中LEA基因的表达量均低于漯麦6010,低温处理1 d和3 d后则相反。
随着低温处理时间的延长,漯麦163和漯麦6010叶片中P5CS基因的表达量均表现为先降后升的变化趋势。对于漯麦163,低温处理1~2 d后P5CS基因的表达量显著低于对照,低温处理3 d后则显著高于对照;对于漯麦6010,低温处理1 d后P5CS基因的表达量显著低于对照,低温处理2~3 d后则显著高于对照,并于低温处理3 d后达到最大值。对照和低温处理3 d后漯麦163叶片中P5CS基因的表达量均高于漯麦6010,低温处理2 d后则相反,低温处理1 d后两个品种叶片中P5CS基因的表达量一致。
3 讨论与结论
叶绿素在光合作用中具有重要作用。王瑞霞等[9]研究发现,在拔节期对小麦进行低温处理,小麦叶片的叶绿素含量显著下降,但下降的幅度因品种而异。细胞膜的流动性和稳定性是细胞乃至整个植物赖以生存的基础,渗透调节物质在低温胁迫下可有效维持细胞结构和功能,对光合作用等生理过程具有积极的作用。张 磊等[13]研究发现,拔节期低温胁迫下,抗寒性较好的小麦会产生更多的脯氨酸;余海波[7]研究发现,一定程度的低温胁迫能够诱导小麦叶片中游离脯氨酸含量的增加,使小麦在短时间内表现出对低温环境的适应性,但当温度继续降低时,脯氨酸含量会下降。低温胁迫下,植物体内的SOD会清除过多的活性氧自由基,维持细胞膜系统的稳定性,提高植株的抗寒性。张 军等[14]研究发现,拔节期持续低温胁迫下,小麦叶片中的SOD活性均有不同程度的增高;薛亚光等[15]则研究发现,稻秸全量还田方式下小麦叶片中的SOD活性随着低温胁迫的加重呈下降趋势,植株表现出对低温逆境的适应性。
本研究发现,拔节期低温胁迫阻碍了漯麦163和漯麦6010的叶绿素合成,进一步降低了小麦叶片的光合能力,低温胁迫时间越长,对小麦叶片的光合作用影响越显著;低温胁迫下,两个品种的SOD活性和脯氨酸含量均显著上升,有利于减轻小麦膜脂过氧化伤害,维持细胞结构和功能,增强两个品种的抗寒性,随着低温胁迫时间的延长,两个品种的SOD活性和脯氨酸含量呈下降趋势,表现出对低温逆境的适应性。结合两个品种在田间的抗寒性表现,与生理指标检测结果相符,说明低温胁迫下漯麦163和漯麦6010均具有较强的自我保护机制,抗寒性较好。
植物抗寒性是由多基因控制的数量性状,抗寒相关基因只有在特定条件下才能表达。根据抗寒基因产物的功能可分为功能基因和调控基因两大类[16]。功能基因直接参与抵抗胁迫反应,主要有渗透调节分子基因P5CS、胚胎发育晚期丰富蛋白基因LEA、抗氧化酶基因SOD以及抗性蛋白基因WCS120等;调控基因主要是通过调控抗寒基因的表达来提高抗寒性,主要包含各种蛋白激酶基因、转录因子基因等。WCS120为冷诱导基因,只受低温胁迫的特异诱导,过表达WCS120可减轻冻害带来的机械损伤,维持代谢物质的运转,从而提高植物的抗寒性[17]。SOD作为功能基因,在消除活性氧的过程中具有重要作用,SOD活性的增加有利于减轻小麦在低温胁迫下造成的膜脂过氧化伤害。P5CS是脯氨酸合成途径中一个关键基因,催化脯氨酸生物合成的最初前两步,其表达与脯氨酸含量密切相关[18];LEA受逆境胁迫诱导,是一种逆境胁迫响应基因,在植物抵抗逆境中发挥着重要作用[19]。
本研究发现,低温胁迫下,与对照相比,漯麦163和漯麦6010两个品种叶片中SOD基因的表达量均显著下调,与SOD活性表现不一致,原因可能与SOD同工酶有关;在低温处理2 d和3 d后,漯麦163和漯麦6010两个品种叶片中SOD基因的表达量与SOD活性测定结果一致。在低温处理3 d后,两个品种叶片中P5CS基因的表达量显著高于对照,与其脯氨酸含量表现相一致。持续低温处理下,两个品种叶片中WCS120基因的表达量表现出先降后升的变化趋势,且显著高于对照。漯麦163叶片中LEA基因的表达量在低温处理1 d后显著上调表达,而低温处理后漯麦6010叶片中LEA基因的表达量呈显著下调表达,推测不同品种对低温的响应机制不同。综上所述,两个品种的抗寒性差异主要集中在相关基因的表达,漯麦163主要通过调控LEA和P5CS基因的表达来提高对低温胁迫的抵抗能力;而漯麦6010则是通过调控P5CS和WCS120基因的表达抵御低温逆境。
小麦的抗寒性机理复杂,不同基因型小麦品种因发育特点不同,在遭受倒春寒时其受害程度也不同,选育耐寒品种是提高小麦抗倒春寒能力的根本途径。本研究从生理生化和抗寒基因表达两方面对漯麦163和漯麦6010的抗寒性进行了分析,并结合大田观察,发现漯麦163和漯麦6010均具有较强的耐倒春寒能力,可作为抗寒性亲本种质资源,加快耐倒春寒小麦品种的选育。
