借助守恒关系 巧解金属与硝酸反应的计算
2023-10-11朱雅琼
朱雅琼
(安徽省灵璧中学,安徽 宿州 234200)
化学计算是中学化学教学的重点,也是难点之一,而在教材中没有专门的章节进行教学,其分布于元素及其化合物的学习中.特别是结合真实情境中的应用把握金属主要的性质、氮及其化合物的主要性质,探索物质性质、实现物质转化[1].由于金属与硝酸的反应有很多的特点,所以本文通过归纳常见的金属与硝酸反应的类型,结合典型例题,以点带面,提升学生的综合计算的能力.
1 金属与硝酸反应的特点
(1)金属种类具有多样性.硝酸是一种氧化性强酸,是工业上应用非常广泛的一种强酸,也是实验室中最为常见的酸,能与除金、铂以外的绝大数金属发生反应.
(2)金属元素存在的多种化合价.由于过渡金属存在多种化合价,特别是最为常见的金属铁,就有+2、+3两种常见的化合价,而硝酸是一种强氧化性酸,硝酸用量的不同可以得到Fe(NO3)2、Fe(NO3)3两种氧化产物,故随着参加反应的硝酸用量不同可能会得到不同价态的氧化产物.
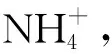
(4)计算过程的复杂性.金属与硝酸反应的计算题目中往往很少只是单纯进行的是金属与硝酸的反应,随着金属与硝酸反应之后,还涉及到往反应后的溶液中加入NaOH溶液使金属离子沉淀的计算;硝酸还原产物为NO、NO2(甚至还有N2O4)与氧气反应的计算等.
综上所述,在进行金属与硝酸反应的计算中如果根据化学方程式进行计算,往往会无从下手,难以进行有效的计算.因此可以将电子守恒、电荷守恒、物料守恒通过相应组合,等量代换,找出已知量与未知量的关系,从而简化解题步骤,准确快速地将题解出.
2 计算依据
电子守恒:在氧化还原反应中,氧化剂得电子总数与还原剂失电子总数是相等的.电子守恒是氧化还原反应计算的基础,由于金属与硝酸的反应都是氧化还原反应,所以电子守恒关系在金属与硝酸反应的计算中具有十分重要的意义.
电荷守恒:又称电中性原理,指在溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数,使整个溶液不显电性.借助电荷守恒,可以找出溶液中各离子浓度之间的关系.同时,经常利用加入NaOH溶液将金属阳离子沉淀出来,由于一个OH-带一个单位负电荷,由等量代换,完全沉淀金属阳离子所需OH-的物质的量就等于金属阳离子所带正电荷总数,也等于金属失电子总数;
物料守恒:又称原子守恒,根据质量守恒定律,化学反应前后各元素原子的种类、个数和质量均保持不变,故金属与硝酸参加反应以后,硝酸中的氮原子共有三个可能存在:一是体现酸性参与成盐;二是体现氧化性被还原,存在于还原产物(主要为NO、NO2)中;三是硝酸过量,存在于反应后的溶液中,可以根据反应后溶液的pH进行计算[2].
3 计算模式
(设有1 mol金属M参加反应,金属的化合价为+n价.)
计算主线:
根据电子守恒:n(e-)=n(NO)·3+n(NO2)·1
根据物料守恒:n(HNO3)(总)=n(HNO3)(成盐)+n(HNO3)(被还原)+n(HNO3)(过量)
若对反应后的产物进行再处理,还可以有以下的几种情况:
(1)对反应后的溶液中加入NaOH溶液,使金属离子恰好沉淀完全,则反应前金属的质量与反应后沉淀的质量之间存在如图1所示关系.

图1 质量关系图
结合电荷守恒与质量守恒,增加的质量即为OH-的质量,而OH-的物质的量则等于金属单质失去电子的物质的量.
(2)当金属离子恰好沉淀完全时,溶液中只有NaNO3,根据电荷守恒和物料守恒,则有
n(NaOH)=n(HNO3)(总)-n(HNO3)(被还原)
(3)对于反应的还原产物(NO、NO2、N2O4等混合气体),通入O2并与水反应使其全部转化为HNO3,具体关系如图2所示.

图2 反应前后物质关系图
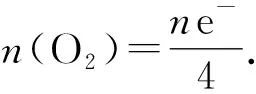
4 典型例题
例1将11.2 g的铜镁的混合物完全溶解于足量的硝酸中,收集产生的气体混合物,再向所得溶液中加入适量的NaOH溶液,产生21.4 g沉淀,根据题意推断气体混合物的可能组成是( ).
A.0.3 mol NO2和0.3 mol NO
B.0.2 mol NO2和0.1 mol N2O4
C.0.1 mol NO、0.2 mol NO2和0.05 mol N2O4
D.0.6 mol NO

例2足量的铜与一定量浓硝酸恰好完全反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68 L O2(STP)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加5.0 mol·L-1NaOH溶液至Cu2+恰好沉淀完全,则消耗NaOH溶液的体积是( ).
A.60 mL B.45 mL C.30 mL D.15 mL
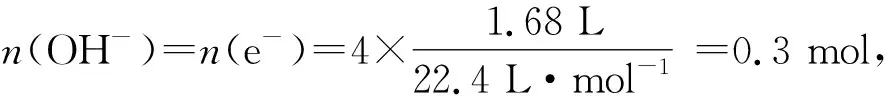
例3将1.20 g铁铜合金完全溶于100 mL 12.0 mol·L-1浓硝酸中,得到NO2和N2O4混合气体672 mL(已换算为标准状况下的体积).向反应后的溶液中加入1.0 mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.05 g沉淀,下列有关判断正确的是( ).
A.反应过程中浓硝酸仅体现氧化性
B.该合金中铁与铜的物质的量之比为2∶1

D.金属离子全部沉淀时,加入NaOH溶液的体积至少为1 150 mL.

