综合生物信息学、网络药理学、分子对接及实验验证探讨补肾健脾方改善2型糖尿病的作用机制
2023-10-10蔡少鹏郑丽莎蔡惠连封杰妮朱娴琼高晓露范巧明杨庆依季兵
蔡少鹏,郑丽莎,蔡惠连,封杰妮,朱娴琼,高晓露,范巧明,杨庆依,季兵
(1.广州中医药大学,广东广州 510006;2.广东祈福医院,广东广州 511400)
糖尿病(diabetic mellitus,DM)发病率正逐年提高,一项全国性横断面研究结果表明,45 岁以上人群糖尿病患病率高达13.21%,其中,90%以上为2 型糖尿病(type 2 diabetic mellitus,T2DM)患者,且患病率随年龄增长而增加[1]。T2DM 与酮症酸中毒、心血管疾病等急慢性疾病高度相关,已成为威胁我国居民健康的重大公共卫生问题。然而,临床上口服的降糖药如双胍类、促胰岛素分泌剂、α-糖苷酶抑制剂多因胃肠道反应、营养与代谢障碍、过敏反应、肝功能损害等副作用而存在临床局限性[2-4]。相对而言,中医药具有毒副作用小、综合治疗作用、可延缓并发症等优点,随着中医药现代化研究进程的加快,对抗T2DM 中药复方的研究也愈加受到关注。有研究报道,中医药在抑制β细胞凋亡、修复β细胞功能等方面展现出光明前景[5-7]。本课题组前期临床研究发现,补肾健脾方(淫羊藿、鹿角胶、黄精、沙苑子、制首乌、黄芪、山药、葛根、丹参、制大黄)具有降低T2DM 患者空腹血糖[7]、糖化血红蛋白[8-9]、稳态模型评估的胰岛素抵抗指数(HOMA-IR)[10]等临床疗效,但其具体作用机制尚未明确。因此,本研究旨在通过联合网络药理学、生物信息学、分子对接分析潜在的作用机制,并通过动物实验验证,以期进一步为临床应用补肾健脾方治疗T2DM 提供参考,现将研究结果报道如下。
1 材料与方法
1.1 网络药理学研究
1.1.1 补肾健脾方化合物与相关靶点 通过中药系统药理学数据库与分析平台(TCMSP,https://tcmsp-e.com/tcmsp.php)获取补肾健脾方中药成分及对应的作用靶点,根据药物动力学参数,以口服生物利用度(OB)≥30%、类药性(DL)≥0.18 进行初筛;同时,通过BATMAN-TCM 数据库(http://bionet.ncpsb.org.cn/batman-tcm/index.php/Home/Index/index)补充中药成分及靶点,以默认参数进行筛选。通过UniProt 数据库(https://www.uniprot.org/)对靶点名称进行标准化,转化为gene symbol格式。
1.1.2 基因表达矩阵获取 通过GEO 数据库(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi)获取基因表达矩阵:数据集GSE18732 基于GPL9486 平台,包括118 个样本,其中,T2DM 样本45例,糖耐量异常(IGT)样本26例,正常样本47例;数据集GSE95849 基于GPL22448 平台,包括18 个样本,其中,T2DM 样本6例,正常样本6例,糖尿病神经病变样本6例。为保证样本的可对比性,本研究剔除了糖尿病神经病变样本,仅12 例样本被纳入研究。通过GEOquery 包获取基因集信息,并进行标准化处理。
1.1.3 Mfuzz分析 基因通常不是以“开-关”的方式进行调控,而是以渐进的方式,这样可以对基因功能进行更精细的控制[11]。T2DM 是由正常血糖发展到IGT后再进一步转变而来,因此,存在渐进性进展的改变过程[12]。与传统硬聚类不同,Mfuzz 提供了一种软聚类算法,通过区分一个基因的聚类程度来反映渐进性的变化规律。本研究以GSE18732 数据集样本临床信息为依据,根据“正常-IGT-T2DM”的转变规律进行Mfuzz分析,获取与T2DM 转变过程同步变化的聚类,提取聚类基因用于后续分析。
1.1.4 差异分析 通过limma 包提取GSE95849 数据集,根据发病状态进行差异分析,以|logFC|≥1且P<0.05 为条件进行筛选,获取T2DM 与正常样本存在差异的基因。
1.1.5 药物作用靶点获取 分别提取“1.1.1”“1.1.3”“1.1.4”项中补肾健脾方的作用靶点及T2DM 发展过程同步变化的差异靶点,获取交集靶点作为补肾健脾方的作用靶点,通过Cytoscape 3.7.1软件进行可视化。
1.1.6 GO富集与KEGG 通路 提取“1.1.5”项中补肾健脾方的作用靶点,通过clusterProfiler、org.Hs.eg.db 包进行富集分析,分别提取P<0.05 的分子生物功能(MF)、生物过程(BP)、细胞组分(CC)和KEGG通路,预测补肾健脾方的作用机制。
1.1.7 核心靶点筛选 提取“1.1.5”项中的作用靶点,导入STRING数据库(https://string-db.org/)获取靶点的交互作用,随后导入Cytoscape 软件,通过MCODE 插件进行网络分析,计算靶点的Degree、Betweenness、Closeness等信息,分别提取每个指标排前10 位的靶点,获取交集靶点作为核心靶点,该靶点在网络中具有优秀的核心影响作用。
1.1.8 分子对接 提取度(Degree)值最高的活性成分,与FOS、NOTCH1 进行分子对接。从Protein Data Bank(PDB)(https://www.rcsb.org/)数据库下载核心靶点蛋白FOS(PDB ID:1A02)、NOTCH1(PDB ID:5L0R)的PDB格式(遵循:人源蛋白,分辨率及具有原始配体)。从TCMSP 数据库、ZINC数据库下载活性成分的mol2 格式。使用PyMOL 2.6.0 对靶点蛋白进行去水、去小分子配体,采用AutoDockTools 1.5.7 对靶点蛋白、活性分子加全氢后进行分子对接,通过PyMOL 对分子对接结果进行可视化处理。
1.2 实验验证
1.2.1 动物 4 周龄、体质量约20 g 的雄性db/db阳性小鼠8只,均购自江苏集萃药康生物科技有限公司,动物生产许可证号:SCXK(苏)2018-0008。本动物实验通过广州锐格生物科技有限公司伦理委员会批准,伦理号:20220301-121。
1.2.2 药物、试剂与仪器 补肾健脾方由淫羊藿12 g、鹿角胶15 g、黄精12 g、沙苑子15 g、制首乌15 g、黄芪30 g、山药30 g、葛根30 g、丹参30 g、制大黄10 g组成,以上中药饮片均购自广东祈福医院中药房,加工成冻干粉。胰岛素酶联免疫吸附分析(ELISA)试剂盒(武汉基因美科技有限公司);线粒体超氧化物歧化酶(SOD)ELISA 试剂盒(广州博辉生物科技有限公司);丙二醛(MDA)ELISA 试剂盒(上海酶研生物科技有限公司);Bax抗体、Bcl-2 抗体、Caspase-3 抗体、山羊抗兔IgG二抗(北京中杉金桥公司);FOS 抗体、NOTCH1抗体(美国Cell Signaling Technology 公司)。酶标仪(深圳雷杜生命科学股份有限公司);电热恒温培养箱(上海一恒科技有限公司);RM2016 切片机(上海徕卡仪器有限公司);DM500 光学显微镜(德国Leica 公司);电泳及转膜装置(美国Bio-Rad公司)。
1.2.3 分组与给药 将db/db 阳性小鼠随机分为治疗组和对照组,每组4只,适应性饲养1 周。治疗组给予补肾健脾方冻干粉溶液9.95 g/kg 灌胃,对照组给予等体积生理盐水灌胃,每日2次,连续给药4 周。小鼠灌胃剂量计算方法:中药按20%出粉率计算,补肾健脾方冻干粉人体用量为0.796 g·kg-1·d-1,按小鼠用药量为人体用药量25倍计算小鼠用药量为19.9 g·kg-1·d-1。
1.2.4 观察指标与方法
1.2.4.1 胰岛功能及氧化应激指标检测 灌胃4 周后,禁食不禁水6 h,断颈处死小鼠。腹主动脉取血,血糖试纸检测空腹血糖水平,按试剂盒说明书采用ELISA 法检测空腹胰岛素,并计算稳态模型评估的胰岛素抵抗指数(HOMA-IR):HOMA-IR=空腹胰岛素×空腹血糖/22.5[13]。按试剂盒说明书采用ELISA法检测SOD、MDA含量。
1.2.4.2 Western Blot法检测小鼠胰腺组织内蛋白表达 取胰腺组织,裂解、离心,收集上清液。取10 μg 蛋白添加到聚丙烯酰胺凝胶中电泳分离转移到PVDF 膜上后封闭,分别加入一抗FOS 和NOTCH1 4 ℃孵育过夜,用TBST 洗涤3 次后加入二抗孵育,用ImageJ 软件定量分析蛋白条带的光密度洗膜,显影。
1.2.4.3 免疫组织化学法观察小鼠胰腺凋亡相关蛋白表达 取胰腺组织石蜡切片,脱蜡和水化,抗原修复,消除内源性过氧化物酶活性,封闭。分别与一抗Bax、Bcl-2、Caspase-3 于37 ℃孵育1~ 2 h,与二抗37 ℃孵育0.5~ 2 h,显色后拍照。用ImageJ 软件分析Bax、Bcl-2、Caspase-3 阳性面积百分比。Bax、Bcl-2 在细胞浆表达,Caspase-3在细胞浆和细胞核均有表达,呈棕黄色或棕褐色颗粒。
1.2.5 统计方法 运用R 4.1.3 软件进行数据处理分析,计量资料用均数±标准差()表示,组间差异对于符合正态分布的数据采用t检验,不符合正态分布的数据采用Wilcoxon 秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 Mfuzz 分析随着正常样本从IGT 转变为T2DM,聚类2、5 呈同步反向变化,聚类7 呈同步正向变化,见图1。提取上述3个聚类共3 593个基因,其表达量与T2DM 的进展有同步变化关系,提示其可能为T2DM的关键生物标志物。

图1 Mfuzz分析Figure 1 Mfuzz analysis
2.2 差异分析以|logFC| ≥1、P<0.05 为条件进行差异分析,筛选得到差异基因2 997个,其中,上调基因2 834个、下调基因163个,见图2。通过绘制韦恩图,获取与Mfuzz 分析结果的交集基因576个,见图3。
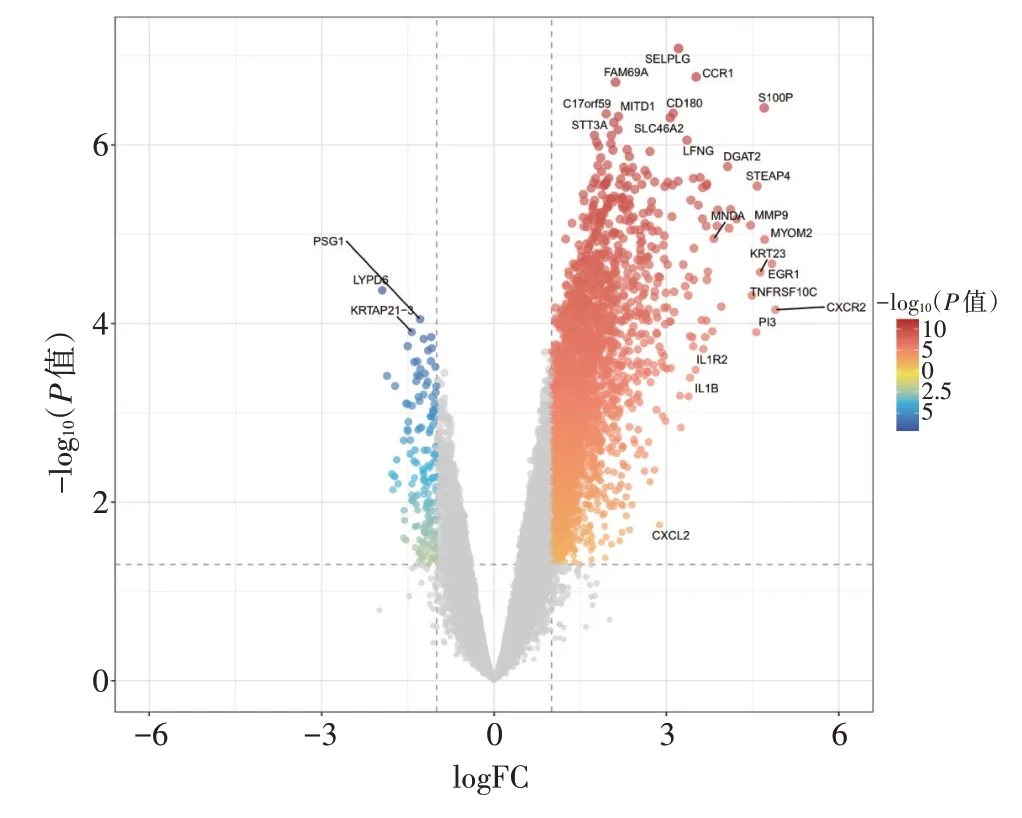
图2 火山图Figure 2 Volcano plot

图3 韦恩图Figure 3 Venn diagram
2.3 “中药-成分-靶点”网络将补肾健脾方活性成分及其靶点与576 个T2DM 靶点取得交集基因77个,包括PROS1、FDXR、PYCR2、FOS等,提取交集基因相关的中药成分信息导入Cytoscape 软件构建网络图,见图4。该网络包括253 个节点和841条边,根据Degree值筛选的核心成分主要有黄体酮(Progesterone)、γ-谷甾醇(Gamma-Sitosterol)、2-甲基腰果二酚(2-Methyl Cardol)、十五烷酸(Pentadecanoic Acid)。
2.4 GO 富集与KEGG 通路77 个基因用于GO 富集及KEGG 通路富集分析,提取P<0.05 的富集结果。MF 主要富集于氧化还原酶的活性、辅酶结合等;CC主要富集于细胞-细胞接触区、线粒体基质等;BP 主要富集于缺氧及其响应。KEGG 通路主要富集于T2DM、FoxO 通路、cAMP 通路等。可以发现,77个基因与氧化应激关系密切。见图5。

图5 GO富集与KEGG通路富集Figure 5 GO enrichment versus KEGG pathway enrichment
2.5 核心靶点筛选将77个基因导入STRING数据库,去除无连接节点,其余参数默认,构建了一个63 个节点和117 条边的网络,通过MCODE 模块分别计算节点的Degree、Closeness、Betweenness、MNC、MCC、EPC、EcCentricity和DMNC指标,分别提取前10个节点获取共同交集靶点2个:FOS和NOTCH1。见图6。通过对比可以发现,FOS 和NOTCH1 在T2DM 样本中表达水平显著高于正常样本,见图7。

图6 花瓣图Figure 6 Petal diagram

图7 云雨图Figure 7 Cloud and rain map
2.6 分子对接根据“2.5”项Degree 值排序,筛选了黄体酮(Progesterone)、γ-谷甾醇(Gamma-Sitosterol)、2-甲基腰果二酚(2-Methyl Cardol)、十五烷酸(Pentadecanoic Acid)作为主要活性成分,随后将活性成分和核心靶点FOS(PDB ID:1A02)、NOTCH1(PDB ID:5L0R)进行分子对接,结合能见表1。结合能小于0,表明受体分子与配体分子能自发结合;结合能小于-1.2 kcal·mol-1,表明对接能力较强,对接后分子的稳定性较高。本研究对接结果显示结合能均小于-1.2 kcal·mol-1,表明活性成分与核心靶点蛋白均能较稳定地结合。分子对接的可视化结果见图8。

表1 结合能Table 1 Binding energy

图8 分子对接的可视化结果Figure 8 Visualisation of molecular docking results
2.7 各组小鼠胰岛功能比较干预后,治疗组小鼠的空腹血糖、空腹胰岛素水平、HOMA-IR 水平均显著低于对照组(P<0.05),结果见表2。
表2 各组小鼠空腹血糖、空腹胰岛素、HOMA-IR水平比较Table 2 Comparison of fasting blood glucose,fasting insulin and HOMA-IR levels among each group of mice ()
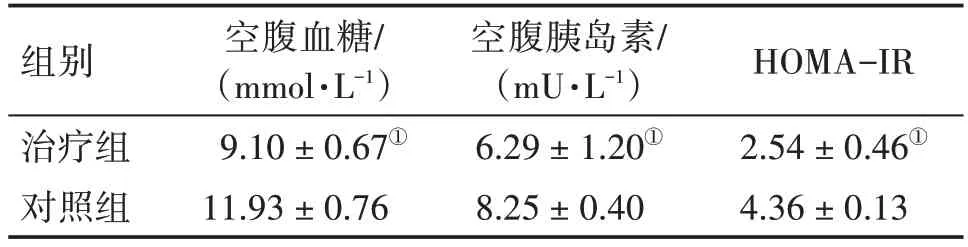
表2 各组小鼠空腹血糖、空腹胰岛素、HOMA-IR水平比较Table 2 Comparison of fasting blood glucose,fasting insulin and HOMA-IR levels among each group of mice ()
注:①P<0.05,与对照组比较
2.8 各组小鼠血清SOD、MDA 比较经干预后,治疗组小鼠的SOD水平明显高于对照组(P<0.05),而MDA水平则低于对照组(P<0.01),结果见表3。
表3 各组小鼠血清SOD、MDA水平比较Table 3 Comparison of serum SOD and MDA levels among each group of mice()

表3 各组小鼠血清SOD、MDA水平比较Table 3 Comparison of serum SOD and MDA levels among each group of mice()
注:①P<0.05,②P<0.01,与对照组比较
2.9 各组小鼠胰腺组织FOS、NOTCH1表达比较干预后,治疗组小鼠胰腺中FOS、NOTCH1 表达量低于对照组(P<0.05或P<0.01),结果见图9。
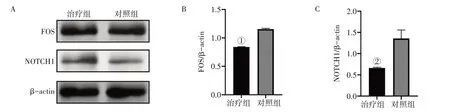
图9 各组小鼠胰腺组织FOS、NOTCH1表达比较Figure 9 Comparison of FOS and NOTCH1 expressions in pancreatic tissue among each group of mice
2.10 各组小鼠胰腺凋亡相关蛋白表达比较干预后,与对照组比较,治疗组小鼠胰腺Bax、Caspase-3 阳性面积百分比降低(P<0.05),Bcl-2阳性面积百分比升高(P<0.05),结果见表4、图10~图12。
表4 各组小鼠胰腺凋亡相关蛋白表达比较Table 4 Comparison of the expressions of apoptosisrelated proteins in the pancreas among each group of mice(,%)

表4 各组小鼠胰腺凋亡相关蛋白表达比较Table 4 Comparison of the expressions of apoptosisrelated proteins in the pancreas among each group of mice(,%)
注:①P<0.05,与对照组比较
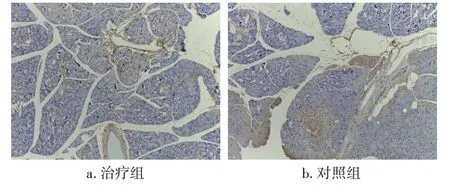
图10 Bax 的免疫组织化学染色图(×100)Figure 10 Immunohistochemical staining of Bax(×100)

图11 Bcl-2的免疫组织化学染色图(×100)Figure 11 Immunohistochemical staining of Bcl-2(×100)

图12 Caspase-3的免疫组织化学染色图(×100)Figure 12 Immunohistochemical staining of Caspase-3(×100)
3 讨论
2 型糖尿病(T2DM)的发病机制中,胰岛素抵抗和胰岛β细胞功能衰竭是两个关键环节。在确诊糖尿病时,糖尿病患者的胰岛β细胞功能已下降至正常人的一半,而在糖尿病诊断前10~12年,β细胞数量已经显著减少,并在此后逐年走向衰竭,正常的胰岛β细胞则难以补偿胰岛素抵抗或不能再发挥这种补偿机制,明显加速了T2DM 病程[14-15]。有学者认为,胰岛β 细胞衰竭源于凋亡异常增加[16],抑制β 细胞凋亡对维持β 细胞数量及功能具有重要意义[17-18]。
胰岛素抵抗状态与糖尿病前期相关,糖尿病前期被认为是转化为糖尿病的高风险状态,在此期间活性氧(ROS)生成增加,增加的氧化应激诱导T2DM 及血管功能障碍等并发症的发生发展[19]。氧化应激导致肌肉和脂肪细胞的葡萄糖摄取受损,并减少β 细胞的胰岛素分泌[20]。Furukawa 等[21]通过使用烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶抑制剂减少全身氧化应激,改善了肥胖小鼠模型中的葡萄糖代谢。Meigs 等[22]研究的数据显示,胰岛素抵抗的患病率与氧化应激标志物8-epi-PGF2α浓度呈正相关,这表明胰岛素抵抗与非糖尿病患者和糖尿病风险升高的亚组如肥胖或空腹血糖受损(IFG)中的氧化应激相关。此外,在IFG 受试者中,与空腹血糖正常受试者相比,这种相关性更高[23-24]。可见,氧化应激诱导β 细胞功能障碍是诱导胰岛素抵抗、促进IGT 与T2DM 的关键过程。然而,目前临床抗T2DM 的治疗药物发挥降糖疗效的同时,对受损的β细胞进一步刺激受损,缺乏促进β 细胞修复的功能,难以控制日渐衰退的β 细胞数量及功能[25-26]。相对而言,中药“多靶点”治疗优势在改善糖尿病症状的同时对β细胞的保护展现出良好的应用前景,并逐渐受到临床的广泛关注。
T2DM 归属于中医学“消渴”的范畴。“脾肾虚于内,标实于外”是T2DM 的发病进展原因。由于久坐、熬夜等不良生活方式及肥胖发病率的增长,目前临床上以“三多一少”为典型表现的T2DM 患者越来越少,相反,以疲倦乏力、形体肥胖、脘腹胀满、腰膝酸软、舌淡胖有齿痕,苔薄白,脉沉细无力等脾肾亏虚证候居多。《灵枢·本脏》言:“肾脆则善病消瘅易伤。”《石室秘录·内伤门》言:“消渴之证,虽分上、中、下而以肾虚致渴,而无不同也。”肾为元阴元阳之脏,肾阴亏虚,无以上济,虚火内生,精血化生失源,脉道不充,久病累及肾阳,不能温养脾阳,加之饮食不节,脾阳受损,日久脾肾亏虚。《素问·经脉别论》言:“饮入于胃,游溢精气,上输于脾,脾气散精,上归于肺……水津四布,五经并行。”气血依赖于脾胃纳运相得,因脾胃功能失常,水谷精微无法转化为气血输布,食滞生痰、生热、生瘀,进一步阻滞阳气宣通,而病邪蓄积体内表现为血糖、血脂等升高。因此,血糖的升高是病邪“标实”的体现,脾肾耗竭是发病的根本,降糖等祛邪手段在短期内起效显著,实则加重了“本虚”,如一线用药二甲双胍,其临床疗效受到普遍认可的时候,却因其药性寒凉,会出现腹泻等脾阳受损加重的表现[27-28];而磺脲类药物降糖起效快且效果显著,却因过度耗损β 细胞,动摇了根本,导致本虚无以抗邪出现继发性失效。因此,补肾健脾为治疗T2DM的要点。
本研究综合生物信息学及网络药理学,筛选出77 个补肾健脾方的作用靶点,通过富集分析,77 个靶点与氧化应激过程关系密切,并进一步筛选出2 个核心靶点FOS、NOTCH1,通过分子对接证明了补肾健脾方的主要活性成分与核心靶点结合稳定。最后,通过动物实验证明了补肾健脾方可有效降低胰腺FOS、NOTCH1 表达,并降低脂质过氧化指标MDA,提高抗氧化指标SOD 活性,抑制凋亡蛋白Bax、Caspase-3 表达,促进凋亡抑制蛋白Bcl-2 表达,同时升高HOMA-IR。表明补肾健脾方通过降低胰腺FOS、NOTCH1 表达来缓解氧化应激,降低胰岛细胞凋亡,改善胰岛素抵抗以延缓T2DM的进展。
综上所述,补肾健脾方可通过胰腺FOS、NOTCH1等发挥抗氧化应激改善胰岛细胞凋亡,达到延缓T2DM 进展的目的,为其对T2DM 的防治提供了证据支持。
