灵武长枣叶片阿拉伯半乳糖蛋白分布特征
2023-10-10陶珊珊章英才刘迎雪
陶珊珊,王 静,章英才,白 琳,刘迎雪
(宁夏大学生命科学学院,宁夏 银川 750021)
阿拉伯半乳糖蛋白(AGPs)为一类广泛分布于植物各器官细胞中富含羟脯氨酸且高度糖基化的糖蛋白(HRGPs)家族,主要由阿拉伯糖和半乳糖构成多糖支链和蛋白质核心链组成结构复杂的大分子[1-3]。通过分子生物学等技术对植物细胞中非常重要的糖蛋白AGPs研究表明,AGPs在生殖发育过程,包括花粉发育、花粉管生长、自交不亲和、大孢子母细胞形成,果实的成熟和衰老过程,以及根和茎等营养器官发生与发育等方面起着重要作用[2-6]。研究结果表明,宁夏枸杞多糖及果实的细胞壁多糖是阿拉伯半乳聚糖AGPs糖蛋白,是枸杞子中具有免疫调节功能的药用有效成分[2-5];番茄LeAGP1过量表达导致植株的株高下降,分支增多,种子数量及大小减少,表明此AGPs参与了营养生长和生殖发育[7];过量表达黄瓜 (Cucumissativus)CsAGP1基因的烟草植株株高增加,说明AGPs促进了茎的生长[8];拟南芥AtAGP30对种子萌发和根的发育起重要的调控作用[9],AtFLA1促进了根的发育和细胞分化[10],AtFLA11、AtFLA12参与了次生细胞壁发育[11-13],与木质素形成同源的基因AtXYP1、AtXYP2,该类AGPs与维管束发育密切相关[14],AtAGP31参与维管束发育与逆境应答[15-16],AtAGP19基因在细胞分裂与生长、叶的发育以及生殖发育过程中起着重要的作用[17]。基于AGPs相关基因的表达模式证实了多种类型的AGPs基因在不同组织部位特异性表达,在植物营养器官和繁殖器官发育中起非常重要的作用,因此,探明AGPs在不同组织部位分布的特征尤其重要[2-3]。
AGPs在植物各器官中都有存在,利用AGPs的特异性抗体,成为研究不同植物中不同部位AGPs分布与特性的重要手段,在枸杞果实AGPs免疫定位[2-5]、低温引起雏菊(Bellisperennis)胚珠和花药发育过程中AGPs分布的变化[18]、以及利用AGPs单克隆抗体JIM8、JIM13、MAC207和LM2对拟南芥有性生殖过程中AGPs进行定位方面取得了较多的研究成果[2-3,19]。在营养器官方面,JIM4识别的AGPs与胡萝卜根早期维管组织的发育相关,JIM14识别的AGPs与根次生加厚的筛管有关[20],而JIM13识别的AGPs定位在幼嫩的木质部和根冠[21],LM2、LM14识别的AGPs定位于野生型大麦根毛的细胞壁和细胞质中[22],由此说明,不同的单克隆抗体识别的AGPs在根组织发育中有其特定的分布,但对植物叶发育中AGPs分布的研究较少。利用针对性抗体对AGPs进行定位的免疫学研究方法,由于其较高的特异性,成为不同植物中不同部位AGPs分布研究的良好途径[2-3]。
叶是植物进行光合作用和蒸腾作用的主要器官,也是植物对环境变化比较敏感的器官,其AGPs的分布直接影响到其功能。研究表明,枣叶中有丰富的黄酮类[23-24]、三萜类[25]、糖类和皂苷等[26],不同发育时期灵武长枣叶营养成分含量与果实营养成分和果实品质间存在明显的相关性[26];AGPs参与了灵武长枣果实维管束发育过程的形态建成、细胞分裂和体积的增大,并为果实发育提供营养支持及保护[2,27],因此,叶AGPs分布有可能对果实品质的形成发挥着重要作用。
灵武长枣(ZiziphusjujubaMill cv. Lingwuchangzao)是鼠李科枣属的鲜食枣品种,原产于宁夏灵武市,果实具有优良的药用品质和食用品质。近年来,在灵武长枣果实研究方面取得了非常多的研究成果[2-3,27],而有关灵武长枣叶AGPs糖蛋白的分布,以及对果实品质的影响尚不明了。因此,本研究以果实不同发育时期灵武长枣叶为材料,应用免疫荧光定位技术,较系统研究不同时期叶中AGPs糖蛋白的分布特征,为进一步研究叶AGPs对灵武长枣生长发育及其在果实品质影响方面的功能奠定基础。
1 材料与方法
1.1 试验材料
以位于宁夏灵武市的宁夏红枣工程技术研究中心试验基地6年生灵武长枣的叶为供试材料,采用随机设计,3次重复,每次重复选择生长发育良好、树势适中、长势相似、栽培管理水平一致的5~10株植株。在果实膨大前期(7月10日)、快速膨大期(8月9日)、着色期(9月8日)、完熟期(9月28日)分别设计4次试验,每次试验时间均设定于上午9∶00—11∶00进行,从试验植株树冠的东、西、南、北4个方位以及上、中、下、里、外各个方向选择枣吊中部果柄附近的叶作为试验对象[2-3,27]。
AGPs单克隆抗体JIM13购自美国乔治亚大学,碱性磷酸酶标记的山羊抗小鼠IgG二抗购自Sigma-Aldrich公司。
1.2 试验方法
参照Bao等[5]、王莹莹[28]及林曼娜[29]的方法,略有改动。
1.2.1 石蜡切片制作 选取各不同发育时期的叶,用锋利的刀片将叶片分割成含有3条主脉的约0.6 cm×1.0 cm的小块,立即放入含有3.7%(v/v)甲醛的2F4固定液中,盖紧瓶盖后注射器抽气至样品下沉瓶底,室温固定4 h。更换固定液3次,每次30 min。然后用PBS磷酸缓冲液(10 mmol·L-1,pH=7.0)清洗3次,每次15 min。样品在4℃下用0.05% Toluidine blue染色15 min,在4℃下依次用30%、50%、70%、90%的乙醇梯度脱水,每次60 min,100%乙醇脱水3~4次,60 min·次-1。样品用乙醇∶Steedman’s wax=1∶1在37℃恒温箱中渗透过夜,次日更换乙醇∶Steedman’s wax=1∶3混合液,在37℃渗透2.5 h,再用纯Steedman’s wax在37℃渗透3次,每次2 h。将样品用纯Steedman’s wax在牛皮纸盒中包埋至凝固。后期蜡块的固着、整修、切片、贴片和展片等步骤参考王静,章英才等的方法[2-3,27]。
1.2.2 糖蛋白免疫荧光定位 切片脱蜡、复水、PBS淋洗浸泡、封闭液处理等参考王静,章英才等的方法[2-3,27]。然后用PBS(含1% BSA)以1∶100比例稀释后的AGPs单克隆抗体JIM13于4 ℃下孵育过夜,次日用PBS淋洗浸泡3次,每次10 min,以去除多余抗体,再用PBS(含1% BSA)以1∶300比例稀释后的碱性磷酸酶标记的山羊抗小鼠IgG二抗36℃黑暗条件下孵育1 h。标记后,PBS淋洗浸泡除去未标记的二抗,0.01% Toluidine blue染色去除植物本身的自发荧光,切片经PBS淋洗浸泡后封片。切片在OLYMPUS IX73荧光显微镜(Olympus,日本)和LEICA STELLARIS 5激光共聚焦显微镜(Leica,德国)下观察并拍照。
2 结果与分析
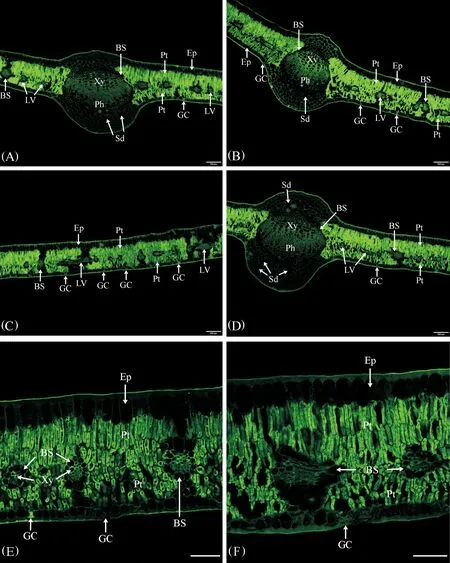
2.1 膨大前期叶AGPs分布特征
膨大前期叶AGPs的分布特征见图1。
(1)表皮:果实膨大前期叶上、下表皮均由一层排列紧密的细胞组成。上表皮细胞较大,近长方形,垂直于叶片方向的细胞壁较薄,抗体所识别的抗原荧光AGPs分布较少,而表皮细胞外切向壁较厚,抗体所识别的抗原荧光AGPs分布较多,形成了较厚的角质层;下表皮细胞较小,方形,抗体所识别的抗原荧光AGPs分布情况与上表皮相似,下表皮细胞外切向壁AGPs分布较多,同样形成了较厚的角质层;气孔仅分布于下表皮,孔下室较大,保卫细胞中分布着少量AGPs(图1A~E)。
(2) 叶肉:叶肉由6~7层细胞组成,靠近上表皮的叶肉组织由3层垂直于上表皮的长柱状栅栏组织细胞组成、排列很紧密,细胞壁和细胞内部均密集分布着抗体所识别的抗原荧光AGPs;近下表皮的叶肉组织主要由 3~4层短柱状的栅栏组织细胞组成,垂直于下表皮,排列也较紧密,细胞壁和细胞内部也密集分布着抗体所识别的抗原荧光AGPs(图1A~E)。由此看来,叶肉是叶AGPs分布的主要部位,灵武长枣叶为典型的等面叶,具有较典型的旱生结构特征。
(3)叶脉:灵武长枣叶具有3条发达的主脉,中间主脉维管束的直径较大,两侧主脉维管束直径略小(图1A,B,D,F)。主脉维管束由近轴面的木质部、形成层和远轴面的韧皮部组成。主脉木质部发达,主要包括多列导管和薄壁组织,每列均由6~7个放射状排列的导管组成,近形成层的导管直径相对较大,在木质部导管和薄壁组织细胞的细胞壁上密集分布着大量抗体所识别的抗原荧光AGPs,在近形成层的木质部中AGPs尤其丰富;木质部和韧皮部之间的形成层由多层扁平状细胞组成,细胞中分布着大量抗体所识别的抗原荧光AGPs;韧皮部由多层排列紧密的较小细胞组成,细胞壁和细胞内部均密集分布着抗体所识别的抗原荧光AGPs。维管束外由一圈卵圆形的分泌细胞形成维管束鞘的结构,细胞中没有抗体所识别的抗原荧光AGPs分布(图1A,B,D,F)。
主脉的上表皮之下为2~3层大小不等的厚角组织,细胞壁分布着较多抗体所识别的抗原荧光AGPs,紧邻其下为 4~5层圆形或卵圆形较大的薄壁细胞,细胞壁上也分布着较多抗体所识别的抗原荧光AGPs,其中分布有1~2个分泌道,内部没有AGPs荧光分布;下表皮之上为3~4 层形态较小的厚角组织,细胞壁和细胞内部均密集分布着抗体所识别的抗原荧光AGPs,紧邻其上为6~7层圆形或卵圆形较大的薄壁细胞,细胞壁和细胞内部抗体所识别的抗原荧光AGPs略少,其中分布有3~4个分泌道,内部没有AGPs荧光分布(图1A,B,D,F)。
在上下表皮间的叶肉中间部位,分布着比较小的侧脉和细脉,大部分叶脉被横切,有时可见叶脉的纵切,叶脉维管束的结构较简单(图1C,E)。外面是一圈含分泌物的薄壁细胞组成的维管束鞘,细胞中没有抗体所识别的抗原荧光AGPs分布,内部木质部和韧皮部细胞的细胞壁和细胞内部均密集分布着抗体所识别的抗原荧光AGPs(图1C,E)。
2.2 快速膨大期叶AGPs分布特征
(1)表皮:果实快速膨大期上表皮垂直于叶片方向的细胞壁较薄,抗体所识别的抗原荧光AGPs分布较少,表皮细胞外切向壁较厚,抗体所识别的抗原荧光AGPs分布较多,形成了较厚的角质层;下表皮抗体所识别的抗原荧光AGPs分布情况与上表皮相似,细胞外切向壁AGPs分布较多,同样形成了较厚的角质层,气孔保卫细胞中分布着少量AGPs(图2A~F)。
注:A~D为荧光显微镜图片,Bar=50 μm; E和F为激光共聚焦显微镜图片,Bar=50 μm。A、B:叶两侧主脉结构及叶AGPs分布;C、E、F:叶结构及AGPs分布;D:叶中间主脉结构及AGPs分布。Note:A~D are the pictures of fluorescence microscope, Bar=100 μm; E and F are the pictures of CLSM, Bar=50 μm. A, B:Bilateral main veins structure and AGPs distribution of leaf;C, E, F:Leaf blade structure and AGPs distribution;D:Middle main vein structure and AGPs distribution of leaf.图2 快速膨大期叶AGPs免疫荧光分布Fig.2 Immunofluorescence distribution of AGPs in leaf during the rapid enlargement period
(2)叶肉:叶肉组织的细胞组成、细胞排列情况与果实膨大前期叶基本相似,叶肉栅栏组织细胞的细胞壁和细胞内部均密集分布着抗体所识别的抗原荧光AGPs,AGPs分布特征也与膨大前期叶相同,叶肉栅栏组织是叶AGPs分布的主要部位(图2A~F)。
(3)叶脉:中间和两侧主脉维管束在木质部导管和薄壁组织细胞的细胞壁上分布着大量抗体所识别的抗原荧光AGPs,形成层和韧皮部细胞壁和细胞内部分布着较多抗体所识别的抗原荧光AGPs,相比果实膨大前期有所减少(图2A,B,D)。与果实膨大前期相似,维管束外由分泌细胞形成的维管束鞘细胞中基本没有抗体所识别的抗原荧光AGPs分布(图2A,B,D)。
主脉的上、下表皮之内的厚角组织细胞壁和细胞内部,以及紧邻其内的圆形或卵圆形较大薄壁细胞的细胞壁和细胞内部均分布着抗体所识别的抗原绿色荧光AGPs,但相比膨大前期叶略有减少(图2A,B,D);上、下表皮厚角组织内部薄壁细胞中分布的分泌道均没有AGPs荧光(图2A,B,D)。
上、下表皮间叶肉中间部位分布的侧脉和细脉,不论是横切还是纵切,维管束的结构均较简单(图2C,E,F)。与膨大前期叶相似,外面含分泌物的维管束鞘薄壁细胞中没有抗体所识别的抗原荧光AGPs,内部木质部和韧皮部细胞的细胞壁和细胞内部均密集分布着抗体所识别的抗原荧光AGPs(图2C,E,F)。
2.3 着色期叶AGPs分布特征
(1)表皮:果实着色期叶上、下表皮细胞壁上抗体所识别的抗原荧光AGPs分布情况与快速膨大期相似,表皮细胞外切向壁较厚,抗体所识别的抗原荧光AGPs分布较多,形成了较厚的角质层(图3A~F)。
(2)叶肉:与之前时期不同,果实着色期叶的叶肉组织细胞排列更加密集,即便是邻近下表皮处的栅栏组织细胞排列也非常紧密,而且叶肉栅栏组织细胞的细胞壁和细胞内部均密集分布着大量抗体所识别的抗原荧光AGPs(图3A~F)。
(3)叶脉:主脉维管束在木质部导管和薄壁组织细胞的细胞壁上密集分布着大量抗体所识别的抗原荧光AGPs,在近形成层的木质部中AGPs尤其丰富;形成层和韧皮部细胞壁和细胞内部分布着较多抗体所识别的抗原荧光AGPs(图3A,B)。主脉的上下表皮之下的厚角组织、薄壁细胞及分布的分泌道AGPs分布特征与膨大前期叶相似(图3A,B)。侧脉和细脉维管束的结构均较简单,内部木质部和韧皮部细胞的细胞壁和细胞内部均密集分布着抗体所识别的抗原荧光AGPs(图3C~F)。主脉、侧脉和细脉维管束外的维管束鞘细胞中基本没有抗体所识别的抗原荧光AGPs分布(图3C~F)。
2.4 完熟期叶AGPs分布特征
(1)表皮:果实完熟期叶上、下表皮细胞壁上抗体所识别的抗原荧光AGPs分布情况与之前时期相似,表皮细胞外切向壁抗体所识别的抗原荧光AGPs分布较多,形成了较厚的角质层(图4A~F)。
(2)叶肉:果实完熟期叶上、下表皮内的叶肉栅栏组织细胞与着色期相比排列更加紧密,栅栏组织细胞的细胞壁和细胞内部均密集分布着大量抗体所识别的抗原荧光AGPs(图4A~F)。
(3)叶脉:与着色期相似,各主脉维管束在木质部导管和薄壁组织细胞的细胞壁上密集分布着大量抗体所识别的抗原荧光AGPs,在近形成层的木质部中AGPs同样丰富;而韧皮部细胞壁和细胞内部分布着较多抗体所识别的抗原荧光AGPs(图4A~B)。主脉厚角组织、薄壁细胞及分泌道AGPs分布特征与着色期相似(图4A~B)。侧脉和细脉维管束木质部和韧皮部细胞的细胞壁和细胞内部均密集分布着抗体所识别的抗原荧光AGPs(图4C~F)。各叶脉维管束鞘细胞中均没有抗体所识别的抗原荧光AGPs分布(图4A~F)。
3 讨论与结论
1)阿拉伯半乳聚糖蛋白(AGPs)是一类高度糖基化的蛋白质[2-3],作为细胞壁-质膜连续体的结构元素而存在,AGPs可能与植物适应逆境条件有关[18]。许多研究表明富羟脯氨酸糖蛋白(HRGPs)作为植物细胞壁的一种结构蛋白,在植物抗冷害机制中发挥着重要作用[2-3],HRGPs重要成员阿拉伯聚半乳糖蛋白AGPs与植物冷害存在重要相互关系,被证明在胁迫下参与信号传导和细胞壁代谢[30]。棉花根部组织中的一个AGP基因GhAGP31在冷胁迫下表达量显著上升[31],表明AGPs参与了植物的抗寒过程。另有研究表明,低温可能导致“生理性干旱”胁迫的产生[32],低温不仅使夏威夷椰子叶片叶肉细胞Ca2+水平及细胞超微结构等内部结构发生变化、光合作用及蒸腾作用显著降低[33],而且AGPs的分布和表达也发生了变化。Yan等[34]采用免疫荧光标记技术研究了人工低温胁迫下多种AGPs在香蕉幼苗叶片中的分布及变化规律;王莹莹[28]以香蕉叶片为供试材料,利用9种识别AGPs的单克隆抗体,采用免疫荧光技术研究了自然低温胁迫下两种香蕉叶片抗原的分布及差异表达,探讨了AGPs在不同冷敏感程度香蕉叶片中的差异变化,不同抗体在两种香蕉叶片中所识别的抗原位置及含量变化趋势不同,揭示了AGPs与植物冷害的关系,认为香蕉中的AGPs基因MaFLA2-1、MaFLA17-3、MaFLA2-2的表达量可能与香蕉的抗冷性密切相关,表明这些 AGPs抗原也可能参与了香蕉的抗冷过程,揭示了AGPs与植物冷害的关系,丰富了植物抗冷机理,为香蕉抗冷育种工作提供参考。近年来发现,AGPs在植物应对生物及盐胁迫等非生物胁迫过程中也扮演着重要角色[35-36],Lamport等[36]利用盐胁迫分析AGPs功能认为,阿拉伯半乳聚糖蛋白(AGPs)通过未知机制参与细胞扩张,因此AGPs含量和细胞扩张速率可能存在相关性,盐胁迫使烟草BY-2细胞中AGPs大量上调,AGPs通过高度多孔的果胶网络扩散的速度大大提高。由此看来,AGPs在植物应对低温、盐碱胁迫导致的生理干旱等非生物胁迫过程中发挥了重要作用。
不仅如此,低温等非生物胁迫还可能影响AGPs在植物体中的分布[30]。Leszczuk等[18]在低温对雏菊(Bellisperennis)胚珠和花药发育过程中AGPs分布变化影响研究中,利用识别AGPs碳水化合物链的特异性抗体(JIM13、JIM15、MAC207)免疫细胞化学研究表明,在雏菊发育的第一阶段,AGPs在雌性和雄性生殖结构中的分布发生了明显变化。通常情况下,AGPs具有特定持久的时空分布方式,AGPs抗原表位可见于每个形成阶段的大孢子母细胞壁、大孢子和胚囊中,而在胁迫条件下的发育过程中,AGPs的定位发生改变,AGPs在胚囊壁中完全消失;在雄性部位发育的过程中,AGPs在正常情况下存在于绒毡层、小孢子母细胞和小孢子中,为了响应低温发育,AGPs定位于小孢子的公共壁和成熟花粉粒中,此外,AGPs在残余的绒毡层细胞中积累[18]。
宁夏是我国西北地区干旱半干旱荒漠与草原的过渡地带,全区3/4以上属干旱区。水分是限制该地区植物生长、产量和分布的主要因素之一,在所有的非生物限制因子中占首要地位[37]。叶与干旱环境的关系最密切,反应最敏感,环境不仅影响叶的外部形态,同时也影响着叶的内部构造和生理活动[38],其中叶结构特征最能体现植物对干旱环境的适应性[39]。灵武长枣是具有宁夏地方特色的药食同源鲜果品种,抗寒、耐盐碱、耐高温和干旱[40]。作为干旱盐碱地和沙荒地种植的先锋树种,灵武长枣叶演化出了具有较粗的叶脉,发达的机械组织,叶肉组织排列紧密,全部由多层栅栏组织组成,表皮有较厚的角质层,气孔通常只分布在叶的下表皮等多种适应性结构,逐渐形成多种抗旱、耐旱的形态结构及对应的AGPs分布特征,在叶表皮细胞外壁、栅栏组织细胞、维管束木质部和韧皮部、机械组织等分布了大量的AGPs,反映了干旱条件下叶结构的适应性与各部位AGPs分布的相关性。从干旱缺水到营养器官和生殖器官的热胁迫,AGPs被认为有助于植物应对生物和非生物胁迫的反应[41]。
2)AGPs糖蛋白在植物营养生长与生殖生长和发育过程中发挥着重要作用[2-3,42],但对植物叶发育中AGPs的研究较少。王莹莹[28]发现,抗体JIM4、JIM8、JIM14、JIM15和LM2等所识别的AGPs抗原在香蕉叶表皮、保卫细胞均有分布,既具有保护作用,又抵御了低温胁迫。Domon等[43]发现,芒草(Miscanthus)在低温胁迫下细胞壁中(1→3),(1→4)-β-D-glucan含量均表现上升,植物细胞壁成分的改变与植物抗寒性有着密切关系。植物在生长过程中受到生物胁迫或者非生物胁迫后,细胞壁的某些特性会发生极大改变,这些胁迫会改变细胞壁组分的含量及结构,从而改变细胞壁的机械性能,这种细胞壁机械性能的改变可以认为是植物对外界环境胁迫的一种响应[2-3,28]。本研究中,不同时期叶表皮的细胞壁及外壁中分布的AGPs,在干旱下诱发了表皮细胞壁的增厚和外壁中较厚角质的产生,减少了植物体内水分的过分蒸腾流失,使叶肉细胞更有效地利用水分,更好地发挥了保护及抵御干旱的功能。
旱生植物的叶肉向着提高光合效能、合成更多有机物以抵抗干旱的方面发展[39],灵武长枣叶高度发达的栅栏组织既避免了干旱地区强烈光照对叶肉细胞的损伤,又可以有效利用衍射光进行光合作用,即栅栏组织越厚、栅栏组织细胞越小且排列越紧密,则植物利用光能的效率越高[38]。干旱胁迫下,马尾松针叶通过增加绿色折叠薄壁组织厚度维持较高的光合能力[44]。研究表明,低温胁迫下,香蕉叶片组织细胞内的一些可溶物含量也在发生着改变,可溶性总糖、还原糖、甘油及可溶性蛋白质的含量均随着温度的降低而升高,并且淀粉与糖之间的转化与植物的抗冷性有着密切关系[45]。烟草AGPs从引导组织向花粉管转移,为花粉管的生长提供营养支持[46]。本研究表明,灵武长枣4个时期叶栅栏组织细胞的细胞壁和细胞内部都分布有大量JIM13抗体所识别的抗原,基本没有明显的变化,叶肉始终是叶AGPs分布的主要部位。叶肉栅栏组织细胞是植物进行光合作用的主要场所,栅栏组织细胞中大量的AGPs可能既参与了叶营养物质的合成,又作为营养物质来源,为植物的生长发育和后期果实营养物质的积累提供了保障和营养支持[2]。
3)细胞壁由纤维素、半纤维素、果胶质及AGPs等细胞壁结构蛋白共同构成[2,47],参与了植物细胞的生长发育、抗寒和抗旱等多种生命过程[2,28]。本研究表明,在灵武长枣4个时期叶主脉和侧脉维管束木质部和韧皮部所有细胞的细胞壁和细胞内部都分布有JIM13抗体所识别的抗原,基本没有明显的变化。AGPs可能参与了木质部和韧皮部纤维素等细胞壁物质的沉积,以及木质部导管的分化和细胞壁的进一步增厚等过程[2-3,27,48]。灵武长枣叶脉维管组织中分布的AGPs参与了叶脉维管束发育过程的形态建成,为干旱条件下水分和养分的高效运输提供了保障[2,27]。另外,王莹莹[28]发现多种不同抗体识别的维管束中AGPs抗原主要分布在香蕉叶脉的厚壁细胞和维管束鞘、木质部、韧皮部,而本研究结果略有不同,不论灵武长枣叶的主脉和侧脉,在维管束鞘细胞中基本上都没有AGPs的分布,可能与不同植物种类的叶结构差异有关,有可能还与维管束鞘中所含不同成分相关。AGPs不仅是细胞壁多糖的组分,而且可能参与了灵武长枣叶维管束鞘细胞中分泌物的形成和积累,既提高了细胞液浓度,增大渗透势,又利于保水抗旱。
