拐枣不同部位多糖的结构特征及活性分析
2023-10-10王洁毕金峰吴群军苟敏周润生陈芹芹
王洁,毕金峰,吴群军,苟敏,周润生,陈芹芹*
(1.中国农业科学院农产品加工研究所,农业农村部农产品加工重点实验室,北京 100193)(2.旬阳县太极缘生物科技有限公司,陕西安康 725700)
拐枣又称枳椇(Hoveniadulcis),是一种鼠李科(Rhamnaceae)枳椇属植物,用于中国传统医学已有上千年历史,其叶子、种子、果梗、树皮和根均可入药,具有消渴、解酒、护肝等功效[1]。拐枣果实产量丰富,每亩年产量可达2 000~3 000 kg。拐枣中含有多种生物活性功能成分,如多糖、黄酮、生物碱等,其中拐枣多糖作为一种天然的高活性物质,在拐枣中干重占比高达10.47%[2]。拐枣果梗多糖具有良好的降糖作用,能够有效抑制α-葡萄糖苷酶活性[3-5]、使大鼠体重增加[6]、降低空腹血糖[7]。且相比于传统的药物治疗,多糖具有细胞毒性低、安全性高等优点,因此成为了治疗糖尿病及其并发症的理想药物。多糖的降血糖特性归因于许多分子机制,如通过对氧化应激损伤的防御以减少糖尿病及其并发症[8],调节和延缓主要消化酶α-葡萄糖苷酶的活性以降低胃肠道中碳水化合物的吸收率,对PI3K/Akt、MAPK等胰岛素信号通路的激活作用等[9]。
拐枣的果实包括果梗及种子,其中果梗约占果实鲜重的90%以上[10]。目前,果梗多用于饮料生产,产品种类较少,大多只是经过简单粗加工便进入市场,产品资源附加值较低[6]。拐枣籽多用于传统中药,研究多集中于小分子物质如黄酮的提取及活性分析[11]。越来越多的研究发现,从植物不同部位获得的多糖具有不同的性质[12]。辛玥等[13]研究发现豇豆多糖的全豆多糖与子叶多糖结构相似,与种皮多糖差异性较大,且种皮多糖的抗氧化活性要明显强于其他多糖。Bai等[14]对人参不同部位多糖的提取率及结构与活性差异进行了研究,结果表明,不同部位多糖提取率的大小顺序为根>花>叶,人参花多糖的分子量最低,抗氧化和α-葡萄糖苷酶抑制活性最佳。然而,目前对拐枣资源的研究及利用方面多集中在拐枣果梗多糖,但对于拐枣籽、果梗及全果多糖的提取率、结构、活性的对比还缺乏系统的研究。因此,本研究对拐枣不同部位(拐枣籽、果梗及全果)多糖的结构和生物活性进行比较,相关结果将为拐枣多糖在降血糖方面的潜在应用及拐枣的全果开发利用提供理论依据,为提升拐枣资源的附加值提供一条新的途径。
1 材料与方法
1.1 材料与试剂
拐枣,由陕西安康旬阳县太极缘生物科技有限公司提供。
HepG2细胞,中国医学科学院基础医学细胞资源中心;无水乙醇、丙酮、乙醚,国药集团化学试剂有限公司;四硼酸钠、4-硝基苯-α-D-吡喃葡萄糖苷(4-Nitrophenyl-α-D-Glucopyranoside,PNPG)、α-葡萄糖苷酶、胰岛素、地塞米松,上海源叶生物科技公司;1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-Picrylhydrazyl,DPPH)、2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-Amino-Bis(2-Ethylbenzothiazoline-6-Sulfonic Acid) Ammonium Salt,ABTS),美国Sigma-Aldrich公司;DMEM培养基、胰酶,美国Gibco公司;葡萄糖含量试剂盒,苏州格锐思生物科技公司;以上试剂除特别说明外均是分析纯级。
1.2 仪器与设备
CPA-12电子天平,德国Sartorius公司;DHG-9123A电热恒温鼓风箱、DK-S26电热恒温水浴锅,上海精宏实验设备有限公司;JP-150高速多功能粉碎机,永康久品工贸有限公司:3K15离心机,艾本德中国有限公司;VORTEX-5旋涡混合器,海门市其林贝尔仪器制造有限公司;UV-1800紫外-可见分光光度计,日本岛津公司;S-570扫描电子显微镜,日本日立公司;ICS-3000离子色谱仪,美国戴安公司;DAWN HELEOS-II多角度激光光散射/凝胶色谱联用仪,美国Wyatt公司;TENSOR27傅里叶红外仪,德国Bruker公司;雷磁PHS-3C pH计,上海仪电科学仪器股份有限公司;Varioskan Flash酶标仪,美国Thermo Scientific。
1.3 实验方法
1.3.1 拐枣多糖的提取
水提醇沉法制备拐枣多糖[4,15]。将拐枣籽、果梗及全果于60 ℃下烘干,再分别用植物粉碎机粉碎,过60目筛。取各部位粉末各100 g,加入φ=95%乙醇250 r/min磁力搅拌24 h,期间更换乙醇4次,以除去脂肪、色素等小分子物质。抽滤,弃去上清液,将残渣置烘箱中40 ℃干燥。
称取10 g预处理的各部位原料,按照1:30的料液比,90 ℃水浴浸提多糖3 h,离心,获得上清液,残渣以同样的条件处理一次,合并上清液,50 ℃旋蒸浓缩至原体积的1/3。加入3%(m/V)的胰酶,37 ℃震荡4 h,以除去游离蛋白质,酶解完成后,沸水浴10 min灭酶,冷却至室温,离心除去沉淀物。向多糖提取液中加入4倍体积无水乙醇,4 ℃静置过夜,8 000 r/min离心10 min,收集沉淀。沉淀分别用无水乙醇、丙酮、乙醚洗涤,干燥后得到各部位多糖。
1.3.2 多糖成分分析
采用苯酚-硫酸法测定多糖中的总糖含量[16];糖醛酸含量参照Peng等[17]的方法,采用分光光度法,以半乳糖醛酸作为标准物质测定;以牛血清白蛋白为标准品,采用考马斯亮蓝法测定多糖中的蛋白质含量[18];以没食子酸为标准品,采用福林酚法测定多糖中的酚类含量[19]。
1.3.3 分子量分布测定
采用高效尺寸排阻色谱(HPSEC)系统分析拐枣多糖的分子量。HPSEC系统配备有TSK凝胶柱(TSK Gel G4000PWxl,300×7.8 mm)、激光散射检测器(DAWN HELEOS II,Wyatt Technology)、紫外检测器(L-2400,Wyatt Technology)和示差折光仪(RI)(OptilabrEX,Wyatt Technology)。10.0 mg拐枣多糖完全溶解于0.1 mol/L氯化钠水溶液中,之后经0.45 μm滤膜过滤。然后将样品(200 μL)注入TSK凝胶柱。用0.1 mol/L的NaCl溶液、流速0.5 mL/min洗脱30 min,柱温为35 ℃。
1.3.4 单糖组成
根据Zhou等[20]报道的方法,采用ICS-3000离子色谱系统(Dionex,Sunnyvale,CA,USA)对拐枣多糖的单糖组成进行了分析,并进行了适当修改。称取约10 mg多糖于水解管中,准确记录多糖质量。加入4 mL 2 mol/L的三氟乙酸,充氮1 min排除空气,于120 ℃烘箱中水解2 h,冷却后氮吹除去三氟乙酸,蒸馏水溶解定容至5 mL。样品稀释一定倍数,过0.2 μm滤膜后进样。使用Carbo Pac PA20类型的分析柱,选用0.25 mol/L氢氧化钠及1 mol/L醋酸钠作为本试验的流动相,检测器采用脉冲安培检测器。
1.3.5 红外光谱
将干燥的多糖样品(2 mg)与KBr粉末混合研磨后压片,在400~4 000 cm-1范围内,用Vector 33红外分光光度计进行扫描,以溴化钾为对照扣除背景[21]。
1.3.6 抗氧化活性测定
1.3.6.1 DPPH自由基清除实验
根据Wang等[22]的方法,对多糖的DPPH自由基除能力进行测定,并稍作修改。用φ=80%甲醇配制浓度为100 μmol/L的DPPH溶液,将HDP溶解在去离子水中以获得各种浓度梯度的多糖溶液,然后将80 μL DPPH溶液加入到40 μL样品溶液中。混合后于室温下避光反应,30 min后用酶标仪在波长517 nm下测量吸光值,每个样品做三个平行。以抗坏血酸作为阳性对照,根据以下公式计算DPPH自由基清除率:
式中:
A2——样品组的吸光度;
A1——对照组吸光度,包括80 μL 80%甲醇溶液和40 μL样品;
A0——空白组的吸光度,包括80 μL DPPH和40 μL去离子水。
1.3.6.2 ABTS自由基清除实验
使用去离子水制备样品溶液(0~10 mg/mL)。用移液器吸取0.1 mL待测液,加入3.6 mL ABTS溶液完全混合,室温静置1 min,然后测量波长为734 nm的反应溶液的吸光度值[23]。ABTS自由基清除率计算如下:
式中:
A2——样品组的吸光度;
A1——对照组吸光度,包括3.6 mL的80%甲醇溶液和0.1 mL多糖样品;
A0——空白组的吸光度包括3.6 mL的ABTS和0.1 mL去离子水。
1.3.7α-葡萄糖苷酶抑制活性实验
参考Jia等[24]的方法测定多糖对α-葡萄糖苷酶的抑制能力,并稍作修改。将40 μL的α-葡萄糖苷酶溶液与40 μL多糖溶液混合均匀,在37 ℃恒温培养箱中孵育15 min,然后向混合溶液中加入20 μL PNPG溶液启动反应,混匀后于37 ℃孵育15 min,最后向反应液中加入150 μL碳酸钠溶液停止反应后,于405 nm波长处测定吸光度值。HDP对α-葡萄糖苷酶的抑制率计算如下:
式中:
A2——样品组的吸光度,反应物包括40 μL多糖、40 μL酶和20 μL PNPG的混合液;
A1——对照组的吸光度,是缓冲溶液代替酶溶液后混合物的吸光度值;
A0——空白组的吸光度,是缓冲溶液代替样品溶液的吸光度值。
1.3.8 拐枣多糖样品对HepG2胰岛素抵抗细胞葡萄糖摄取的测定
1.3.8.1 拐枣多糖样品对HepG2细胞存活率的影响
接种200 μL HepG2细胞于96孔板中,使细胞密度为每孔2×104个,在CO2培养箱中培养过夜,至细胞密度达到80%左右,吸出培养基,每孔加入200 μL含有多糖样品的培养基,同时设置空白组、对照组,继续培养24 h,然后用PBS洗涤1次,每孔加入200 μL的培养基及20 μL的MTT溶液,继续培养4 h。去除MTT溶液后,在每孔中加入150 μL二甲亚砜,震荡10 min后在490 nm处测定各孔的吸光值[25]。
式中:
A样品——添加多糖及细胞;
A对照——添加细胞未添加多糖;
A空白——未添加多糖和细胞。
1.3.8.2 HepG2细胞胰岛素抵抗模型葡萄糖摄取的建立
将200 μL HepG2细胞以每孔2×104个的密度接种于96孔板上,培养过夜后,移去培养基。PBS洗涤,分别以终浓度为5×10-7mol/L的胰岛素DMEM培养液[25]、终质量浓度为10 μg/mL的胰岛素和0.5 mmol/L的油酸的DMEM培养液[6]、含有3 μmol/L地塞米松[26]的DMEM培养液进行诱导培养48 h,培养结束采用葡萄糖氧化酶-过氧化物酶法,根据葡萄糖试剂盒步骤测定上清液葡萄糖含量,并按公式(5)计算葡萄糖消耗率,选择葡萄糖消耗能力最弱组为胰岛素抵抗模型。
式中:
R——葡萄糖消耗率,%;
C空白——未添加细胞组的葡萄糖含量,mg/mL;
C模型——添加细胞及多糖组的葡萄糖含量,mg/mL。
1.3.8.3 葡萄糖消耗率测定
胰岛素抵抗细胞模型建立之后,吸去培养基,用PBS洗涤后,吸去各孔培养液,加入含有不同浓度多糖的培养基培养24 h,结束后吸取上清液采用葡萄糖试剂盒测定葡萄糖含量,并计算葡萄糖消耗率。
1.3.9 数据分析
采用SPSS 26软件进行单因素方差分析和邓肯多重比较,P<0.05表示差异显著,结果以平均值±标准偏差表示;使用Origin 2021软件作图。
2 结果与分析
2.1 多糖提取率及化学组成分析
拐枣不同部位水提多糖(HoveniadulcisPolysaccharide,HDP)的得率与化学组成如表1所示。全果多糖(Whole Fruit Polysaccharide ofH.dulcis,HDPW)、籽多糖(H.dulcisSeed Polysaccharide,HDPS)和果梗多糖(H.dulcisPeduncles Polysaccharide,HDPP)的得率分别为3.83%、2.69%、3.00%,三个部位的得率没有显著性差异。三种多糖的总糖、糖醛酸、蛋白和总酚的质量分数范围分别为30.98%~33.46%、3.72%~13.75%、9.21%~27.39%、8.02%~14.87%,其中糖醛酸含量,蛋白含量及总酚含量存在显著性差异(P<0.05)。HDPP的总糖含量及总酚含量最高,分别占比33.46%和14.87%,总糖含量与Liu等[27]报道的33.34%含量近似,总酚含量低于Liu等报道的27.76%,这可能与拐枣的产地及采收期的不同有关。HDP中存在蛋白及酚,可能是由于氢键和疏水相互作用以及疏水腔和裂缝的存在会介导多糖与蛋白及酚形成偶联物[28],拐枣多糖倾向于以结合物的形式存在,是由拐枣的原料特性所决定,茶叶、洋甘菊、紫锥花、加拿大飞蓬等植物的多糖存在相似的情况[29]。

表1 拐枣不同部位多糖的提取率及化学组成Table 1 Yield and chemical composition of polysaccharides from different sources of H.dulcis
2.2 分子量及单糖组成
采用高效凝胶排阻色谱测定了不同部位多糖的分子量,如表1所示。三种多糖分子量的色谱峰均出现三个尖峰,三个分子峰的分布范围分别为476.90×104~865.25×104u、12.53×104~165.75×104u、0.34×104~45.72×104u。HDPS的中、低分子量值(45.72×104~165.75×104u)要高于HDPW(0.34×104~12.53×104u)和HDPP(0.51×104~21.26×104u)。
Mw/Mn,为多分散性指数,反映了聚合物摩尔质量分布的宽度。单分散聚合物的多分散性指数值为1,较高的Mw/Mn值表示较宽的摩尔质量分布[30]。其中HDPW、HDPS、HDPP峰1~3的Mw/Mn范围分布分别为1.43~2.08、1.23~3.42和1.46~2.33。多分散性指数均高于1,但其数值较小,说明拐枣多糖由多分散杂多糖组成,分子质量分布广泛。
根据离子色谱分析,三种多糖均为非均一性多糖,它们主要由岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、甘露糖、半乳糖醛酸和葡萄糖醛酸组成,但是单糖组成摩尔比存在显著性差异(P<0.05)。HDPS的主要单糖成分为半乳糖、甘露糖、阿拉伯糖,而HDPW和HDPP的优势单糖为葡萄糖、半乳糖、阿拉伯糖,但二者摩尔比不同,分别为51.66:22.85:14.03和30.77:35.32:19.90。在糖醛酸摩尔比方面,三种多糖中HDPS的半乳糖醛酸和葡萄糖醛酸所占摩尔比值总和最高,这与糖醛酸指示剂的测定结果趋势相同。
2.3 红外光谱
多糖的红外光谱如图1所示,三种多糖的图谱未出现较多的个数变化及明显的位置偏移,三种多糖均在3 390、2 931、1 618、1 230 cm-1等处出现吸收峰。3 390 cm-1处的强吸收峰,为多糖羟基的O-H伸缩震动,2 931 cm-1处的吸收峰,为多糖C-H伸缩振动引起,1 230 cm-1处是硫酸基中S=O的伸缩振动吸收[31]。1 618 cm-1处的强峰为羧基(COO-)的特征峰,表明含有糖醛酸[3],这与糖醛酸测定结果及单糖分析结果相一致。1 200~1 000 cm-1波数之间的强吸收峰处的谱带显示了C-O-C和C-O-H键的存在,表明多糖内含有吡喃糖环[32]。1 399 cm-1处吸收峰是-CH2的变形吸收峰[33]。在880 cm-1和840 cm-1位置处的吸收峰出现了区别。880 cm-1处的吸收峰表明HDPS含有β-糖苷键连接的吡喃糖,840 cm-1处的特征吸收峰表明HDPP和HDPW含有α-糖苷键连接的吡喃糖[34]。
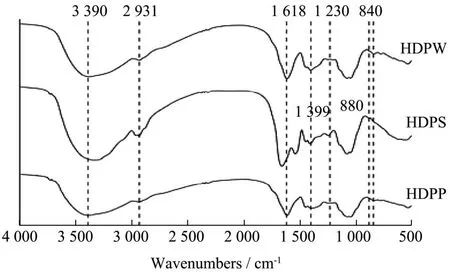
图1 HDPW、HDPS和HDPP的红外光谱图Fig.1 FT-IR spectra of HDPW, HDPS and HDPP
2.4 抗氧化活性分析
氧化反应与许多疾病密切相关,如糖尿病及其并发症的发生,氧化应激能够启动一系列导致胰岛素抵抗和糖尿病的有害通路,因此通过抗氧化治疗以减轻氧化应激对人体的损伤,已成为防治糖尿病的有效途径之一。
三种多糖和Vc的DPPH自由基清除率如图2a所示。HDP均对DPPH具有良好的清除能力,且清除效果与多糖的质量浓度呈剂量依赖关系。HDPW、HDPS、HDPP对DPPH自由基的IC50值分别为0.016、0.043和0.015 mg/mL(P<0.05),3种拐枣多糖和Vc对DPPH自由基的清除能力由大到小依次为Vc>HDPP>HDPW>HDPS。图2b为三种多糖对ABTS+自由基的清除效果。HDPW、HDPS、HDPP均具有良好的ABTS+自由基清除能力,随着拐枣多糖质量浓度增加,ABTS+自由基清除能力均呈上升趋势。HDPW、HDPS、HDPP和Vc对ABTS+自由基的IC50值分别为0.47、1.21、0.49和0.10 mg/mL(P<0.05),其中HDPW的清除能力最强,但HDP都弱于Vc的清除能力。
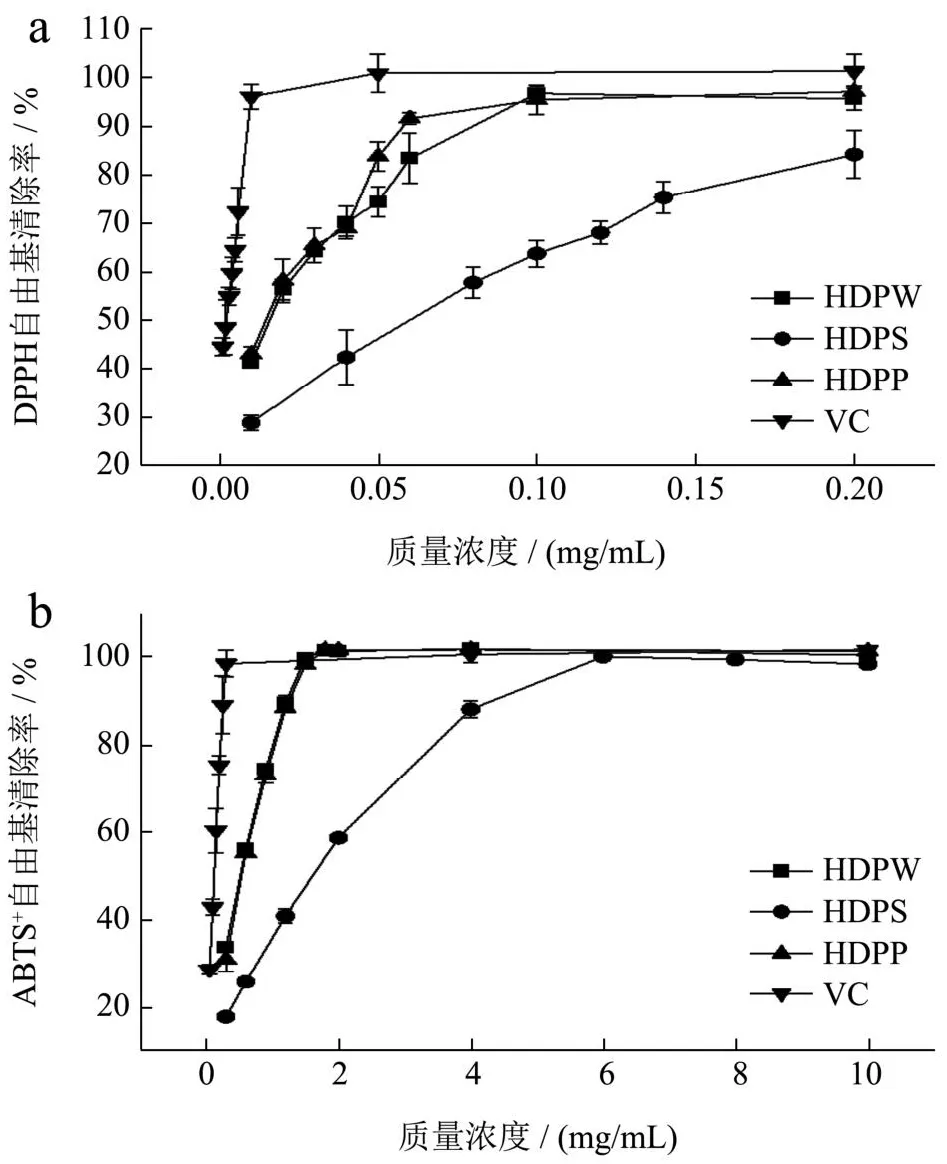
图2 HDPW、HDPS和HDPP对DPPH自由基(a)和ABTS+自由基(b)的清除能力Fig.2 Scavenging activity of DPPH free radical (a) and ABTS+free radical (b) of HDPW, HDPS and HDPP
植物多糖的抗氧化活性在很大程度上取决于化学组成、分子量以及分支的程度和大小[35,36]。多糖的分子量与其生物活性密切相关[33],低分子量的多糖由于其末端具有较强的还原羟基,往往具有较强的抗氧化活性。从表2所示,HDPW、HDPP的中低分子量低于HDPS,这意味着分子量可能是影响HDP还原能力的因素之一。分子量大的高聚物结构紧凑,分子内氢键的作用更强。分子内氢键的强烈作用削弱了羟基的活性,可能限制了其羟基暴露的机会,这可能是其自由基清除活性降低的原因[37]。
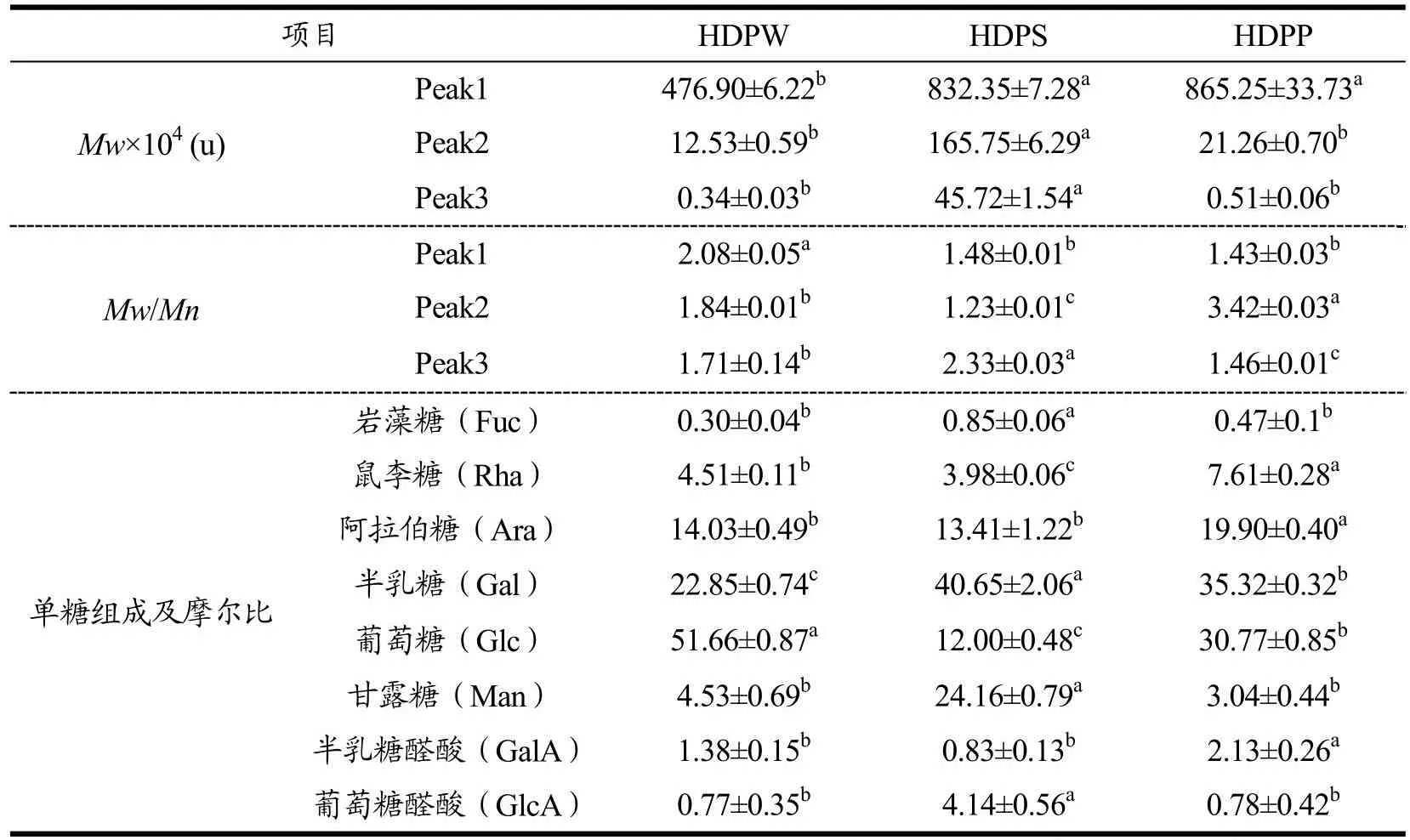
表2 拐枣不同部位多糖的分子量(Mw)、多分散性(Mw/Mn)和单糖组成(%)Table 2 Monosaccharide composition and molar ratio of polysaccharides from different sources of H.dulcis (%)
2.5 α-葡萄糖苷酶抑制活性
α-葡萄糖苷酶位于小肠中,可以将摄入的淀粉分解为葡萄糖使餐后血糖水平升高,因此,通过抑制α-葡萄糖苷酶活性调节饮食后的血糖峰值是一个很好的策略。目前,α-葡萄糖苷酶抑制模型已被广泛用于评价药物体外降糖活性[21]。图3为不同质量浓度的HDP对α-葡萄糖苷酶的抑制活性。HDP在体外条件下对α-葡萄糖苷酶具有的剂量依赖性抑制作用。多糖质量浓度为10.0 mg/mL时,HDPW、HDPS、HDPP对α-葡萄糖苷酶的抑制率最高,分别为91.77%、51.36%和89.02%,IC50值分别为0.14、9.99和0.13 mg/mL,抑制能力从大到小为HDPP>HDPW>HDPS,这可能是由于HDPP和HDPW的中低分子量较低。Xu等[38]用H2O2对黑加仑多糖进行了降解,获得了两种更低分子量的多糖,降解后的多糖比原多糖具有更佳的抗氧化、α-淀粉酶和α-葡萄糖苷酶抑制活性,且分子量越低,活性越高。此外,红外光谱显示HDPP和HDPW中含有α-糖苷键而HDPS中含有β-糖苷键,前人研究表明,含有α-糖苷键的多糖会显示出更好的生物活性,如南方红豆杉的抗肿瘤活性[39],桑黄菌丝体的抗氧化及肿瘤抑制活性[40]。
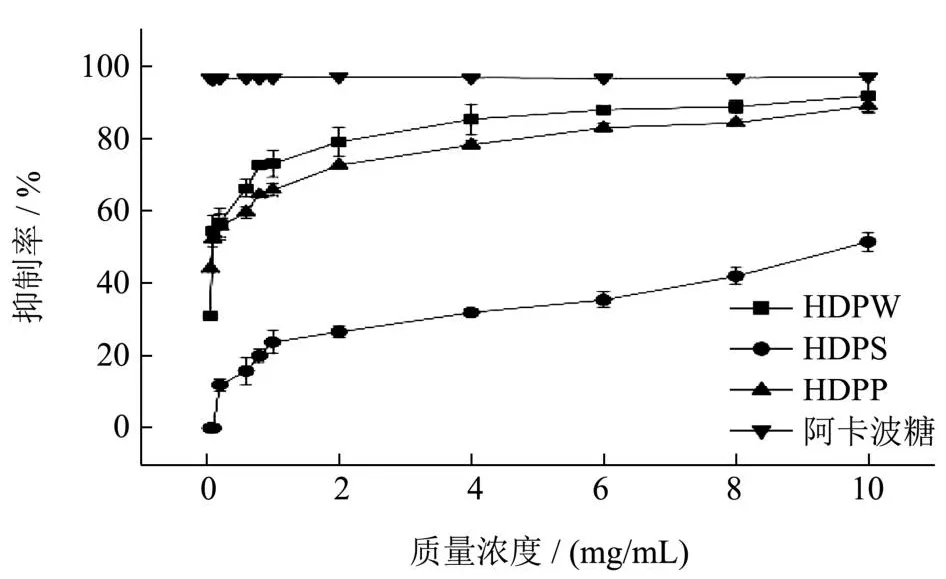
图3 HDPW、HDPS和HDPP对α-葡萄糖苷酶的抑制效果Fig.3 Inhibitory effects of HDPW, HDPS and HDPP on α-glucosidase
2.6 拐枣多糖样品对HepG2胰岛素抵抗细胞葡萄糖摄取的测定
2.6.1 拐枣多糖样品对HepG2细胞存活率的影响
采用MTT法检测多糖及盐酸二甲双胍对HepG2细胞存活率的影响,结果如图4所示。0.05~1 mg/mL浓度下的多糖样品及二甲双胍均无细胞毒性,当HDPW和HDPP的质量浓度为5 mg/mL时,HepG2存活率显著降低,分别为18.57%和20.96%。而二甲双胍组质量浓度为1 mg/mL时,细胞的存活率83.88%,细胞存活率显著降低。因此分别选取0.05、0.10、0.50 mg/mL作为低、中、高剂量组进行后续实验。
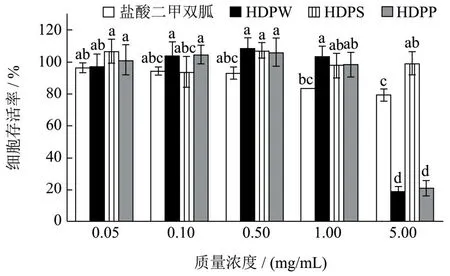
图4 HDP对HepG2细胞存活率的影响Fig.4 Effects of HDP on the survival rate of HepG2 cells
2.6.2 HepG2细胞胰岛素抵抗模型(IR-HepG2)的建立
在胰岛素、胰岛素联合油酸、地塞米松的作用下,HepG2的葡萄糖消耗率较空白组均发生显著降低,葡萄糖消耗率分别减少了10.42%、7.64%及14.41%(图5)。其中地塞米松作为诱导剂时其葡萄糖消耗率降低效果最明显,因此选用地塞米松作为后续IR-HepG2细胞实验诱导剂。
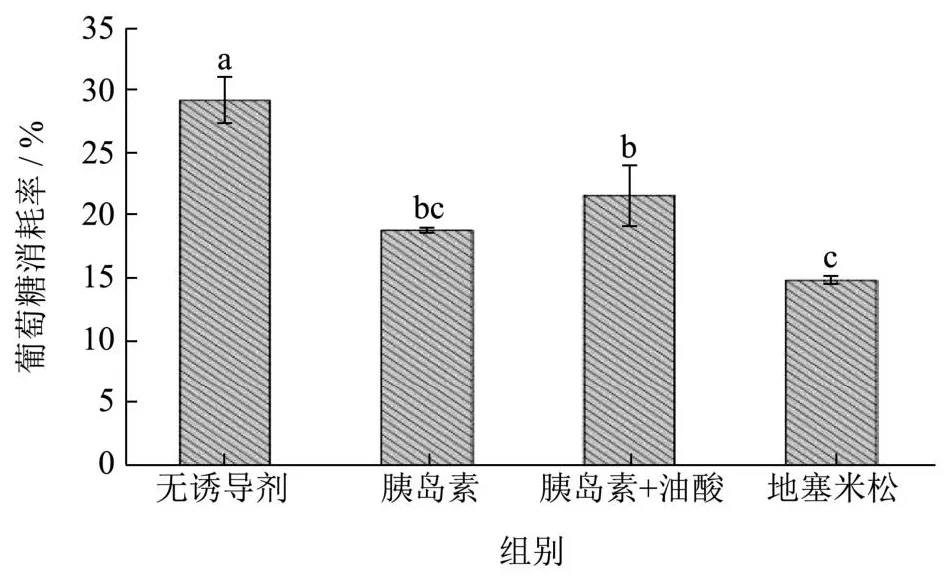
图5 不同诱导剂诱导构建IR-HepG2Fig.5 Construction of IR-HepG2 induced by different inducers
2.6.3 葡萄糖消耗量测定
胰岛素抵抗是引发Ⅱ型糖尿病的主要原因,肝细胞作为胰岛素作用的主要靶细胞,发生胰岛素抵抗后主要表现为葡萄糖利用率降低,由此引发空腹高血糖症状。HepG2细胞具有与正常肝细胞相同的糖代谢功能,且更易培养,被广泛用于筛选糖尿病治疗药物。图6为多糖对胰岛素抵抗的治疗效果。加入多糖后,IR-HepG2细胞葡萄糖吸收率较模型组有所提高。其中HDPS的胰岛素抵抗改善效果弱于HDPW和HDPP,中高剂量组的HDPW和HDPP可显著提高IR-HepG2细胞的葡萄糖消耗率。在多糖质量浓度为0.5 mg/mL时,HDPW、HDPP较模型组的葡萄糖吸收率可提高7.52%、7.66%,但是HDPS较模型组没有显著的提高作用。各剂量组内的HDPW和HDPP的葡萄糖消耗促进能力没有显著性差异。这种降糖活性与它们的结构特征有关,低分子量的HDPP和HDPW具有较好的胰岛素抵抗改善能力,这可能是低分子量的多糖更容易进入细胞,更容易修复IR-HepG2细胞的表面损伤。
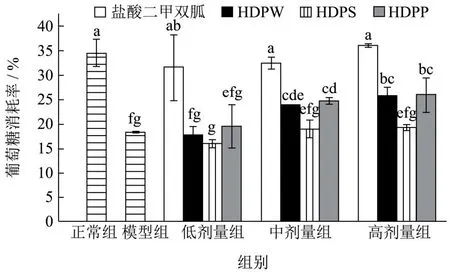
图6 HDP对IR-HepG2葡萄糖消耗率影响Fig.6 Effect of HDP on glucose consumption rate of IR-HepG2
3 结论
本研究采用水提醇沉法制备了拐枣全果、籽及果梗三种部位的多糖,HDPW、HDPS、HDPP得率分别为3.83%、2.69%、3.00%。其中,HDPW及HDPP具有α-糖苷键结构,而HDPS具有β-糖苷键结构。HDPP和HDPW的抗氧化、α-葡萄糖苷酶抑制活性及胰岛素抵抗改善能力明显高于HDPS。HDPW具有最佳的ABTS清除活性,而在DPPH清除、α-葡萄糖苷酶抑制及胰岛素抵抗改善能力方面,HDPW和HDPP之间没有显著性差异。由于果梗与籽的分离较为繁琐,所以在工业上可以考虑进行全果综合利用。
