基于核酸适配体传感器的即时检测(POCT)技术*
2023-10-10朱春燕朱春楠刘晓军郑冬云
方 依 朱春燕 何 平 朱春楠 刘晓军 郑冬云 刘 超
(中南民族大学生物医学工程学院,武汉 430074)
近年来,受全球大范围传染性疾病爆发、医疗急救诊断需求上升、慢性病患者居家诊断需求上升等因素影响,传统生化检测实验室面临检测成本高、耗时长、依赖专业操作人员等一系列难题。尤其是在医疗资源缺乏地区,传统实验室已无法满足突发公共卫生事件的检测需求。因此,低成本、简单快捷、不依赖大型仪器、检测准确度高、可现场采样与分析的即时检测(point-of-care testing,POCT)技术日益受到人们的关注。该技术的发展对于疾病的有效诊断、疗效监控和疫情的防控具有十分重要的意义[1]。在即时检测传感器的组成中,识别分子元件是即时检测传感器的关键组成部分,决定了传感器的灵敏度、特异性、稳定性和响应时间。多肽、酶、抗体等蛋白质分子作为识别元件[2-4],在即时检测中得到了有效应用。然而,这些分子存在成本高、识别对象有限、不易于保存等众多缺点,极大地限制了其应用范围。相较于抗体,核酸适配体具有易实现选择性修饰、合成效率高、批间差异小、生产成本低等突出优势[5-8]。研究人员将核酸适配体与酶、纳米材料等偶联,结合核酸信号放大技术,在电化学与光学传感平台实现了多种疾病标志物的快速检测[9-10]。基于此,本文首先论述了核酸适配体的筛选策略及其研究新进展,其次,介绍了核酸适配体POCT传感器的分子信号放大策略,以及常用传感器类型与应用,最后,探讨了核酸适配体在POCT领域中面临的挑战,并展望了该技术的发展趋势。
1 核酸适配体筛选
核酸适配体又称为化学抗体[11],是一段碱基数目小于100的单链DNA或RNA分子[12]。核酸适配体分子内碱基通过氢键、范德华力和疏水堆积等作用力形成稳定的三维结构,能够与金属离子[13-14]、糖类[15]、小分子[16]、氨基酸[17]、抗生素[18]、多肽[19]、蛋白质[20]等靶标特异性结合。作为传感器的分子识别元件,核酸适配体具有亲和力高、易于实现信号放大、检测灵敏度高、特异性强等优点[21],成为环境检测[22]、医学诊断与治疗[23-24]、食品分析[25]等众多领域的重要分子工具,具有广阔的应用前景。
发展简捷快速的适配体筛选方法,丰富识别靶标分子的核酸适配体种类,将有效推动核酸适配体在POCT技术中的应用。如图1所示,人们主要以靶标物质为筛选对象,通过体外指数富集配体的系统进化技术(SELEX),从人工合成的寡核苷酸文库中筛选出特异性核酸适配体[26]。筛选对象可以是金属离子[27]、小分子[28]、蛋白质[29]、细菌[30]、病毒[31-32]、细胞[33]、组织或动物活体[34-35]。现有筛选过程普遍包含多轮正向筛选与负向筛选程序。通过聚合酶链反应(PCR)富集与靶标物质结合的核酸分子,并采用高通量测序获得适配体的碱基序列和相对丰度。由于核酸适配体亲和力受生理环境等因素的影响,在检测对象所处的生理环境中筛选到的核酸适配体具有更优越的适用性[36]。如基于细胞、组织或活体为对象开展的核酸适配体筛选,不仅可以发现更多潜在靶点,且筛选到的核酸适配体在生理环境中能够与靶标分子有效结合[37-38]。
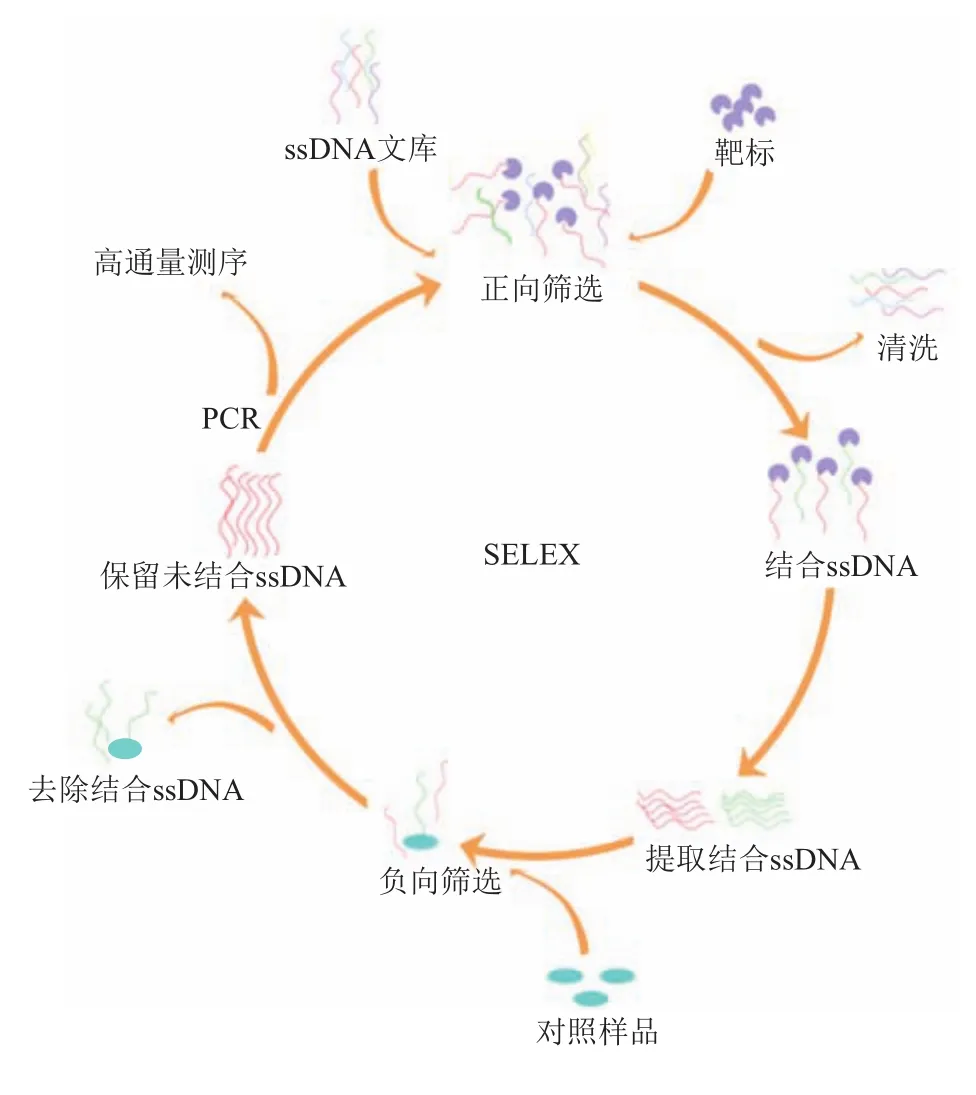
Fig.1 Schematic presentation of the typical procedure for aptamer selection图1 核酸适配体常规筛选流程示意图
近年来,为了克服SELEX筛选过程冗长、复杂等问题,研究人员开发了一系列筛选技术,如GO-SELEX[39]、Non-SELEX[40]、M-SELEX[41]和CE-SELEX[42]等用于提高SELEX筛选效率、增强适配体亲和力,以及简化筛选流程。最近,加拿大多伦多大学Shana O.Kelley院士团队[43]结合微流控芯片,开发了一种名为“Pro-SELEX”的新型筛选方法,用于定量分离具有特定亲和力的适配体。斯坦福大学Soh团队[44]发展了一种大规模并行筛选靶向响应分子开关核酸适配体的策略,解决了传感器应用过程中需要设计分子开关的难题。Stojanovic团队[45]提出了针对小分子不同官能团进行分别优化筛选的方案,为筛选靶向低分子质量靶点的核酸适配体提供了新的思路。此外,人工碱基的引入,能够有效扩展核酸适配体的结构多样性,提高核酸适配体亲和力和抗酶切能力[46]。然而,人工碱基核酸适配体存在合成难度大、扩增效率不高、测序难等问题。针对人工碱基核酸适配体的筛选方法还有待进一步优化[46]。近年来,在核酸适配体的筛选流程中,研究者利用计算机进行序列评估、结构分析和分子对接等方式,有效缩短了筛选流程,提高了筛选效率[47]。
2 核酸适配体POCT信号放大策略
检测速度快和灵敏度高是POCT传感器的核心需求。为了有效提高核酸适配体POCT传感器的检测速度和灵敏度,合理选择分子识别信号放大方法至关重要。现有核酸适配体POCT分子识别信号放大策略包括:a.基于核酸扩增与自组装;b.生物酶催化辅助;c.纳米材料辅助;d.CRISPR/Cas系统辅助。
2.1 核酸扩增与自组装信号放大策略
核酸扩增是一种通过增加核酸分子数量以提高检测灵敏度的有效方法。核酸适配体传感器中常用的核酸信号扩增技术包括:PCR[48]、环介导等温扩增(loop-mediated isothermal amplification,LAMP)[49]、重组酶聚合酶扩增(recombinase polymerase amplification,RPA)[50]、链置换扩增(strand displacement amplification,SDA)[51]和滚环扩增(rolling circle amplification,RCA)[52]。其中,PCR是一种常用的高特异性和高灵敏度酶催化变温扩增技术。然而,该反应需要借助热循环仪精确控制样品温度,从而循环完成DNA的变性、退火和延伸步骤,在POCT中的应用有限。LAMP、RPA、SDA与RCA为依赖酶催化的等温扩增技术,广泛用于核酸信号放大检测[53]。其中,RPA技术扩增速度最快,可以在10~30 min内完成DNA的扩增,非常适用于POCT的需求。如Du等[50]通过RPA,在侧向层析技术中使用核酸适配体检测红霉素,检测下限为3 pmol/L,检测时间仅需15 min。然而,该方法存在需要对引物进行特殊设计,易产生非特异性扩增产物等问题。RCA具有线性扩增与指数扩增两种形式,检测灵敏度高,需要提供环状模板。Zhou等[54]使用RCA对核酸适配体识别信号放大,开发了一种检测血小板衍生生长因子B链(PDGF-BB)的电化学传感器,检测限低至10 fmol/L。
上述扩增均需要生物酶的参与,虽然扩增效率高,但同时也提高了对检验试剂的保存要求。除此之外,还有非酶介导的信号放大方法,包括Toehold 介导的链置换反应(Toehold-mediated stand displacement reaction,TSDR)[55]、催化发夹自组装(catalytic hairpin assembly,CHA)[56]和杂交链反应(hybridization chain reaction,HCR)[57]。这类恒温核酸自组装信号放大技术,通过创建级联DNA放大器实现信号增强,在POCT传感器中得到了有效应用[53,58]。如He等[59]通过对指数放大CHA技术进行优化,有效提高了CHA检测灵敏度与特异性。相对酶催化反应扩增技术,自组装技术存在反应速率慢和背景信号高等问题,相关应用还有待进一步改进。部分研究者将自组装信号放大技术与酶催化核酸扩增进行了有效融合,如Chen等[60]将SDA与CHA放大技术联合使用,能够同时有效提高检测速度与灵敏度。
2.2 基于生物酶辅助信号放大策略
酶催化反应是一种简单、快速和高效的信号放大方法,在电化学传感平台、荧光PCR平台、酶联免疫吸附平台、比色法平台中都得到了广泛应用[61]。酶的种类可分为生物酶和纳米酶两大类。生物酶类具有易获取、催化活性高、催化反应种类多、特异性强等特点。其中,核酶与脱氧核酶可直接与核酸适配体序列相连接,使用较为简便,蛋白类酶中,HRP酶、核酸切割酶、蔗糖酶等催化反应底物易产生光学或电化学信号,使用最为广泛。辅助信号放大时,一般将生物酶偶联在核酸适配体或其互补序列末端,或装载在脂质体[62]、水凝胶[63]、金属框架[64]等纳米材料中。核酸适配体识别靶标后,能够介导激活生物酶的催化反应,产生光学或电化学检测信号。通过多种酶促反应的联合应用,可提高靶标信号的检测灵敏度。如Weng等[65]基于捕获核酸适配体的识别,通过Exo-III酶辅助信号放大,并利用转化酶进行信号转导,开发了一种基于个人血糖仪的致病菌检测方法。该技术在细菌病原菌检测和细菌感染早期诊断方面具有广阔的应用前景。然而,生物酶的分子结构不稳定,催化效率易受环境与温度的影响,是其在POCT中所面临的挑战。
2.3 基于纳米材料辅助信号放大策略
纳米材料如金属纳米颗粒[66]、石墨烯[67]、碳纳米管[68]、金属有机框架[69]等,具有优异的光电性能、较大的比表面积、易偶联适配体、优秀的装载能力和催化性能,在提高核酸适配体传感器灵敏度方面发挥了重要作用[70-73]。研究早期,人们将纳米材料作为电极增强或荧光猝灭材料,用于构建适配体电化学或荧光传感器[74]。如Hassani课题组[75]通过电沉积将金纳米颗粒修饰在电极表面,提高了电化学传感器的电子转移效率,实现了二嗪磷的高灵敏度检测。另外,部分纳米材料具有类似生物酶的催化活性和选择性,被称为纳米酶。纳米酶具有结构稳定、制备成本低、活性可调控、易与适配体分子偶联等优点,广泛用于电化学和比色传感器中[76-77]。然而,该材料也面临底物特异性有限、催化效率较弱等局限。目前,多个研究课题组将纳米材料作为标记材料,用于输出高分辨的电化学或光学响应信号。多种纳米材料相互协同可以有效增强输出信号、提高检测灵敏度。如Yan等[78]开发了基于二硫化钼纳米材料和二氧化硅纳米颗粒的信号放大适配体电化学传感器。该传感器实现了前列腺抗原与肌氨酸的高灵敏度检测,成功用于前列腺癌的精准诊断。基于纳米材料辅助的信号放大策略中,核酸适配体通常采用共价修饰等化学方法标记在纳米材料表面,但纳米材料或修饰基团形成的位阻效应会在一定程度上降低核酸适配体的亲和力[79]。为解决该问题,研究人员开发了多种非标记型纳米材料增强信号传感器[80]。
2.4 基于CRISPR/Cas系统的信号放大策略
CRISPR/Cas系统不仅在基因编辑领域取得了突破性进展,也为生物传感检测带来了新的发展方向[81]。早期基于CRISPR/Cas的核酸检测系统能够有效识别单拷贝单核苷酸突变,备受人们关注。基于此开发的传感器具有特异性高、灵敏度高、检测速度快、成本低等优势,十分适用于现场核酸靶标的快速检测[82]。核酸适配体的引入,使得CRISPR/Cas系统在小分子、蛋白质等非核酸分子检测体系内得到了有效发展。基于核酸适配体的CRISPR/Cas检测系统,主要通过核酸适配体识别靶标,诱导激活Cas蛋白切割DNA或RNA分子信标,实现信号放大,提高检测灵敏度[83-84]。如陆艺团队[85]基于核酸适配体与CRISPR/Cas12a系统开发了快速检测ATP与Na+的POCT传感器。目前,CRISPR/Cas信号放大系统存在易受样本环境影响、脱靶效应产生非特异性切割,以及复杂的序列设计等问题。今后,伴随CRISPR/Cas系统特异性的不断提高,该技术与核酸适配体的结合将在POCT领域内取得更多应用成果。
3 基于适配体的POCT传感器
近年来,研究者们开发了多种基于适配体的POCT传感器,成功用于病毒、细菌与疾病标志物的快速检测。根据检测信号类型,这些传感器可分为电化学传感器和光学传感器两大类。
3.1 核酸适配体电化学传感器
电化学传感是一种利用电极与待测样品之间的电化学反应,通过测量电流、电位或电荷转移等电化学信号,对待测样本中目标分析物实现定量或定性分析。电化学传感具有检测灵敏度高、特异性好、响应速度快、装置易微型化等优点。目前,电化学传感器在金属离子、小分子、蛋白质、细胞、细菌、病毒等物质快速检测领域获得了广泛应用。电化学传感器中,敏感元件与目标分子之间的特异性识别作用是完成检测的重要环节。常用识别元件有抗体、多肽、酶、核酸适配体等生化分子。相较于其他识别元件,核酸适配体更容易修饰在电极表面。常用修饰方法有:直接吸附法、自组装膜法、共价修饰法、化学交联法,以及生物素/亲和素分子法等[86]。实际应用过程中需要结合检测灵敏度、选择性和操作便捷性等因素,选择合适的修饰方法。此外,现有研究表明,受空间位阻效应和核酸适配体取向性的影响,直接修饰在电极表面上的核酸适配体靶向捕获效率会有所降低[87]。基于此,谭蔚泓课题组[88]开发了DNA四面体辅助修饰方法。该方法能有效增强适配体取向性和稳定性,提高靶标分子捕获效率,实现了外泌体的高灵敏度检测。
核酸适配体本身不具备明显的电化学信号,通常需要在核酸适配体末端修饰电活性标签,如二茂铁、铁氰化物、亚甲基蓝、CdS纳米颗粒等。与抗体不同,研究者可基于核酸适配体构象变化实现生物分子特异性识别信号的转化[89]。根据该检测原理,核酸适配体电化学传感器分为“signal off”和“signal on”两大类。为了提高检测灵敏度与稳定性,研究人员开发了多种比例型核酸适配体电化学传感器。该传感器能有效减少实验操作与样本环境带来的干扰,具有出色的灵敏度和良好的重复性。如李峰团队[90]基于DNA四面体的超支化杂交链反应,构建了双核酸适配体识别介导的比率型电化学传感器,实现了复杂生物样本中肿瘤外泌体的精准定量分析。
便携式血糖仪是目前最成功的POCT电化学传感设备之一,具有成本低、操作简单和便携性好等优点。早期便携式血糖仪只能对体液内单一的葡萄糖进行检测,其应用范围有限。2011年,陆艺等[91]基于核酸适配体与便携式血糖仪,实现了对可卡因、腺苷、γ干扰素,以及铀离子POCT。后续多个课题组通过核酸适配体识别元件捕获靶标,利用酶偶联催化分解产生葡萄糖(图2a),或调控纳米材料释放葡萄糖(图2b),确立分析物浓度与产生葡萄糖的浓度之间的关系,对分析物进行定量分析[92-93]。
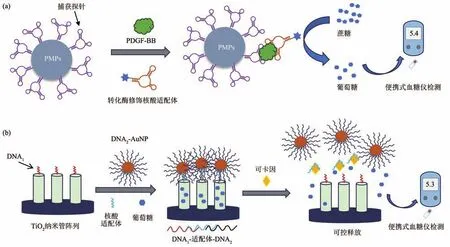
Fig.2 Aptamer-based POCT sensor with personal glucose meter readout图2 基于核酸适配体的便携式血糖仪POCT传感器
近年来,基于场效应晶体管和微流控芯片构建的电化学连续检测技术,成为了国内外可穿戴传感检测研究前沿领域。该检测技术可实时监测人体内疾病标志物、代谢分子、药物分子、神经递质等物质含量,对于药物研发、发病机制研究、疾病精准诊断和个性化治疗具有重要意义[94]。核酸适配体具有优异的靶向性,与靶标分子结合产生的构象变化是可逆的,十分适用于长时的连续监测。2013年,美国Soh教授课题组和Plaxco教授课题组[95]将靶向阿霉素或卡那霉素的核酸适配体修饰在微流控芯片内的金电极表面,通过监测核酸适配体构象变化引发的电信号变化,实现了动物体内循环药物浓度的长时监控。然而,该传感器需要提供复杂的层流液体用于减少大分子对核酸适配体的干扰。近年来,为提高核酸适配体在电极表面的稳定性和改善电极的生物相容性,毛兰群团队[96]构建了一种核酸适配体修饰碳纤维微电极,有效用于神经递质的在体连续监测。场效应晶体管传感器具有优异的电化学性能,能够有效提高检测灵敏度高。研究者开发了多种核酸适配体功能化场效应晶体管传感器用于电化学连续检测[97-98]。如Andrews团队[99]构建了一种可植入式核酸适配体场效应晶体管传感器,用于脑内血清素的POCT,检测灵敏度较普通电化学传感器降低了3~6个数量级。目前,在该检测研究领域,提高核酸适配体探针的稳定性和抗干扰能力仍然是其所面临的重要挑战。
3.2 核酸适配体光学传感器
光学传感是一种非接触式无损检测方法,具有仪器操作简便、易于微型化、检测速度快和灵敏度高等特点。检测原理主要是通过将待检物质与光学信号相关联,实现对目标分子的定性与定量分析。常见的光学检测信号包括光的散射、光的反射、光的吸收和光的发射等。常用检测方法有:比色法、荧光法、表面增强拉曼光谱法(SERS)、表面等离子共振法(SPR)和倏逝波光纤生物传感等(图3)。表1为常用光学检测方法的特征及其优缺点汇总。

Table 1 Aptamer-based optical POCT assays: characteristics,advantages,and disadvantages表1 基于核酸适配体的光学POCT检测方法特征及优缺点

Fig.3 Aptamer-based optical POCT assays图3 基于核酸适配体的光学传感POCT策略
3.2.1 比色法
比色法是一种不依赖激发光源的光学传感方法。该方法基于靶标与识别元件结合后,生成产物对光产生选择性吸收,进而导致样品发生颜色变化。人们通过肉眼或简单仪器即可确定待测成分与含量。核酸适配体比色法中,通常在核酸适配体或其互补序列末端修饰显色底物(如金属纳米颗粒、酶等)可完成信号的输出。Liu等[105]最先报道了构建核酸适配体-金纳米比色体系用于腺苷的检测,利用了金纳米团聚引发溶液颜色变化的原理。Wu等[110]开发了基于滚环扩增的液晶比色适配体传感器,有效提高了比色法适配体传感器的检测灵敏度。另外,为减少化学修饰对核酸适配体靶向性能的影响,研究者开发了多种非标记技术。如谭蔚泓课题组[100]设计了一种简单的外泌体表面蛋白非标记比色分析法。研究者通过构建核酸适配体-金纳米-盐比色体系,实现了外泌体表面蛋白的可视化和定量分析(图3a)。目前,受限于样品自身和检测环境颜色干扰的影响,提高核酸适配体比色法传感器的抗干扰能力和实现多靶标分析是重点研究方向。
3.2.2 侧向层析法
侧向层析技术是一种简单、快速(10~20 min)、低成本、不依赖大型仪器的检测方法。非专业人员也可自行操作呈现检测结果。相较于基于抗原-抗体作用的侧向免疫层析技术,核酸适配体侧向层析技术具有检测成本低、不受批次影响、检测对象广等特点。该技术在POCT领域具有良好的应用场景[108]。该检测器构建方案可分为夹心法和竞争法两种类型。其中竞争法对序列设计的要求较高,夹心法可实现多通道检测[93]。由于检测灵敏度低,传统侧向层析检测方法难以实现定量检测。研究者通过结合核酸信号放大技术,以及采用纳米荧光颗粒取代纳米金属颗粒,有效提高检测灵敏度。人们利用便携式检测设备可实现定量检测。如Jin等[101]使用上转换荧光纳米颗粒作为信号标记,有效提高了检测灵敏度。该传感器后续通过手机完成信号检测,实现了在一片试纸条上同时检测3种不同物质的目标,从而体现了核酸适配体用于多物质同时检测的优势(图3b)。目前,市面上还没有成熟的核酸适配体侧向层析检测产品。主要挑战在于该检测结果易受样本环境影响(如核酸酶),存在检测结果重复性差等问题。
3.2.3 荧光检测法
光学传感检测器中荧光检测法的检测灵敏度高,可实现多种靶标分子的检测,能在微型化装置内完成检测,是一种使用广泛的POCT方法。由于核酸适配体具备易实现信号放大等特征,在荧光POCT传感器中备受青睐。核酸适配体自身不产生荧光,需要在检测体系中加入荧光分子。根据核酸适配体是否修饰固定,传感器分为标记型与非标记型两大类别。在标记型荧光核酸适配体传感器中,常见策略是在核酸适配体末端修饰荧光-猝灭基团或荧光共振能量分子对,从而组成分子信标。该方案原理是基于核酸适配体构象变化所导致的“荧光信号开启”或“荧光信号关闭”响应[107]。谭蔚泓课题组[111]最先提出并使用该策略,实现了对乳酸脱氢酶的快速检测。该方案检测信噪比高,但检测灵敏度受到荧光基团分子间距大小的限制。另外,荧光基团标记过程较为繁琐,修饰基团可能降低核酸适配体的靶向性能。因此,研究者试图开发更简便的非标记型方案。早期,人们主要是采用溴化乙锭(ethidium bromide,EB)[112]、钌配合物[113]等DNA嵌入染料作为信号分子。核酸适配体结合靶标分子后,导致DNA嵌入染料信号分子荧光强度发生变化。近年来,研究者利用氧化石墨烯等纳米材料猝灭荧光原理,开发出多种高灵敏度非标记型荧光核酸适配体POCT传感器[102](图3c)。另外,受荧光蛋白的启发,研究者合成和筛选到了一系列能够与荧光染料特异性结合并激活染料荧光的荧光适配体[114]。
3.2.4 表面增强拉曼光谱法(SERS)
表面增强拉曼技术具有检测速度快、选择性高、指纹谱检测、低光漂白和宽激发等特点,近年来获得了研究者的广泛关注[108]。其中,基于核酸适配体的表面增强拉曼检测原理主要有两种。a.基于核酸适配体自身构象变化产生拉曼信号,如Campbell等[115]通过该原理开发了人血红蛋白的检测传感器。Negri等[116]采用该原理开发出检测流感病毒核蛋白的传感器。这种策略操作简单,无需复杂化学反应。但该策略检测灵敏度较低,核酸适配体自身构象易受修饰方法和环境因素的影响,不适用于复杂生物样本中靶标的定量分析。通过筛选获取高亲和力核酸适配体,改善基底材料可有效提高检测灵敏度。Park等[103]筛选到了靶向病毒S蛋白的高亲和力核酸适配体(Kd值小于2 nmol/L),在银纳米森林基底上检测S蛋白的灵敏度为100 pg/L(图3d)。b.核酸适配体修饰探针产生拉曼信号,常见标记分子有亮甲酚蓝、甲基青莲、亚甲基蓝等。通过标记信号分子,能够有效增强检测灵敏度,减少背景信号的干扰。通过多标记策略,可实现多靶标物质同时检测[117]。近年来,卷积神经网络等深度学习模型用于SERS指纹图谱的分析,有效推动了SERS技术在POCT中的应用范围[118-120]。
3.2.5 表面等离子体共振法(SPR)
SPR传感器是一种基于表面等离子共振效应的光学传感器,是一种无需标记、灵敏度高、实时响应、选择性高、多路复用的新型光学检测方法。基于SPR的适配体传感器中,适配体通常修饰在在金层表面。当靶标分子结合核酸适配体后,表面等离子共振角度发生改变。通过监测光的折射率变化,实现目标物质的定性或定量分析。传统商业化SPR传感器体积较大,不适于POCT。研究者基于光纤或微流控芯片构建了可便携式SPR传感器,并且将样品消耗减少至数微升或亚微升,实现了标志物POCT[121-122]。Kim等[104]报道了一种新型的基于双核酸适配体夹心平台。该方案中,金纳米棒修饰核酸适配体探针,有效增强了SPR检测灵敏度,实现了诺如病毒衣壳蛋白的高灵敏度检测(图3e)。新型冠状病毒感染(COVID-19)疫情后期,Lewis等[123]开发了能够特异性检测严重急性呼吸综合征冠状病毒2(SARS-CoV-2)表面SP1刺突蛋白的SPR适配体传感器,不仅能够用于病毒POCT,而且提供了核酸适配体与SP1刺突蛋白的亲和力常数,对于优化POCT产品具有重要意义。目前,由于SPR器件加工成本高,样品需要前处理,重复使用性差等问题的影响,SPR适配体传感器在POCT领域中的应用还未得到有效开展。
3.2.6 倏逝波光纤生物传感
倏逝波光纤生物传感器(evanescent wave fiber optic biosensor)是一种基于光纤传感技术的生物传感器。激光在纤芯与包层间进行全内反射式传输时,产生倏逝场激发光纤表面探针的荧光基团,从而实现目标物的定性与定量分析(图3f)。该传感器具有检测速度快、灵敏度高、可连续监测、易便携等优点。核酸适配体分子作为生物识别元件,主要通过物理吸附、共价偶联、生物素/亲和素法修饰在光纤表面。如何提高核酸适配体稳定性,实现高通量和连续性检测是该传感器所面临的重要挑战[109]。娄新徽团队[124-125]开发了一种纳米亲和双层(NADL)多功能传感界面,有效提高了光纤表面核酸适配体抗干扰能力,实现了该类传感器对小分子靶标和蛋白质靶标的高灵敏度与特异性检测。
4 总结与展望
综上所述,核酸适配体作为分子识别元件,具有识别对象广、易获取、易实现信号放大、适用于多种生物传感器的特点,在POCT中具有独特的优势。然而,基于核酸适配体的POCT在技术研究领域与产品商业化方面还面临着诸多挑战。
在基础研究领域,核酸适配体POCT技术面临着核酸适配体筛选程序复杂、分子识别机制理解不完善、传感器检测灵敏度有限、检测结果不稳定等挑战。针对上述问题,一方面,研究者需要加强核酸适配体识别分子机制的基础研究,完善核酸适配体三级结构解析技术,结合机器学习训练模型发展人工智能筛选核酸适配体新方法,另一方面,将核酸适配体与微流控芯片、穿戴式设备等新型集成化传感器更高效地融合,将有效提高传感器检测灵敏度和稳定性[79,126-127]。如将核酸适配体探针与基于微流控液滴技术开发的数字扩增技术有效融合,实现单分子检测与绝对定量分析。在可穿戴式柔性传感器研究中,将核酸适配体与柔性电极材料有效融合、通过AI数据分析处理多种核酸适配体探针信号,为患者提供个性化疾病诊断与治疗方案。
在产品商业化领域,一些检测速度快,但操作复杂、检测仪器不易便携化的POCT技术无法转化为POCT产品。因为POCT产品需要在患者身旁即可获得临床诊断结果,不受操作人员培训水平和检验场所限制。目前,基于核酸适配体的相关POCT产品主要有荧光或比色法的检测试剂盒以及胶体金试纸条。如Aptagen公司开发的于荧光法检测产品,Aptamer Group公司开发的SARS-CoV-2检测试纸条,以及Achiko公司开发的SARS-CoV-2检测试剂盒。但上述相关产品在POCT市场上还未能获得广泛认可,主要原因在于:一方面,核酸适配体靶向的分子靶标种类较少,筛选周期较长,能够开发形成稳定产品的种类较为缺乏;另一方面,核酸适配体POCT产业基础薄弱,而抗体相关POCT产品研发、生产工艺、产业链条等条件发展成熟,产品更新速度快。核酸适配体POCT产品需要具有独特的性能,才能够取代抗体POCT产品。目前,在小分子检测与多通道检测领域,核酸适配体具备一定的竞争力,期待相关产品能够获得突破。