喂食二氢杨梅素对高脂日粮小鼠生长代谢及发情周期的影响
2023-10-09谢梅英侯连杰
谢梅英 侯连杰

摘 要 在动物生产中,脂肪沉积会影响母猪繁殖性能,如降低发情率、受胎率和仔猪出生成活率等。二氢杨梅素是一种绿色安全二氢黄酮醇类黄酮植物提取物,对饲养动物具有抗氧化、抗炎、降血糖及调血脂等多方面的作用,但是否能够缓解高脂日粮导致的动物发情周期紊乱尚不清楚。通过给每天给高脂饮食小鼠灌喂200 mg·kg-1体重的二氢杨梅素溶液,观察二氢杨梅素对小鼠体重、体组成、直肠温度、代谢产热和发情周期的影响。结果表明:1)二氢杨梅素显著抑制高脂日粮诱导的小鼠体增重和体脂含量增加及脂肪细胞脂质蓄积;2)二氢杨梅素可缓解高脂日粮导致的小鼠发情周期紊乱,缩短肥胖小鼠发情间期、延长发情期,并升高血清中促卵泡激素和雌二醇水平;3)二氢杨梅素通过逆转高脂日粮对小鼠棕色脂肪产热基因和白色脂肪棕色化相关基因表达的抑制作用,提高肥胖小鼠代谢产热。
关键词 小鼠;喂食;二氢杨梅素;发情周期;肥胖;能量代谢;脂肪组织
中图分类号:S814 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2023.13.001
在动物生产中,脂肪沉积会影响母猪繁殖性能,如降低发情率、受胎率和仔猪出生成活率等[1]。此外,肥胖会引起饲养动物内分泌及代谢异常,如代谢率降低、高胰岛素血癥和孕酮产生过剩[2],伴随着发情周期紊乱[3]、多囊卵巢综合征[4]和不孕症[5]等。因此,预防肥胖可以提高畜禽繁殖性能,降低生殖疾病发病率,改善动物繁殖性能。
二氢杨梅素又称蛇葡萄素、白蔹素、双氢杨梅树皮素、双氢杨梅素等,是一种绿色安全二氢黄酮醇类黄酮植物提取物[6]。其广泛存在于蛇葡萄科蛇葡萄属植物中,在藤茶中含量可以达到30%,也存在于杨梅科、杜鹃科、藤黄科等植物中[7]。既往研究证实,二氢杨梅素通过激活AMPK、NRF2和NF-κB等通路发挥抗氧化[8]、抗炎[9]、降血糖及调血脂等多方面的作用[10-11]。然而,二氢杨梅素是否能够缓解高脂日粮导致的动物发情周期紊乱尚不清楚。本试验旨在探究二氢杨梅素对高脂日粮导致的小鼠发情周期紊乱的影响,研究结果有望揭示二氢杨梅素在改善肥胖相关生殖异常方面的调控作用,为其在改善动物繁殖性能和人类健康中的应用提供试验依据。
1 材料与方法
1.1 试验动物和试验设计
36只6周龄C57B/L6雌性小鼠(广东省医学实验动物中心),在22~28 ℃、60%~80%湿度的条件下,12 h的光/暗循环,适应1周后,将小鼠随机分为3组(n=12):正常日粮组、高脂日粮饮食组和“高脂日粮饮食+二氢杨梅素”组。正常日粮饲喂标准啮齿动物饲料(AIN-93G),高脂日粮饮食组饲喂高脂日粮(脂肪提供60%能量),高脂日粮饮食+二氢杨梅素组饲喂高脂日粮(脂肪提供60%能量)并灌喂200 mg·kg-1体重的二氢杨梅素溶液,正常日粮和高脂日粮饮食组每天灌喂等体积的PBS。试验期18周,在不同饲养阶段,对小鼠体组成、直肠(体核)温度和发情周期等进行检查。试验结束后,用CO2麻醉小鼠,眼球取血分离血清,用ELISA试剂盒检测雌二醇(estradiol,E2),促卵泡生成素(follicle-stimulating hormone,FSH)水平。
1.2 材料和试剂
二氢杨梅素购买自MCE公司(HY-N0112)。FSH和E2检测试剂盒购自南京建成生物工程研究所。
1.3 体组成检测
从12周龄开始每周一上午9:00用动物体成分和核磁共振成像系统分析仪(Body Composition Analyzer MiniQMR23-060H-I, Niumag Corporation, Shanghai, China)测定小鼠的体脂含量和脂肪分布。
1.4 整体代谢
按照综合实验动物监测系统(Promethion metabolic screening systems,美国Systems International公司)操作指南,测定20周龄小鼠的产热和耗氧量等代谢参数。
1.5 组织RNA提取和实时荧光定量PCR检测基因表达
按照广州美基生物科技公司RNA快速提取试剂盒操作说明提取腹股沟白色脂肪和肩胛间褐色脂肪RNA。按照TaKaRa公司逆转录试剂盒操作说明将组织总RNA逆转录为cDNA用于后续定量PCR实验。实时荧光定量PCR实验操作在本团队前期发表研究中均有报道,相关基因引物序列见表1。
1.6 Western Blot检测基因的蛋白含量
使用RIPA裂解液裂解脂肪组织,12 000 r·s-1离心10 min获得组织蛋白溶液,使用BCA法测定蛋白浓度。蛋白变性后利用Western Blot检测基因的蛋白含量,Western Blot实验方法参照本团队前期发表研究。
1.7 直肠温度测定
从8周龄开始每天用小鼠用直肠探头连接数字温度计测量小鼠的直肠温度。
1.8 发情周期鉴定
对20周龄雌性小鼠连续8天进行阴道涂片的细胞学检查,每天观察1次阴道涂片细胞类型,确定发情周期所处阶段。固定小鼠,用移液枪吸取20 μL PBS至小鼠阴道,反复抽吸5次,将液体均匀涂至整个载玻片,涂片风干后,甲醇固定3 min,瑞氏染液染色6 min,PBS轻柔冲洗,吉姆萨染液染色8 min,最后用自来水漂洗,自然干燥后封皮检测。各阶段的分辨方法如下:发情间期黄体退化,可见大量白细胞及少量黏膜和上皮细胞;发情期卵泡成熟排卵,为无核角化细胞包含少量上皮细胞;发情前期卵泡快速生长,可见大量有核上皮细胞和少量角化细胞;发情后期黄体生成,为一半上皮细胞和一半白细胞。
1.9 苏木精&伊红(H&E)染色
分离内脏脂肪,用4%多聚甲醇固定48 h,脱水后用石蜡包埋切片,用苏木精和伊红染色并拍照。
1.10 统计分析
所有数据均以“平均值±标准误”表示。使用SPSS 22.0软件进行统计分析。采用单因素方差分析对各组均值进行差异分析,p<0.05为有统计学意义。
2 结果与分析
2.1 二氢杨梅素对高脂日粮诱导的小鼠脂肪沉积的影响
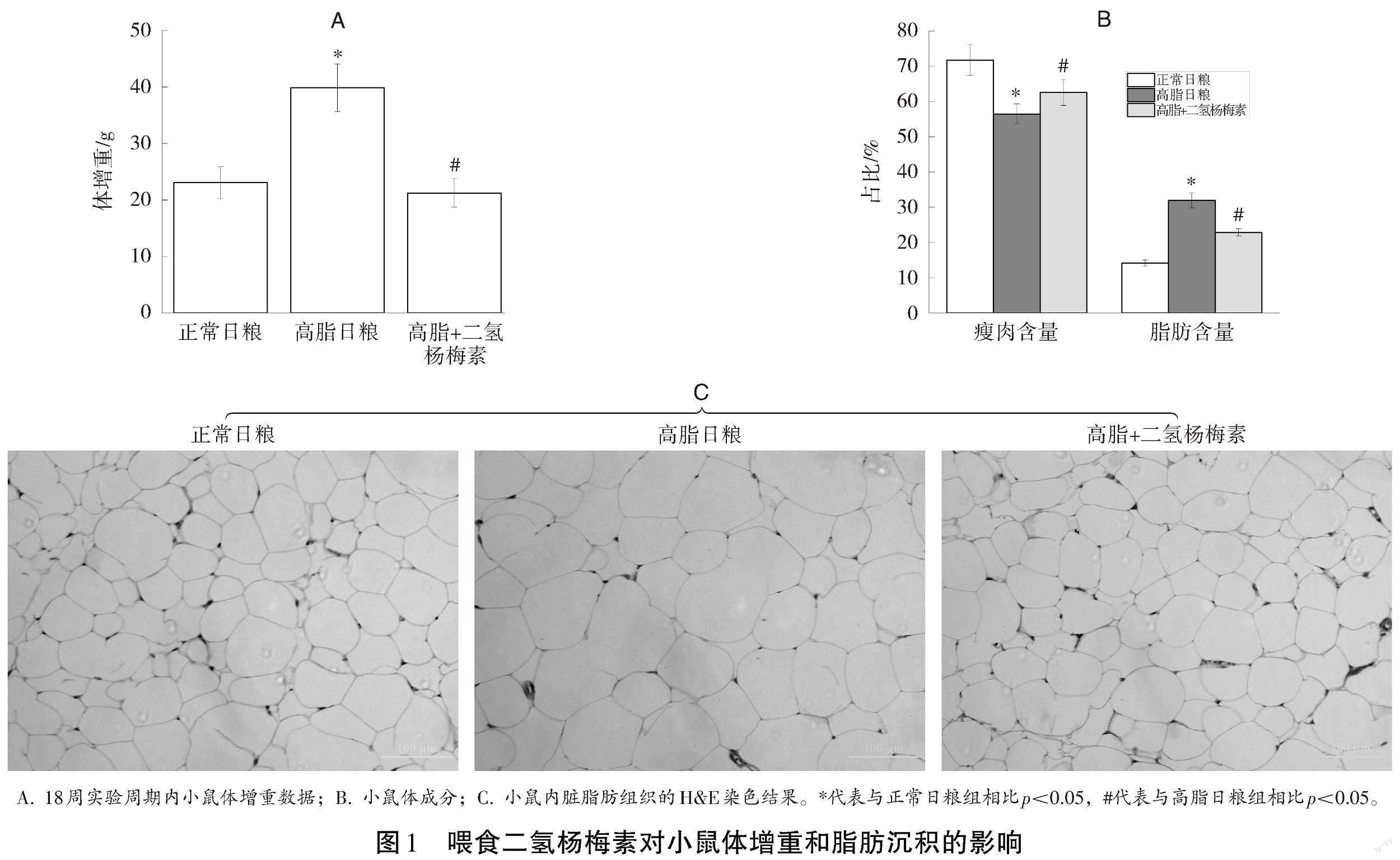
与正常日粮相比,18周的高脂日粮饲喂显著增加小鼠体增重和小鼠脂肪含量,喂食二氢杨梅素可显著逆转高脂日粮诱导的体增重和脂肪含量的增加(见图1A、1B)。与此同时,内脏脂肪的H&E染色结果表明:与正常日粮相比,高脂日粮饲喂显著增加小鼠的内脏脂肪细胞脂质蓄积,二氢杨梅素显著逆转了高脂日粮诱导的内脏脂肪细胞脂质累积(见图1C)。
2.2 二氢杨梅素对高脂日粮导致的雌性小鼠发情周期紊乱的影响
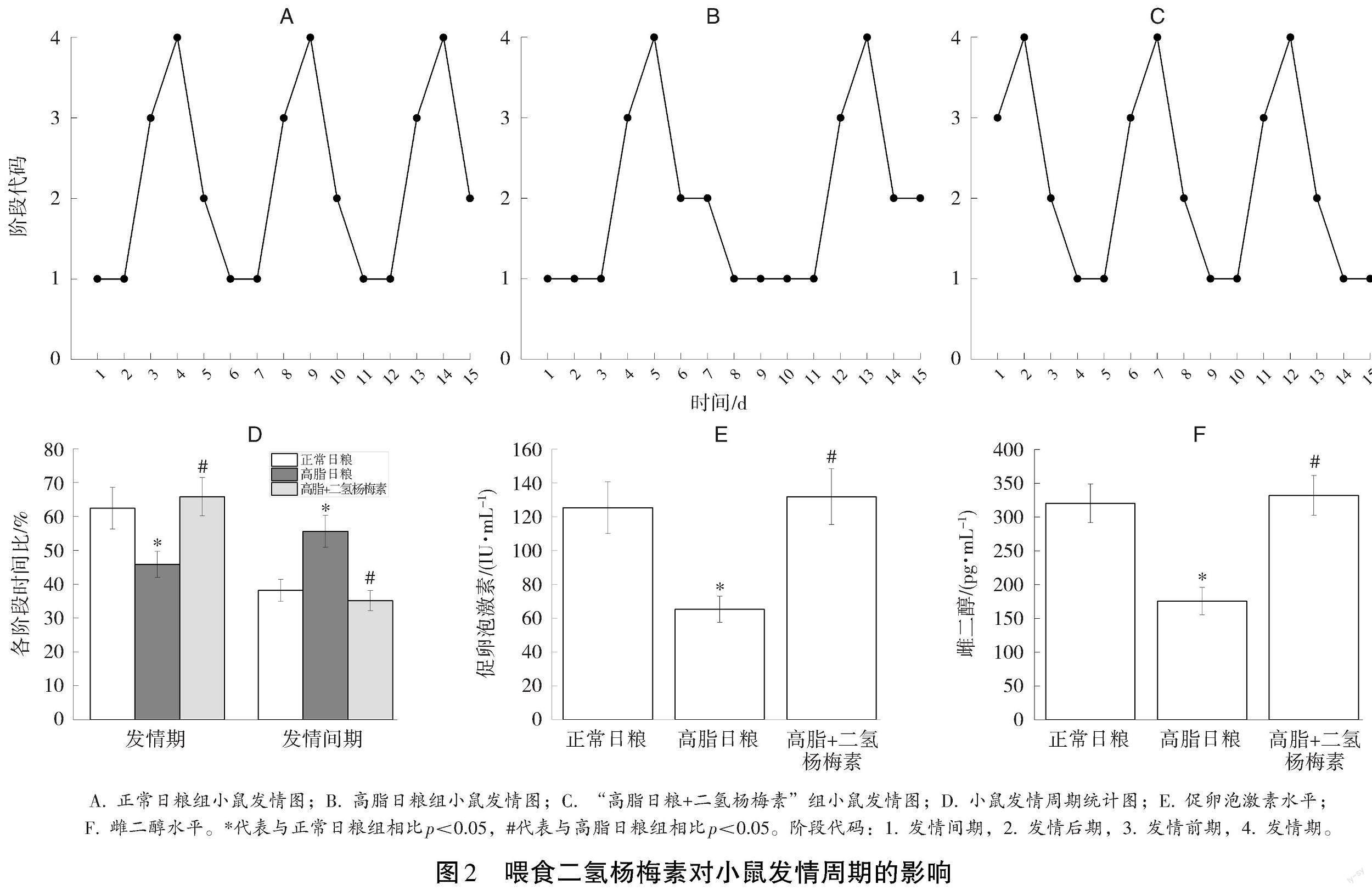
与正常日粮相比,高脂日粮诱导肥胖小鼠发情周期显著增长(见图2A、2B),而且降低发情期的时间比例,增加发情间期的时间比例(见图2D);而喂食二氢杨梅素将小鼠发情周期恢复到正常天数(见图2B、2C),并且逆转高脂日粮导致的发情期缩短和发情间期延长(见图2D)。雌二醇和促卵泡激素的ELISA检测结果表明:肥胖小鼠体内雌二醇和促卵泡激素水平显著降低,二氢杨梅素能够改善高脂日粮对血清雌二醇和促卵泡激素水平的抑制作用(见图2E、2F)。上述结果表明,二氢杨梅素可以改善高脂日粮导致的雌性小鼠发情周期紊乱。
2.3 二氢杨梅素对肥胖雌性小鼠能量代谢的影响
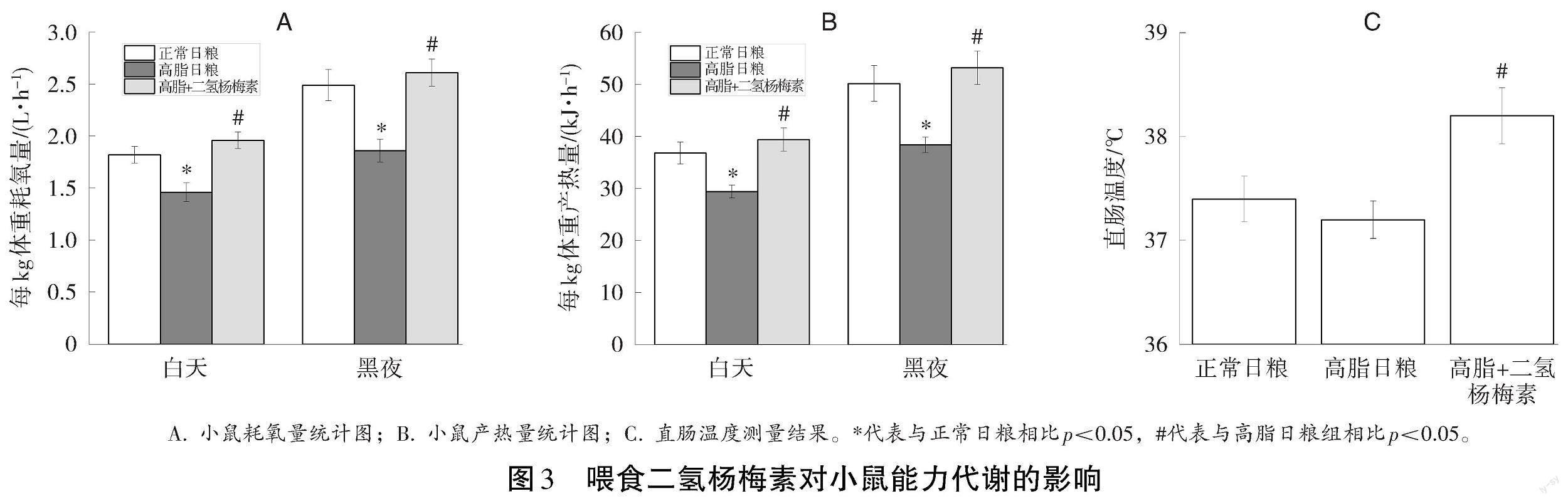
为探究二氢杨梅素缓解高脂日粮导致的发情周期紊乱是否与提高机体基础能力代谢有关,本研究测定了喂食二氢杨梅素对肥胖小鼠的基础代谢的影响。结果显示,高脂日粮降低小鼠的耗氧量和产热量,而二氢杨梅素逆转了高脂日粮引起的耗氧量和产热量的降低(见图3A、3B)。同时,二氢杨梅素使小鼠的直肠温度显著升高,与能量代谢增加的表型一致,表明二氢杨梅素提升肥胖雌性小鼠的能量代谢。
2.4 二氢杨梅素对肥胖小鼠的棕色脂肪激活和白色脂肪棕色化相关基因表达的影响
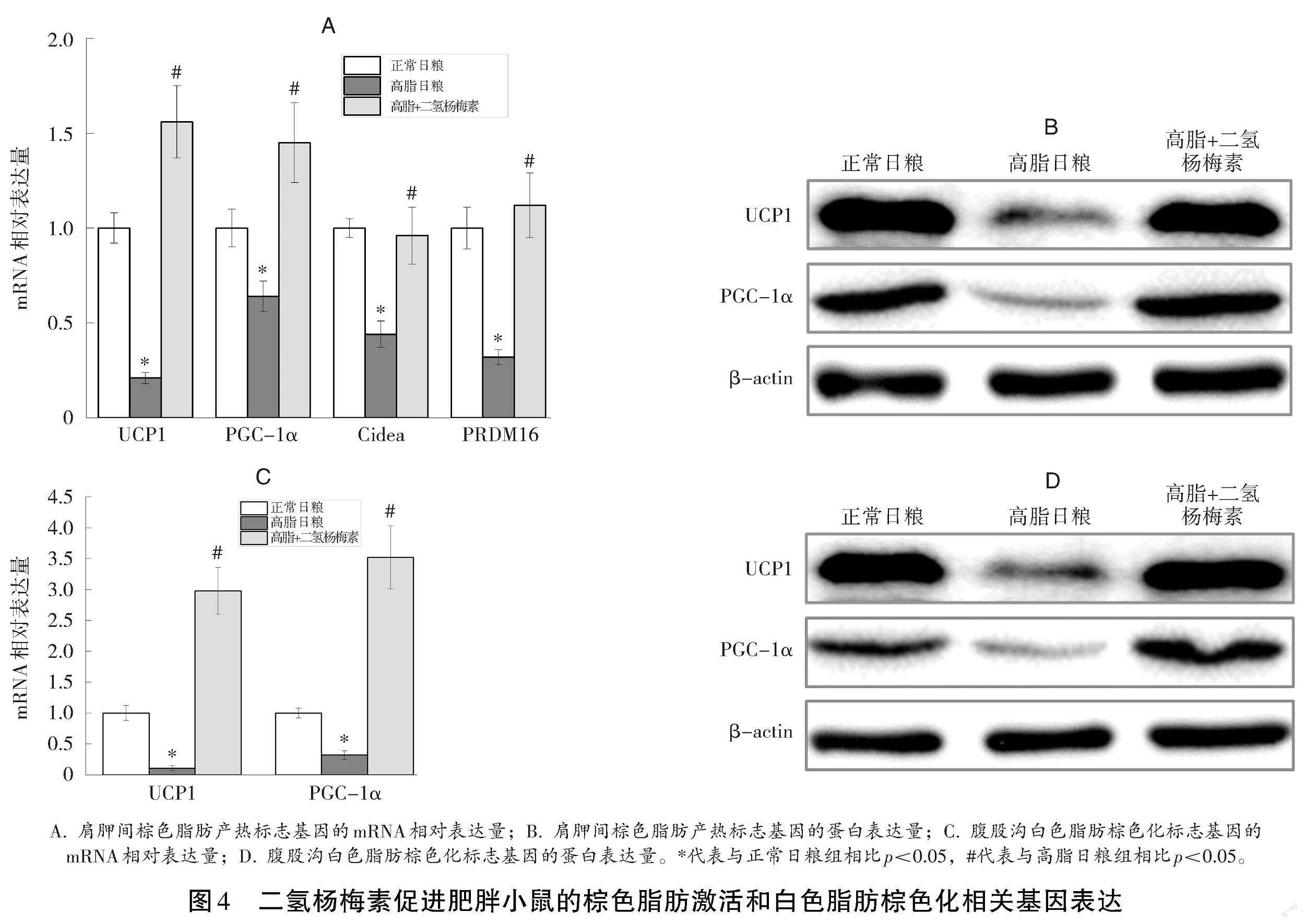
由于棕色脂肪激活和白色脂肪棕色化与增加小鼠产热密切相关,因此本试验探究了二氢杨梅素对棕色脂肪激活和白色脂肪棕色化的影響。定量PCR结果(见图4)表明:高脂日粮抑制棕色脂肪激活相关基因UCP1、PGC-1α、Cidea和PRDM16的表达,二氢杨梅素逆转高脂日粮对棕色脂肪激活相关基因的抑制作用;WB结果与qPCR结果一致。此外,定量PCR结果表明:高脂日粮抑制腹股沟白色脂肪棕色化转变相关基因UCP1和PGC-1α mRNA水平,二氢杨梅素显著逆转高脂日粮对腹股沟白色脂肪棕色化转变相关基因的抑制作用,且WB结果与定量PCR结果一致。上述结果表明,二氢杨梅素促进肥胖小鼠的棕色脂肪激活和白色脂肪棕色化相关基因表达。
3 讨论与结论
3.1 讨论
已有研究表明,肥胖或高脂日粮会损害包括发情周期紊乱在内的雌性动物繁殖性能[12]。本研究同样发现高脂日粮导致雌性小鼠发情周期紊乱。本研究结果显示:小鼠灌服二氢杨梅素可以缓解高脂日粮导致的肥胖小鼠发情周期紊乱。
雌性动物发情周期是其繁殖过程的重要组成部分,受生殖激素的严密调控,不规律的发情周期往往伴随着促卵泡激素和雌二醇等生殖激素水平的紊乱[13]。有研究报道,肥胖女性血清促卵泡激素和雌激素浓度较低;在啮齿类动物中,卵巢切除术导致肥胖发生,而补充雌激素可抑制肥胖的发生[2]。有趣的是,雌激素可抑制动物的采食行为,而较低雌激素水平将诱导动物采食,进一步诱导肥胖[14]。有研究表明,雌性的发情行为与体脂含量密切相关;机体能量平衡和发情周期受到下丘脑神经元的严格调控,高脂日粮可以稳定地提高哺乳动物雌二醇水平,雌二醇抑制促性腺激素促黄体生成激素分泌,导致动物发情表现差[15]。另有研究表明,当高脂日粮引起大鼠肥胖时(体重增加27%),可导致98%的大鼠发情中断[16]。本研究中发现二氢杨梅素处理后,可显著升高小鼠雌激素水平,并恢复小鼠正常的发情周期。在本研究中发现高脂日粮诱导肥胖的小鼠体内促卵泡激素和雌激素水平显著降低,二氢杨梅素改善肥胖对促卵泡激素和雌激素分泌的抑制作用,提示二氢杨梅素可预防高脂日粮导致的肥胖雌性小鼠生殖激素水平的改变。
本研究还进一步解析了二氢杨梅素缓解肥胖引起的发情周期紊乱的机制。鉴于肥胖往往伴随着能量平衡的变化,本研究通过检测小鼠机体代谢产热结果发现:二氢杨梅素增加了高脂日粮诱导肥胖小鼠的基础耗氧量和产热量。由于哺乳动物的基础产热量的增加主要通过棕色脂肪和棕色化的白色脂肪中解偶联呼吸作用实现[17],因此,本研究检测了小鼠棕色脂肪和白色脂肪中解偶联蛋白UCP1的表达变化,结果发现高脂日粮抑制UCP1在棕色脂肪和白色脂肪中的表达,但二氢杨梅素显著增加UCP1的表达。本研究团队前期证明二氢杨梅素能够激活PGC-1α信号通路抑制肥胖小鼠脂肪组织炎症反应,改善小鼠胰岛素敏感性[18];而PGC-1α是棕色脂肪激活和白色脂肪棕色化过程中重要转录因子,可促进UCP1的表达[19]。本研究也表明:二氢杨梅素可显著增加棕色脂肪和白色脂肪组织PGC-1α的表达,提示二氢杨梅素通过激活PGC-1α/UCP1信号通路,促进脂肪组织的解偶联呼吸作用,增加小鼠代谢产热,从而改善肥胖引起的发情周期紊乱。
3.2 结论
喂食二氢杨梅素可缓解高脂日粮诱导肥胖所导致的小鼠发情周期紊乱和代谢产热降低,其可能与棕色脂肪激活和白色脂肪棕色化产热相关。本研究揭示了二氢杨梅素在改善动物肥胖相关的生殖异常方面的潜在应用,可为其在人类生殖疾病治疗和动物繁殖性能改善中的应用提供一定的试验依据。
參考文献:
[1] HAUSMAN G J, BARB C R. Adipose tissue and the reproductive axis: biological aspects[J]. Endocr Dev, 2010, 19:31-44.
[2] LEENERS B, GEARY N, TOBLER P N, et al. Ovarian hormones and obesity[J]. Hum Reprod Update, 2017, 23(3):300-321.
[3] ITRIYEVA K. The effects of obesity on the menstrual cycle[J]. Curr Probl Pediatr Adolesc Health Care, 2022:101241.
[4] LORD J M, NORMAN R. Obesity, polycystic ovary syndrome, infertility treatment: lifestyle modification is paramount[J]. BMJ, 2006, 332(7541):609.
[5] CARSON S A, KALLEN A N. Diagnosis and Management of Infertility: A Review[J]. JAMA, 2021, 326(1):65-76.
[6] DU Q Z, CAI WJ, XIA M, et al. Purification of(+)-dihydromyricetin from leaves extract of Ampelopsis grossedentata using high-speed countercurrent chromatograph with scale-up triple columns[J].J Chromatogr A, 2002, 973(1/2):217-220.
[7] LEE K H, KIM J H. Development and optimization of fractional precipitation for the pre-purification of (+)-dihydromyricetin[J]. Biotechnol Bioproc E, 2008, 13(3):274-278.
[8] LIU T T, ZENG Y, TANG K, et al. Dihydromyricetin ameliorates atherosclerosis in LDL receptor deficient mice[J]. Atherosclerosis, 2017, 262:39-50.
[9] WU J, ZHAO F T, FAN K J, et al. Dihydromyricetin Inhibits Inflammation of Fibroblast-Like Synoviocytes through Regulation of Nuclear Factor-kappaB Signaling in Rats with Collagen-Induced Arthritis[J]. J Pharmacol Exp Ther, 2019, 368(2):218-228.
[10] ZHANG J, CHEN Y, LUO H, et al. Recent Update on the Pharmacological Effects and Mechanisms of Dihydromyricetin[J]. Front Pharmacol, 2018, 9:1204.
[11] LI H, LI Q, LIU Z, et al. The Versatile Effects of Dihydromyricetin in Health[J]. Evidence-based complementary and alternative medicine : eCAM 2017, 2017:1053617.
[12] MINTZIORI G, NIGDELIS M P, MATHEW H, et al. The effect of excess body fat on female and male reproduction[J]. Metabolism, 2020, 107:154193.
[13] MICEVYCH P E, WONG A M, MITTELMAN-SMITH M A. Estradiol Membrane-Initiated Signaling and Female Reproduction[J]. Compr Physiol, 2015, 5(3):1211-1222.
[14] SINCHAK K, WAGNER E J. Estradiol signaling in the regulation of reproduction and energy balance[J]. Front Neuroendocrinol, 2012, 33(4):342-363.
[15] NEGRON A L, RADOVICK S. High-Fat Diet Alters LH Secretion and Pulse Frequency in Female Mice in an Estrous Cycle-Dependent Manner[J]. Endocrinology, 2020, 161(10): bqaa146.
[16] NGADJUI E, NKENG-EFOUET P A, NGUELEFACK T B, et al. High fat diet-induced estrus cycle disruption: effects of Ficus asperifolia[J]. Journal of complementary & integrative medicine, 2015, 12(3):205-215.
[17] COHEN P, KAJIMURA S. The cellular and functional complexity of thermogenic fat[J]. Nat Rev Mol Cell Biol, 2021, 22(6):393-409.
[18] HOU L, JIANG F, HUANG B, et al. Dihydromyricetin ameliorates inflammation-induced insulin resistance via phospholipase C-CaMKK-AMPK signal pathway[J]. Oxidative Medicine and Cellular Longevity, 2021, 2021: 1-18.
[19] ZHANG Z, ZHANG H, LI B, et al. Berberine activates thermogenesis in white and brown adipose tissue[J]. Nat Commun, 2014, 5(1): 5493.
