赛艇测功仪2000 m全力划过程中不同分段的血液代谢组学研究
2023-10-09林家仕姚安蒋国用元曹安陈建明王向党秦宇飞
林家仕 姚安 蒋国用 元曹安 陈建明 王向党 秦宇飞
1 集美大学体育学院(厦门 361021)
2 北京市体育科学研究所(北京 100075)
运动会引起人体物质和能量的代谢变化或适应,使血液重新分配,同时产生大量的代谢产物,藉此可反映机体内部所发生的代谢变化[1]。赛艇是一项以有氧供能为主、无氧供能为辅的周期性运动项目[2,3]。研究发现,在所有有氧运动项目中,赛艇运动对人体的生理要求排在首位[4],运动员们在比赛过程中受到强烈的生理刺激后,机体组织和器官代谢会发生显著变化,而代谢能力决定了赛艇运动员的生理和专项能力。
能量供应是赛艇专项特征的重要组成部分[5],许多学者通过气体能量代谢的计算方法,发现赛艇2000 m比赛过程中,有氧供能的比例高达到80%以上[6-8]。虽然有氧供能对赛艇运动员总能量供应的贡献很大,但有研究表明,职业赛艇运动员在比赛后会出现较高的血乳酸浓度和较低的血液pH值[9],显然,有氧供能并不能完全满足赛艇运动员对能量的需求,尤其是在起航加速和冲刺阶段。
随着系统生物学的演变,生物体内诸多复杂而不可预测的变化越来越清晰。在过去二十年里,通过代谢组学认识和理解运动生理反应在运动科学领域取得了巨大的突破[10],主要涉及的研究有竞技运动训练、运动营养、运动康复、代谢应答和代谢组比较等[11],最常见的实验样本是血液和尿液。Yan 等[12]通过代谢组学的方法,对职业赛艇运动员长期训练后的血液代谢变化进行了研究,结果发现,与训练前相比,有机酸、氨基酸、糖类、胺类和脂肪酸等多种小分子代谢物在训练后1周至2周后发生了明显变化,而肌酸激酶和睾酮等生理生化指标并未发现显著差异。在竞技运动训练中,代谢组学可以反映运动过程中机体终端所发生的生物学事件,代谢物甚至可以直接调节人体的许多生理过程[13]。以往对运动代谢的研究主要体现在运动干预前后的变化[14],这虽然能显示机体代谢最终的表型信息,但是无法显示运动过程中不同阶段的变化特征[15]。鉴于此,本研究通过观察赛艇测功仪2000 m全力划过程中不同分段的血液代谢组学特征,分析运动过程中不同分段能量供应相关的潜在生物标志物,从而更加清晰地认识和理解运动过程中机体大量代谢产物和代谢通路的整体性变化特征。
1 对象和方法
1.1 研究对象
选取男子赛艇运动员12 名,均为一级运动员,基本信息见表1。受试者无烟酒习惯、无心血管疾病和长期运动损伤,测试前1 个月内无伤病。本次测试不会影响运动员的身体健康或使其面临危险,所有受试者自愿参加,均已签署知情同意书,并获得了校科技伦理委员会的批准和监督(编号:JMU202204030)。

表1 受试者基本信息
1.2 研究方法
1.2.1 实验设计
12 名赛艇运动员在4 天内依次进行赛艇测功仪2000 m全力划及过程中500、1000和1500 m模拟划测试。每天测试时间、地点和环境相同,无测试期间只进行恢复性训练,不同距离测试间隔≥24 h。测试前,实验人员及专业护士提前20 min 进入实验场地,调试好仪器,将室内温度控制在22℃~25℃。受试者调整好测功仪的阻力和坐距后,以16 浆/min 的负荷在测功仪上完成5 min准备活动,准备活动结束静坐休息5 min开始赛艇测功仪测试。第1 天进行2000 m 全力划测试,并以每500 m为一个分段,记录运动过程中不同分段的运动时间、平均桨频和平均功率,后3 天模拟第1天2000 m全力划过程中500、1000和1500 m的成绩依次进行。全程教练员跟随,给予口头鼓励和运动监督,并使用Polar 心率带(Polar Accurex Plus,Polar Elector Oy,Finland)对受试者最大心率进行监测。
如图1 所示,所有受试者在第一天运动前安静状态下采集1次肘静脉血液样本(标记为A组),作为基线血液样本。2000 m 全力划及过程中500、1000 和1500 m运动后即刻,分别再采集肘静脉血(依次标记为B、C、D 和E 组),作为不同分段血液样本。血样采集使用含有抗凝剂的紫色试管,每次采血容量不少于2 ml,整个实验采血5 次,共收集60 个血液样本。每次采血后需立即将血液进行预处理:经3000 rmp 离心10 min 后,提取上层血浆至小型EP(Eppendorf)管内,保存到-80°C冰箱直至代谢组学分析。

图1 血液样本采集流程图
1.2.2 实验质量控制
(1)受试者测试前24 h不做剧烈运动[16],保持正常作息且身体机能状态良好;(2)测试期间正常饮食,不限制热量供应,正常饮水,但不允许服用任何营养补剂或药物;(3)本次实验正式开始前,对所有受试者进行了2000 m 运动前和运动后24 h 的血液代谢组学预实验,结果显示,运动后24 h 与运动前的血液代谢特征一致,表明在赛艇运动中,间隔24 h 的运动测试可以采用同一基线值进行数据分析。也有研究显示,训练有素的男子赛艇运动员在24 h 后重复进行2000 m 试验不会影响其生理机能状态[17];间歇性大强度运动后,人体血清代谢物在1小时至1天恢复[18];马拉松运动员血浆代谢物在运动后24 h 内可以恢复到运动前水平[19]。因此,本实验只在第1天午餐后2 h安静状态下进行1次肘静脉采血,作为实验基线血液样本。
1.3 代谢组学分析
血液代谢组学分析使用高效化学同位素标记-液质联用(high performance chemical isotope labeling LC-MS,HP-CIL LC-MS)代谢组学平台进行样本分析,样品制备使用丹磺酰标记试剂盒。
1.3.1 样品前处理
(1)样本分装。所有样品进行解冻和涡旋后,将每个样品分为三个部分。第1部分,取30 μL血浆至对应的1.5 mL 离心管中,供一通道分析(30 μL/通道)。第2 部分,取30 μL 血浆放置冰箱保存,作为备份样本。第3部分,从每个样品中各取40 μL血浆合并成一个样本,经涡旋后形成混合样本,混合样本再分装成30 μL的样品,并进行标记以作为参考样本。
(2)蛋白沉淀。在每个含有30 μL 血浆的离心管中加入90 μL 预冷的质谱级甲醇,充分涡旋和低速离心后,置于-20℃冰箱静置1 小时,然后在4°C 下对样品进行高速离心(12000 rpm,10 min)。吸取90 μL上清液至新的离心管中,使用氮气吹干。
(3)胺类/酚类标记。每个样本加入25 μL 质谱级水复溶样本,并严格按照标准操作流程(SOP)及试剂盒要求进行样品标记。首先加入12.5 μL 的缓冲液试剂A,37.5 μL 的12C 标记试剂B.12(用于单独样本与混合样本的标记)或13C 标记试剂B.13(仅用于混合样本标记),在涡旋混匀后置于40°C 条件下孵育45 min。孵育完成后,加入7.5 μL试剂C,用于淬灭过量的标记试剂,并将混合溶液在40°C 条件下孵育10 min。最后,加入30 μL pH调节试剂D。
(4)样品混合。使用LC-UV对标记后的胺类/酚类次级代谢组进行定量,根据定量结果,将等量的13C 标记的混合样品加入到12C 标记的单独样品中以进行液质分析。在液质分析前,同时准备质控样本,即将13C标记的混合样品和12C 标记的混合样品等体积充分混匀后作为作为质控样本。所有样本制备完成后进行液质分析。
1.3.2 液质分离条件
每15 个样本进行一次质控样本与保留时间校准样品的分析,以监测仪器运行稳定性。仪器使用Agilent 1290 LC linked to Agilent 6546 Q-TOF Mass Spectrometer 安捷伦1290 超高效液相色谱-6546 四级杆-飞行时间质谱仪;色谱柱使用Agilent eclipse plus reversed-phase C18 column(150×2.1 mm,1.8 μm particle size);流动相A为0.1%(v/v)甲酸-水;流动相B为0.1%(v/v)甲酸-乙腈;洗脱梯度为t=0 min,25%MPB;t=10 min,99%MPB;t=13 min,99%MPB;t=15 min,99%MPB;t=15.1 min,25%MPB;t=18 min,25%MPB;流速为400 μL/min;柱温为:40°C;扫描范围为220~1000 m/z。严格按照标准操作流程(Rapid LC-MS Analysis for HP-CIL Metabolomics Platform)进行液质分析。
1.3.3 数理处理
液质分析共采集65个数据,包含60个样本数据和5 个QC 质控样本数据。数据采集并导出,经过格式转化与质量检查后,将所有数据上传至IsoMS Pro 1.2.15软件进行初步处理。65 个数据按照分组情况分为6组,其中,60个运动样本分别标记为A、B、C、D和E组,剩余5个质控数据标记为QC组。经过滤后,每组数据按照总有用信号比进行归一化处理,所有数据只有在至少一个组80%的样本中均出现的代谢物才得以保留,以去除不稳定信息。
1.3.4 数理统计分析
赛艇测功仪成绩运用SPSS26.0 软件进行分析,以平均数±标准差(±s)方式表示,并标注显著性差异P<0.05。代谢组学数据采用IsoMS Pro 1.2.15 软件进行多元统计分析(PCA、PLS-DA)和火山图分析,观察各组之间的总体分布和组间的离散程度以区分各组间代谢轮廓的总体差异,并筛选出差异代谢物。差异代谢物通过MetaboAnalyst 5.0 平台进行层次聚类分析,并结合NovaMT 代谢组学数据库与HMDB 在线数据库匹配鉴定到的所有差异代谢物,通过搜索特定代谢物的m/z 峰的精确分子质量数据来注释潜在生物标志物和评估它们的生物学作用。
2 研究结果
2.1 不同分段赛艇测功仪成绩
与第1天赛艇测功仪2000 m全力划过程中不同分段的成绩相比,后3天C、D和E组模拟划测试成绩中的运动时间、平均桨频和平均功率都达到了高度一致,且均无显著性差异(P>0.05)。如表2所示,在赛艇测功仪2000 m全力划过程中,平均功率和平均桨频呈现出不同的变化特征。其中,C组运动后的平均功率,与D、E、B组运动后相比存在显著差异(P<0.05),且随着运动距离的增加而减少;平均桨频在各组运动后无显著差异(P>0.05)。通过对不同分段运动后最大心率的监控发现,B 组运动结束后平均最大心率最高,但相比E 组运动后无显著性差异(P>0.05)。
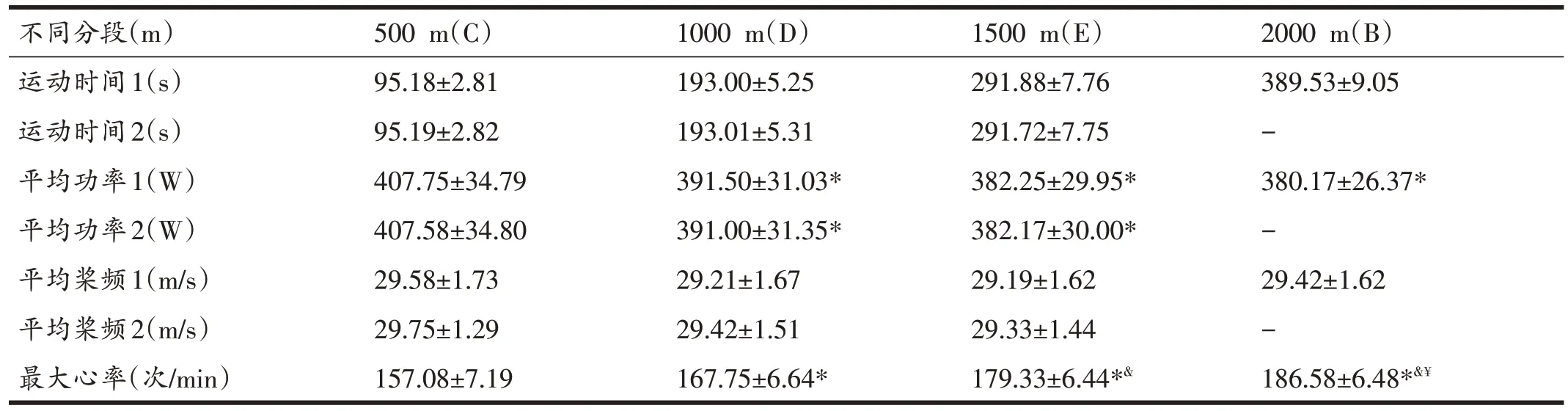
表2 不同分段赛艇测功仪成绩
2.2 多元统计分析
(1)主成分分析
采用无监督主成分分析方法(PCA)对所有数据进行分析,结果显示(图2),A、B、C、D 和E 组样本之间存在差异,但并未显著分离。在每12个样品后各注入一个具有混合质量控制样品(QC),以监测随时间推移的任何仪器漂移。通过PCA图观察到QC样本的聚类,且所有样品均处于95%的置信区间,表明仪器在运行过程中的稳定性良好。
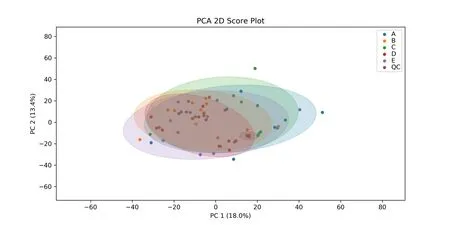
图2 主成分分析(PCA)
(2)偏最小二乘判别分析
采用有监督偏最小二乘判别分析(PLS-DA)进一步检查代谢差异,可以有效地对组间观察值进行区分,并且能够找到导致组间区别的影响变量。结果显示(图3),A、B、C、D 和E 组样本在空间上递进分离,表明不同分段之间差异代谢物含量发生了显著变化。其中,对此模型的评价显示,R2=0.775,Q2=0.467,所有值均在稳定范围内,说明所构建的模型良好,可以用于差异代谢物筛选。
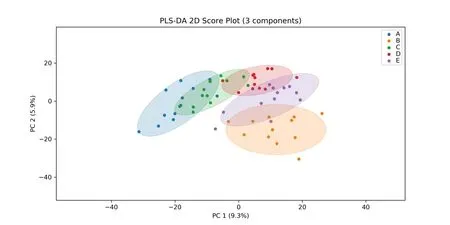
图3 偏最小二乘法判别分析(PLS-DA)
2.3 火山图分析
将检测到的所有代谢物通过差异倍数(fold change,FC)和P值绘制成火山图,以直观显示前后两组差异代谢物的整体分布情况(图4)。差异倍数通过计算A、B、C、D和E组样本分析结果的平均值的比值得到,P值来自pairedt-test,q 值来自FDR-adjustedp-value(Storey’sq-value)。当使用FC>1.5 或<0.67,P<0.05以及q<0.25 作为差异代谢物判定标准时,赛艇测功仪2000 m 全力划过程中不同分段的结果显示,AC 分段(0~500 m)共有45 个代谢物满足FC>1.5 和P<0.05,7个代谢物满足FC<0.67 和P<0.05(对应的q-value 阈值为0.046);CD 分段(500~1000 m)共有30 个代谢物满足FC>1.5和P<0.05,5个代谢物满足FC<0.67和P<0.05(对应的q-value 阈值为0.093);DE 分段(1000~1500 m)共有12个代谢物满足FC>1.5和P<0.05,1个代谢物满足FC<0.67和P<0.05(对应的q-value阈值为0.014);EB 分段(1500~2000 m)共有57个代谢物满足FC>1.5和P<0.05,15个代谢物满足FC<0.67和P<0.05(对应的q-value阈值为0.23)。
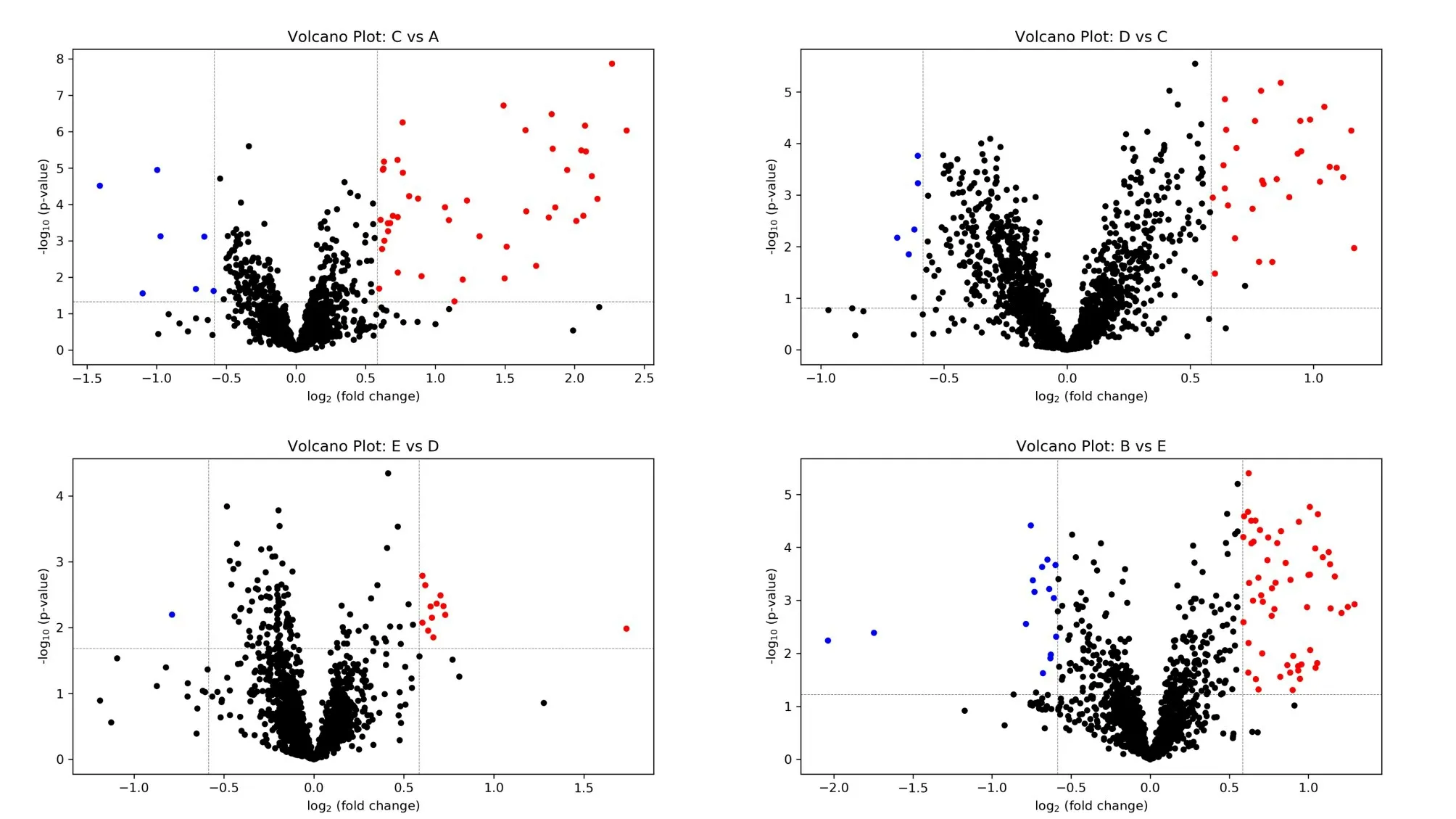
图4 差异代谢物火山图
2.4 热图分析
将预实验结果(B-24 h)与A、B、C、D、E 组进行层次聚类,通过T-test 绘制排名前100 的代谢物热图,把相同变化特征的差异代谢物归为一类,可以更直观地显示不同分段的代谢变化特征。如图2 所示,A、B、C、D 和E 组间差异代谢物的相对表达量存在显著差异(P<0.05),表明赛艇测功仪2000 m全力划过程中不同分段之间机体代谢发生了显著变化,而A 组与B-24 h组差异代谢物的相对表达量相同,不存在显著差异(P>0.05),表明运动后24 h机体代谢特征与运动前安静状态一致。因此,在赛艇运动中,当所需代谢组学样本基线相同时,间隔24 h 以上的测试,可以只采集一次安静值作为统一基线样本。

图5 层次聚类分析热图
2.5 差异代谢物筛选
通过上述差异代谢物热图分析和火山图分析结果,结合NovaMT 代谢组学数据库与HMDB 在线数据库,除去未能准确匹配和无法鉴定的代谢物后,进行最终差异代谢物筛选,当FC>1.25 或<0.83,P<0.01 以及VIP 值>1 作为差异代谢物判定标准时,共筛选出23 种显著变化的差异代谢物(表3),它们分别参与三羧酸循环(tricarboxylic acid cycle,TCA)、支链氨基酸代谢(branched-chain amino acid metabolism,BCAA)、氧化应激、氨基酸代谢、谷胱甘肽代谢、β-丙氨酸代谢、甲烷代谢、咖啡因代谢、肌酸代谢、叶酸抵抗、嘌呤代谢和甘油磷脂代谢等多个生物代谢途径(图6)。结果显示:(1)与A组(安静)相比,C组(500 m)运动后即刻的L-赖氨酸、鸟氨酸、丝氨酸、甘氨酸、4-羟脯氨酸和胱氨酸显著减少(P<0.01),N-甲基-L-谷氨酸、泛酸、对羟基苯乙酰甘氨酸、肌酐和腺嘌呤显著增加(P<0.01);(2)与C 组(500 m)相比,D 组(1000 m)运动后即刻的4-羟脯氨酸、甘氨酸、四氢嘧啶、L-缬氨酸和5-氨基戊酸显著减少(P<0.01),泛酸、抗坏血酸、对羟基苯乙酰甘氨酸、次黄嘌呤、磷酸乙醇胺、3-亚砜-L-丙氨酸、N-甲基-L-谷氨酸、胱氨酸、高香草酸和腺嘌呤显著增加(P<0.01);(3)与D 组(1000 m)相比,E 组(1500 m)运动后即刻的吲哚-3-羧酸显著减少(P<0.01),次黄嘌呤和抗坏血酸显著增加(P<0.01);(4)与E组(1500 m)相比,B 组(2000 m)运动后即刻的茶碱显著减少(P<0.01),4-羟脯氨酸、甘氨酸、次黄嘌呤、抗坏血酸、氨基己二酸和甲硫氨酸显著增加(P<0.01)。
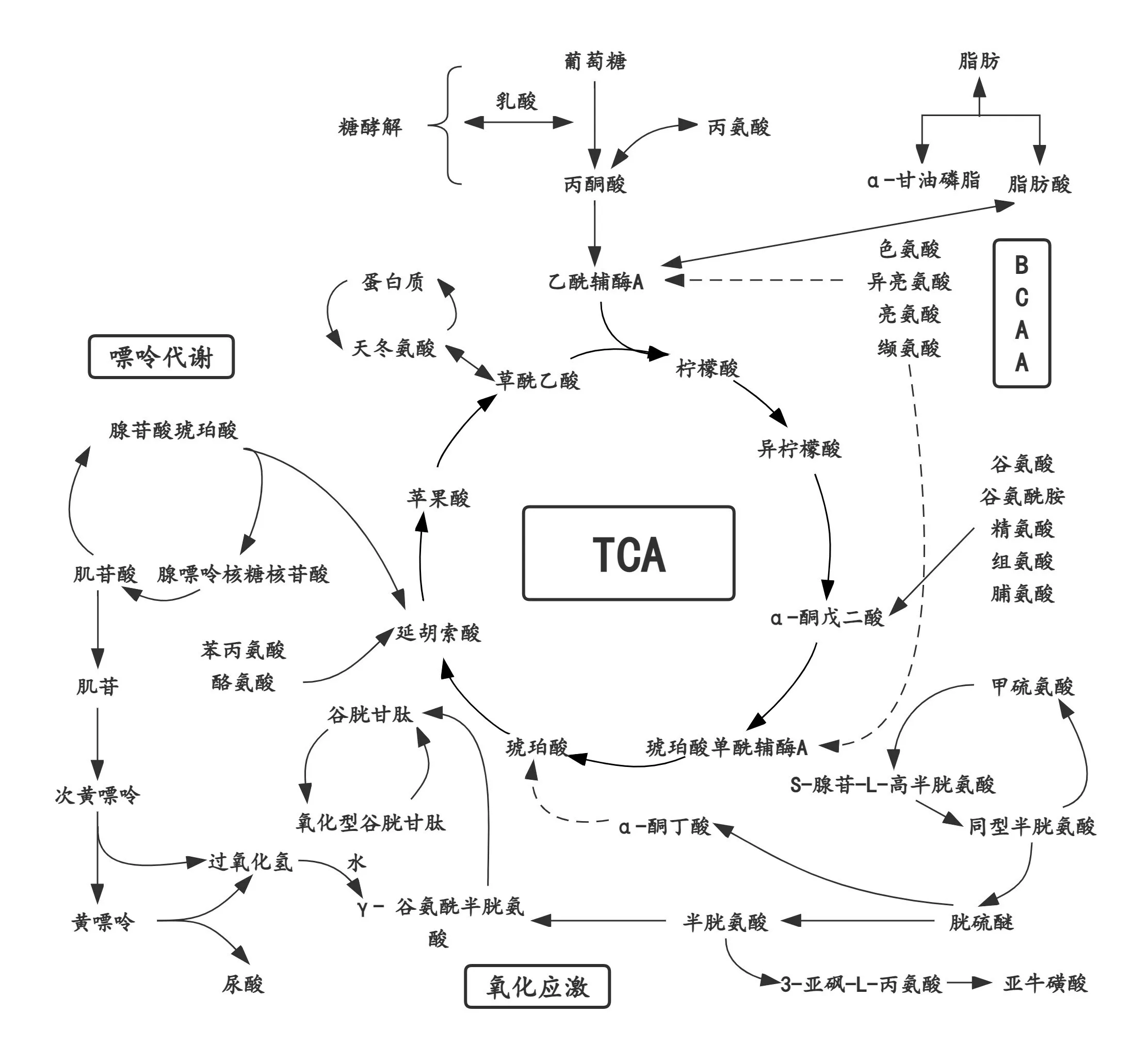
图6 代谢通路图
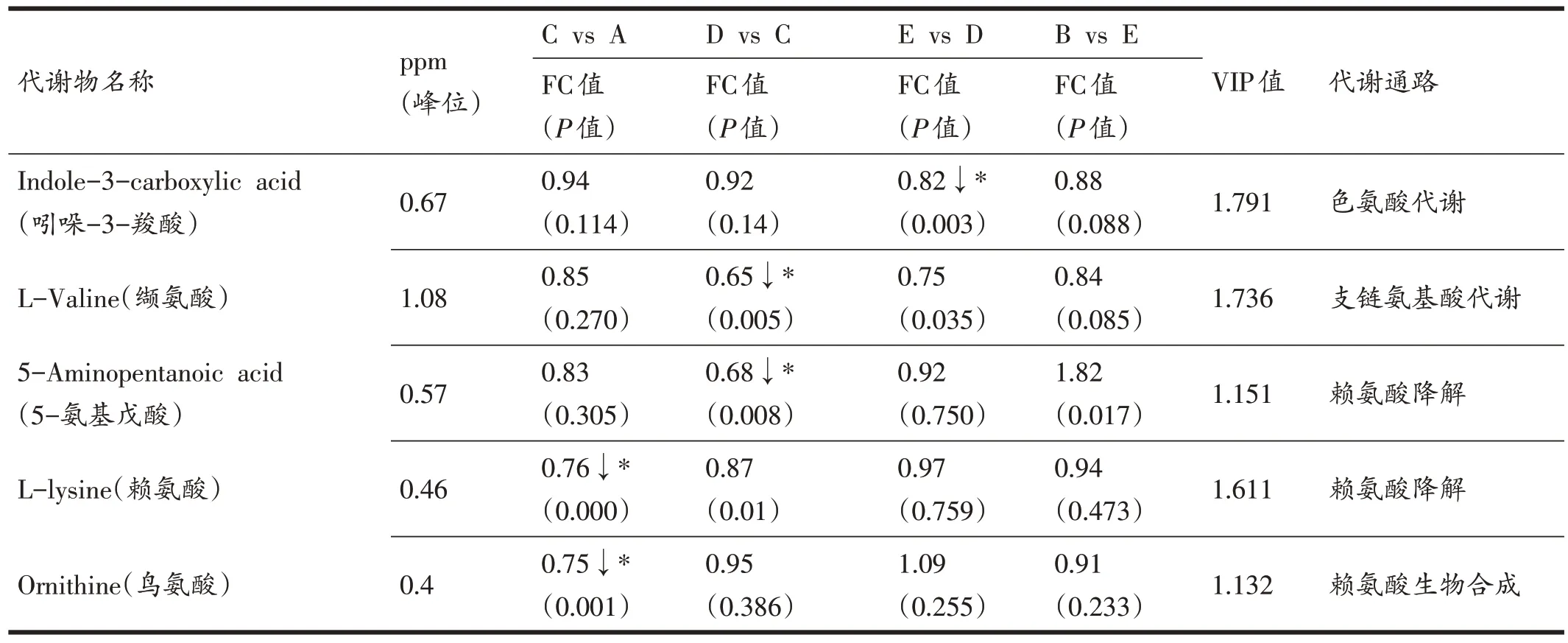
表3 不同分段的代谢物变化及代谢通路特征
3 讨论
3.1 有氧代谢对赛艇运动的影响
本研究通过分析赛艇测功仪2000 m 全力划过程中不同分段的血液代谢组学特征发现,赖氨酸、缬氨酸、磷酸乙醇胺、甲硫氨酸、甘氨酸、对羟基苯乙酰甘氨酸和茶碱等有氧代谢相关的潜在生物标志物在不同分段发生了显著变化,说明有氧代谢供能在运动过程中发挥了重要作用。赖氨酸,在体内所有必需氨基酸中贮存最多,能与酮戊二酸缩合形成酵母氨酸,并通过产生有氧呼吸底物乙酰辅酶A(乙酰CoA)促进能量的产生,它还可以通过产生肉碱帮助脂肪酸代谢,从而在线粒体中进行β氧化[22]。鸟氨酸是赖氨酸合成途径中的主要代谢物质,也是瓜氨酸和精氨酸的前体,有合成代谢的作用。氨基己二酸是赖氨酸的氧化衍生物,诱导胰腺细胞氧化和酶分泌,可以反映为活性氧(reactive oxygen species,ROS)的生成、蛋白质和脂肪的氧化以及胰腺生理紊乱等[23]。本研究中,L-赖氨酸、鸟氨酸在AC 分段(0~500 m)显著减少,表明TCA 循环、氨基酸代谢和脂肪酸代谢的增强,氨基己二酸在EB 分段(1500~2000 m)显著增加,可能是受机体氧化应激和脂肪酸氧化等影响。
缬氨酸是BCAA代谢的重要组成部分,BCAA代谢可作为能量代谢物质为长时间运动提供能量,主要在骨骼肌中进行。研究发现,运动能力强的大鼠,腓肠肌中缬氨酸水平显著高于运动能力弱的大鼠[24]。四氢嘧啶属于甘氨酸、丝氨酸和苏氨酸代谢的中间产物,是具有L型碳原子构型的氨基酸,作为相容性溶质,主要的作用是协助细胞平衡胞内外渗透压。Rakesh等[25]研究发现,四氢嘧啶能够通过提高脂膜表面的水合作用,提高细胞膜承受极端环境的能力。高香草酸是儿茶酚胺的主要代谢物,同时参与酪氨酸代谢。酪氨酸作为神经调节的氨基酸,可用于蛋白质合成,是合成儿茶酚胺、肾上腺素和去甲肾上腺素的前体,在运动中通过调节肾上腺系统功能发挥重要作用[26]。本研究中,L-缬氨酸和四氢嘧啶在CD 分段(500~1000 m)显著减少,高香草酸在CD 分段(500~1000 m)显著增加,表明BCAA 代谢、TCA 循环和氨基酸代谢增强,有氧代谢发挥重要作用。
磷酸乙醇胺属于甘油磷乙醇胺类有机化合物,是脂肪酸代谢产物,主要在大脑中表达。它是一种依赖于5'-磷酸吡哆醇的酶,能催化乙醇胺降解为乙醛、磷酸盐和氨。乙醛则可以转化为乙酰CoA,用于TCA 循环、脂质合成等[27]。乙醇胺可以通过乙醇胺激酶转化为磷酸乙醇胺[28],对心脏缺血再灌注损伤具有保护作用[29],乙醇胺还可以与花生四烯酸形成内源性大麻素。研究发现,在急性高强度运动过程中,磷酸乙醇胺以剂量依赖的方式抑制线粒体呼吸[30],并引起甘油磷脂代谢的升高,从而影响细胞膜的功能。本研究中,磷酸乙醇胺在CD 分段(500~1000 m)显著增加,说明脂肪代谢增强,甘油磷脂代谢发挥重要作用。
甲硫氨酸是一种脂肪族非极性氨基酸,可用于蛋白质生物合成,也是5-甲基四氢叶酸-同半胱氨酸甲基转移酶的甲基受体,参与到叶酸循环。甲硫氨酸还是甜菜碱分解代谢的甲基受体[31],甜菜碱作为脂酰胆碱、半胱氨酸和肉碱等物质合成的前体,可以促进脂肪代谢。研究发现,小鼠服用甜菜碱后,其有氧耐力水平会得到显著性提高[32]。本研究中,甲硫氨酸和半胱氨酸在AC(0~500 m)、CD(500~1000 m)和EB 分段(1500~2000 m)显著变化,说明有氧代谢发挥重要作用。
甘氨酸可促进脂肪代谢,降低机体血脂。在短时间大强度运动中,甘氨酸浓度会呈现下降[33]。有学者发现在800 米跑后甘氨酸浓度显著下降,且脂类代谢产物酮体也发生明显变化,并推测出甘氨酸促进了机体脂质代谢[34]。另有研究发现,大负荷训练后甘氨酸含量呈上升趋势,甘氨酸浓度上升也有可能是机体脂肪代谢供能比例上升的标志[35]。本研究中,对羟基苯乙酰甘氨酸是一种酰基甘氨酸,可以作为有氧代谢指标之一。甘氨酸酰基通常是脂肪酸的次要代谢物,可以从3,4-二羟基苯丙氨酸代谢中得到。本研究中,甘氨酸和对羟基苯乙酰甘氨酸在AC(0~500 m)、CD(500~1000 m)和EB 分段(1500~2000 m)发生了显著变化,与上述研究结果一致,但其产生不同变化特征的机制仍然未知。
茶碱被称作单酚,是咖啡因代谢的中间产物之一。补充外源性咖啡因可以增加激素敏感脂肪酶的活性和血清甘油酯的水平,从而导致脂肪酸的分解[36]。本研究中,茶碱在CD 分段(500~1000 m)显著升高,这与脂肪酸代谢有关。而在EB 分段(1500~2000 m)显著降低,可能是因为冲刺过程中,无氧代谢发挥主要作用,脂肪酸代谢被削弱。
3.2 无氧代谢对赛艇运动的影响
本研究发现丝氨酸、N-甲基-L-谷氨酸、泛酸、肌酐、腺嘌呤和次黄嘌呤等无氧代谢相关的潜在生物标志物在AC 分段(0~500 m)与EB 分段(1500~2000 m)发生了显著变化,说明无氧代谢供能在运动过程中发挥了重要作用。丝氨酸是糖酵解合成途径的一个重要分支,在生物合成途径中提供了氨基酸和核苷酸等必需前体,并控制细胞的抗氧化和甲基化能力[37]。丝氨酸转羟甲基酶可以催化丝氨酸、甘氨酸和N5,N10-甲基四氢叶酸,从而促使三者进行相互转化,并进入叶酸循环。本研究中,丝氨酸在AC 分段(0~500 m)显著减少,表明糖酵解代谢发挥了重要作用。N-甲基-L-谷氨酸是谷氨酸的一种衍生物,也是甲烷代谢的中间代谢产物,是由谷氨酸N-甲基甲胺酶催化甲胺和谷氨酸发生反应生成的,可以被甲基谷氨酸脱氢酶催化生成谷氨酸[38]。本研究中,N-甲基-L-谷氨酸受运动过程中无氧代谢的影响,在AC 分段(0~500 m)显著增加,可能与氨基酸代谢和细胞能量转运有关。泛酸被称为维生素B5,是形成乙酰CoA所必需的物质,因此在碳水化合物、蛋白质和脂肪的代谢和合成中起关键作用。泛酸对乙酰CoA 的需求增加,有可能是乙酰CoA的生物合成受到泛酸激酶活性的严格调控[39]。本研究中,泛酸在AC 分段(0~500 m)显著增加,通过乙酰CoA 变构结合抑制泛酸激酶,使乙酰CoA 生物合成减少,乙酰CoA 的减少将降低脂肪酸氧化[40],因此,在能量供应上更有利于依赖糖酵解产生乙酰CoA的氧化。
肌酐是肌肉中磷酸肌酸的分解产物,可快速合成三磷酸腺苷(ATP),也是磷酸原供能系统的主要能源物质。研究发现,击剑运动员比赛后体内肌酐含量显著升高[41]。在正常情况下,肌酐不易受食物中蛋白质的影响,而运动时,磷酸肌酸再合成也是能量供应最快的来源,并在线粒体内外的合成与转运过程中发挥着重要作用[42]。腺嘌呤和次黄嘌呤都是嘌呤代谢的产物,Shi等[43]研究发现,嘌呤代谢会随着力竭运动的增加而增加,大强度训练中,骨骼肌中嘌呤核苷酸(主要成分为ATP)代谢会加速,其代谢产物如二磷酸腺苷、单磷酸腺苷、次黄嘌呤核苷酸浓度也会升高。Balso 等[44]研究发现,短时间高强度运动也会促使腺嘌呤的含量增加,但并不会伴随肌苷的产生,这是典型的厌氧核苷酸分解代谢途径。本研究中,肌酐、腺嘌呤和次黄嘌呤分别在AC 分段(0~500 m)和EB 分段(1500~2000 m)显著增加,表明磷酸原代谢与核苷酸代谢在其中发挥了重要作用。
3.3 氧化应激对赛艇运动的影响
氧化应激过程会产生大量中间产物,这是体内氧化与抗氧化作用失衡的一种表现。本研究发现赛艇运动员在测功仪2000 m 全力划过程中,3-亚砜-L-丙氨酸、吲哚-3-羧酸、4-羟脯氨酸、抗坏血酸等氧化应激产物在不同分段发生了显著变化,说明氧化应激显著影响着赛艇运动员的运动表现。3-亚砜-L-丙氨酸参与到牛磺酸和亚牛磺酸代谢,是胱氨酸代谢产物。牛磺酸是一种控制渗透压的有机酸,是胆汁的主要成分[45],牛磺酸代谢的增强可以解释为ROS的增加[46]。而胱氨酸是其他次级代谢物不完全代谢的产物,作为传递还原信号的主要分子开关,可在人类血液中被鉴定到[47]。研究发现,胱氨酸显著增加在一定程度上可以反映人体内氧化损伤的加重程度[48]。5-氨基戊酸可以在棒状杆菌中找到,是4-氨基丁酸、2-氧戊二酸氨基转移酶的体内底物[49]。2-氨基丁酸显著增加则会增加谷胱甘肽的活性[50],谷胱甘肽在维持细胞内氧化还原平衡中起着至关重要的作用。本研究中,3-亚砜-L-丙氨酸、半胱氨酸和5-氨基戊酸在CD 分段(500-1000 m)显著增加,表明有氧代谢增强和氧化应激的产生。氧化应激可以增加肝脏谷胱甘肽合成速率,使谷胱甘肽合成的半胱氨酸供应变得有限,也可以反映ROS 的产生或通过抗氧化修复损伤失衡[51]。
吲哚-3-羧酸是色氨酸代谢过程的中间产物[52],色氨酸转化为5-羟色胺与运动疲劳有着紧密联系[53],色氨酸代谢可以激活芳基烃受体,在免疫调节过程中发挥着重要作用[54]。本研究中,吲哚-3-羧酸只在DE 分段(1000~1500 m)显著减少,表明机体疲劳程度增加。4-羟脯氨酸是胶原蛋白的主要成分,研究发现,4-羟脯氨酸水平会在抑郁和压力情况下增加[55]。本研究中,4-羟脯氨酸在AC(0~500 m)和CD(500~1000 m)两个分段显著降低,可能是ROS 的增加,加速了胶原蛋白的降解,在EB 分段水平显著升高,可能是持续运动中肌肉出现损伤导致。
抗坏血酸是一种抗氧化剂,它的生物活性形式是维生素C,可以对机体的抗氧化状态和细胞应激反应造成影响。在代谢过程中起还原剂和辅酶的作用,可作为酶的辅助因子或细胞内的抗氧化剂,保护线粒体基因组和线粒体膜免受自由基损伤。李真真等[56]研究发现,力竭运动后抗坏血酸浓度会快速升高,并证实了抗坏血酸具有提高运动能力和延缓运动疲劳的效果。另有研究表明,运动前补充抗坏血酸可减轻运动后脂质过度氧化、炎症反应、皮质醇水平和肌肉损伤等,运动后补充抗坏血酸可以减少应激条件引起的细胞损伤,并保护细胞免受应激反应[57]。本研究中,抗坏血酸在CD(500~1000 m)、DE(1000~1500 m)和EB(1500~2000 m)三个分段显著增加,可能是对自身抗氧化能力降低的一种代偿反应,有助于缓解运动引起的氧化应激,加快运动后的恢复,这也表明了抗坏血酸在赛艇运动中后程的重要影响。
3.4 局限性和建议
首先,本研究的样本量较少,只选取了12 名国家一级男子赛艇运动员作为研究对象,并且未能设置对照组。建议未来的研究中可以选取更多不同性别或不同级别的赛艇运动员作为研究对象,以进一步挖掘赛艇运动员在2000 m 运动过程中的物质和能量代谢特征。竞技运动代谢组学研究的另一个重要目标在于探究多组学技术的应用,如基因组学、转录组学、蛋白质组学等。本研究基于样本量和实验条件的限制,只采用了代谢组学这一种方法,因此,在今后的研究中可以结合更多的组学技术,以揭示竞技运动背后的生物学机制。此外,本研究还发现大量无氧代谢相关的潜在生物标志物具有较高的影响值,说明无氧代谢在赛艇运动中发挥了重要作用,建议在未来的训练中,除了注重赛艇运动员有氧能力的培养,也要重视无氧能力的提升。
4 结论
有氧代谢、无氧代谢和氧化应激相关的差异代谢物显著影响赛艇测功仪2000 m 全力划过程中不同分段的供能和运动表现,其中,泛酸、N-甲基-L-谷氨酸、腺嘌呤和次黄嘌呤等无氧代谢产物在0~500 m 分段或1500~2000 m分段发生的变化较为显著,可作为鉴别赛艇运动员无氧供能的潜在生物标志物。
