基于透明质酸酶活性的感染微环境响应型抗菌涂层的制备
2023-10-09黄义星郑镇誉徐国潮邹盛涛
黄义星,郑镇誉,徐国潮,邹盛涛
温州医科大学附属第二医院 骨科,浙江 温州 325027
现代骨科学的创立与进步,离不开金属内植入物的参与。但是骨内植入物引发的相关感染让广大临床医护人员感到非常棘手。四肢骨折手术后的相关感染发生率为5%~15%,脊柱手术后的相关感染发生率也高达2%~5%[1]。感染一旦发生,处理非常麻烦,局部应用抗生素也成为越来越多临床医师的首选方法[2]。骨内植入物表面抗菌涂层设计是在不改变骨内植入物基本结构和力学性能的前提下,赋予其缓释抗生素的功能[3]。且研究人员目前在响应性药物缓释方面取得了一定的进展,包括酶、pH、光、热和温度响应等[4-5]。相关研究显示,骨内植入物相关感染的发生主要与金黄色葡萄球菌相关,而其感染与繁殖会大量释放透明质酸酶、链激酶和血浆凝固酶等[6]。本研究期望用细菌感染后产生的透明质酸酶自动降解抗菌涂层中的透明质酸(hyaluronic acid,HA),从而促成抗生素的释放,实现涂层的智能响应性缓释效果。
1 材料和方法
1.1 材料 蒙脱土(montmorillonite,MMT)购自山东优索化工科技有限公司;透明质酸和万古霉素(vancomycin,VA)购自西安普瑞斯生物工程有限公司;原子力显微镜(FM-NanoviewRa-AFM)购自苏州飞时曼精密仪器有限公司;扫描电镜(SEM3300)购自北京大束科技有限责任公司;金黄色葡萄球菌购自上海抚生实业有限公司;鬼笔环肽和DAPI购自北京索莱宝科技有限公司;克氏针购自东莞市联顺精密金属材料有限公司;椭圆偏振光谱仪(UVISEL Plus)购自苏州上器试验设备有限公司;共聚焦显微镜(LSM900)购自北京普瑞赛司仪器有限公司;核酸蛋白检测仪(HD-2000)购自深圳三莉科技有限公司;MC3T3细胞购自上海通派生物科技有限公司;TNF-α ELISA试剂盒、碱性磷酸酶试剂盒、钾离子检测试剂盒购自上海酶联生物科技有限公司;硅片购自苏州晶矽电子科技有限公司;涂菌棒购自北京龙谷天成科技发展有限公司;透明质酸酶购自上海弘顺生物科技有限公司;生化培养箱(LRH-250)购自上海瑞稳仪器设备厂;SD大鼠购自南京君科生物工程有限公司[SCXK(沪)2018-0006]。
1.2 方法
1.2.1 聚合物抗菌涂层的制备:0.5 g MMT溶解于200 mL去离子水中,获得浓度为2.5 mg/mL,放置在磁力搅拌器上(60 r/min)搅拌24 h后,在4 ℃冰箱中静置1周。同样方法配置HA溶液,浓度为2 mg/mL。进一步在HA溶液中加入VA,获得HA-VA(透明质酸-万古霉素)终浓度为1 mg/mL。按照实验设计要求准备组装基材,如克氏针、硅片、对聚二甲基硅氧烷(PDMS)等;并依次在去离子水、无水乙醇、去离子水中超声处理20 min,烘干,放置在4 ℃冰箱中。在组装开始之前,将所有预配溶液超声过夜。依次将组装基材浸泡在MMT和HA-VA溶液中30 min,每次从溶液中取出后均先在氮气下吹干,然后再次浸入下一步溶液中,以此记为一组装双层。重复上述组装步骤,获得最终所需的蒙脱土/透明质酸-万古霉素5[(MMT/HA-VA)5]多层膜聚合物抗菌涂层。
1.2.2 聚合物抗菌涂层的材料学表征:在聚合物多层膜涂层的组装过程中,通过原子力显微镜跟踪了涂层表面粗糙度的变化情况,并记录粗糙度的具体数值。
1.2.3 聚合物抗菌涂层的细菌响应和酶响应性缓释行为的检测:以硅片为组装基材,在硅片表面构建(MMT/HA-VA)5多层膜涂层。在24孔板中分别加入2 mL PBS、104CFU/mL金黄色葡萄球菌溶液、106CFU/mL金黄色葡萄球菌溶液、100 U/mL透明质酸酶溶液(HAS)和160 U/mL HAS。将表面负载(MMT/HA-VA)5多层膜涂层的硅片同时放入上述孔中,保证溶液可以完全浸没过硅片,并将制备完毕的(MMT/HA-VA)5多层膜涂层作为(MMT/HA-VA)5组,不与细菌或酶接触。继续将24 孔板放置在细菌培养箱(37 ℃)中孵育48 h。待达到规定孵育时间后,同时取出所有硅片,使用氮气进行完全吹干,使用扫描电镜观察各组多层膜涂层在共培养后表面形貌的变化情况。抑菌环实验:制备琼脂板,对金黄色葡萄球菌进行扩增,用移液枪吸取100 µL浓度为108CFU/mL的金黄色葡萄球菌,采用涂菌棒涂抹均匀,将硅片放置在琼脂板中央,置于细菌培养箱培养24 h,隔日测量抑菌环直径。利用椭圆偏振光谱仪,通过光谱椭圆偏振法测量各组多层膜涂层的厚度。
1.2.4 聚合物抗菌涂层的抗菌性能测试:细菌内部存在丰富的碱性磷酸酶、钾离子、蛋白质和核酸,并且保持稳定状态以保证细菌的生命支持。当细菌的细胞壁完整性受到破坏后,以上细胞内容物会被释放到胞外。故可以通过检测细菌胞外碱性磷酸酶、钾离子、蛋白质和核酸含量的多少来评价细菌的活性,进一步反映聚合物抗菌涂层的抗菌性能。以体积为1 cm3的PDMS为组装基材,在其表面构建(MMT/HA-VA)5多层膜聚合物涂层,表面未经任何修饰的空白PDMS作为空白组。将2组PDMS先经紫外灭菌24 h,然后放置入15 mL离心管中。取对数生长期的金黄色葡萄球菌,采用0.9%氯化钠溶液稀释至细菌浓度为1×106CFU/mL。在每个离心管中加入5 mL上述浓度金黄色葡萄球菌。将上述混合菌液放置在细菌培养箱中培养(37 ℃,100 r/min)。在第4 h、12 h和24 h提取菌液,5 000 r/min离心15 min,吸取上清液,使用碱性磷酸酶试剂盒按说明书操作步骤测上清液吸光度值(405 nm)。同时使用钾离子检测试剂盒,继续测定吸光度值(450 nm)。实验通过检测共培养菌液中蛋白质和核酸的含量变化来评估金黄色葡萄球菌生物膜通透性的改变。金黄色葡萄球菌混合菌液配置参数同上,在4、12和24 h分别提取菌液,离心机5 000 r/min转速离心15 min,吸取上清液,使用核酸蛋白检测仪在波长280 nm(蛋白质)处和260 nm(核酸)处检测吸光度值。
1.2.5 聚合物抗菌涂层的细胞相容性检测:制备聚合物抗菌涂层的提取液。实验所需提取液应按照固体表面积与浸提液体积的比例为0.2 g/mL的原则进行提取。按照上述原则,以0.9%氯化钠溶液为浸提液,获得(MMT/HA-VA)5多层膜涂层提取液。使用24孔板培养细胞,单孔接种约5.0×104个小鼠前成骨细胞(MC3T3细胞),(MMT/HA-VA)5组加入200 µL上述获得的提取液,空白组加入等量含血清培养液,培养24 h。去除培养基,PBS清洗3遍,多聚甲醛固定0.5 h,再次使用PBS清洗3次,进行鬼笔环肽(Phalloidin)染色和4’,6-二脒基-2-苯基吲哚(DAPI)染色,并采用计算机内置软件导出两种染色合成图。
1.2.6 聚合物抗菌涂层体内实验:以在SD大鼠胫骨内插入髓内针的模式构建大鼠骨内植入物相关感染模型,本研究已通过温州医科大学实验动物伦理委员会的批准。分为3组:感染组、(MMT/HA-VA)5组和空白组。感染组在大鼠胫骨隧道内注射5 µL金黄色葡萄球菌菌液(104CFU/mL)并植入未经修饰的克氏针。(MMT/HA-VA)5组同样注射等量等浓度的金黄色葡萄球菌,但植入表面经(MMT/HA-VA)5多层膜聚合物涂层修饰的克氏针。空白组不注射细菌,但是植入未经修饰的克氏针。动物造模结束后,饲养8周处死;分别在第1、2、4、6、8周从大鼠尾静脉抽取血液,根据ELISA法跟踪大鼠体内炎症因子(TNF-α)的变化趋势。处死大鼠后,立即从胫骨隧道内取出克氏针放置在琼脂涂板上培养,并将大鼠骨组织脱钙进行组织学分析。
1.3 统计学处理方法 采用SPSS21.0软件进行数据处理分析。计量资料用±s表示,多组间比较用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 聚合物抗菌涂层的材料学表征 原子力显微镜检测见涂层表面具有粗糙结构,起伏有致,凹凸不平。视觉上直观的感觉就是组装粒子聚集程度高的区域形成山峰,亮度大,而组装粒子聚集程度低的区域形成山谷,亮度小,见图1。随着组装过程的进行,复合物材料表面的表面粗糙度呈现出逐渐增加的趋势。当组装完毕一双层之后,涂层表面的粗糙度为(383.67±5.44)nm。组装获得(MMT/HA-VA)3多层膜涂层结构,其表面粗糙度为(425.33±10.78)nm。最终获得目标涂层(MMT/HAVA)5,测试得其表面粗糙度为(576.33±8.96)nm,见图2。(MMT/HA-VA)5和(MMT/HA-VA)1相比,表面粗糙度有所增加(P<0.05)。

图1 组装过程中多层膜材料表面粗糙度3D图

图2 组装过程中多层膜材料表面粗糙度数值变化
2.2 聚合物抗菌涂层的细菌响应和酶响应性缓释行为的检测 扫描电镜见制备完毕的(MMT/HA-VA)5多层膜结构表面覆盖均匀,涂层比较致密紧实。经过PBS浸泡之后,其表面未发生明显变化,显示出比较优异的稳定性。但在与细菌或者酶接触后,涂层表面发生不同程度的崩解剥落,但依然有部分结构残留在涂层表面,而且随着细菌或酶浓度的增加,涂层表面的崩解程度也在明显增加,残留结构进一步减少,见图3。104CFU/mL金黄色葡萄球菌组、106CFU/mL金黄色葡萄球菌组、100 U/mL HAS组和160 U/mL HAS组与(MMT/HA-VA)5组比,形成的抑菌环的大小和表面涂层的厚度差异均有统计学意义(P<0.01),见图4。

图3 (MMT/HA-VA)5多层膜涂层与各组接触后涂层表面扫描电镜图

图4 (MMT/HA-VA)5组、PBS组、104 CFU/mL金黄色葡萄球菌组、106 CFU/mL金黄色葡萄球菌组、100 U/mL HAS组、160 U/mL HAS组形成的抑菌环的大小和表面涂层的厚度
2.3 聚合物抗菌涂层的抗菌性能测试 随着时间的增加,空白组和(MMT/HA-VA)5组的胞外碱性磷酸酶、钾离子、蛋白质和核酸含量均表现出增加的趋势;(MMT/HA-VA)5组所检测的上述细菌内容物含量都高于空白组,差异均有统计学意义(P<0.05),见图5-8。

图5 (MMT/HA-VA)5组和空白组分别与金黄色葡萄球菌共培养4、12、24 h后胞外碱性磷酸酶含量
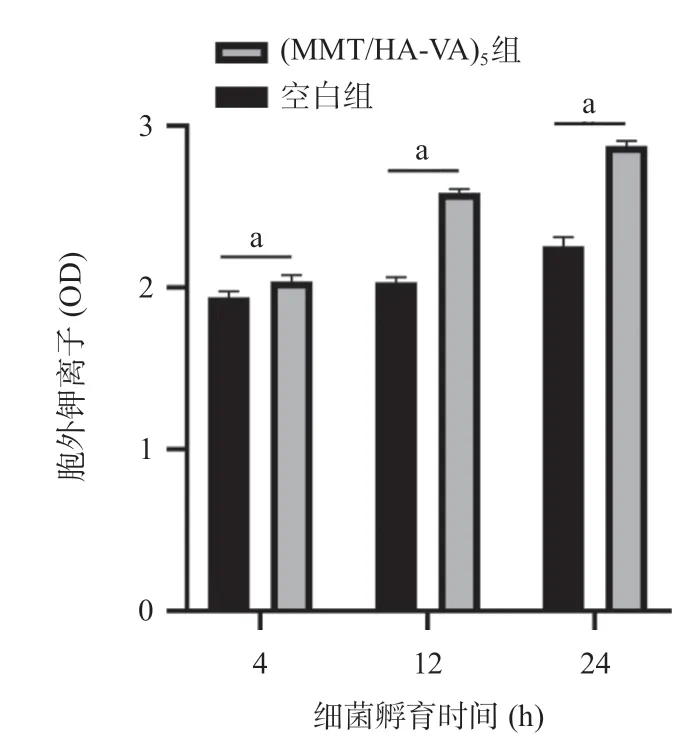
图6 (MMT/HA-VA)5组和空白组分别与金黄色葡萄球菌共培养4、12、24 h后胞外钾离子含量

图7 (MMT/HA-VA)5组和空白组分别与金黄色葡萄球菌共培养4、12、24 h后胞外蛋白质含量
2.4 聚合物抗菌涂层的细胞相容性检测 共聚焦显微镜可见骨髓间充质干细胞的细胞核被染成蓝色,而细胞质内的肌动蛋白丝则被鬼笔环肽染成红色。2组细胞的伸展状态均比较充分,没有明显差异。2组细胞骨架中的肌动蛋白微丝在数量和分布密度方面对比也比较类似。提示(MMT/HA-VA)5多层膜涂层具有良好的细胞相容性,浸提液安全可靠,对大鼠骨髓间充质干细胞没有明显的不良反应和不良干扰,见图9。

图9 空白组和(MMT/HA-VA)5组与MC3T3细胞共培养后Phalloidin染色、DAPI染色和两种染色合成图(×100)
2.5 聚合物抗菌涂层体内实验 感染组在最初的6周内,炎症因子急剧升高,之后一直稳定在较高水平,证明该感染模型设计合理;空白组的TNF-α水平始终维持在正常水平,未发生感染,提示该操作人员的实验技术、动物管理过关;对于植入表面负载(MMT/HA-VA)5多层膜涂层克氏针的大鼠,在髓腔内注射有较高浓度的菌液,但检测其炎症因子依然稳定在正常水平以内;感染组和空白组间TNF-α水平差异有统计学意义(P<0.05),说明该骨内植入物相关感染模型造模成功;感染组和(MMT/HA-VA)5组间TNF-α水平差异有统计学意义(P<0.05),说明(MMT/HA-VA)5涂层具有优异的抗感染功能;而(MMT/HA-VA)5组和空白组间TNF-α水平差异无统计学意义(P>0.05),证明含涂层克氏针植入大鼠体内后未引起额外的炎症反应。见图10。在感染组中的克氏针表面检测出细菌,而(MMT/HA-VA)5组中未能检测到,见图11。空白组代表正常骨组织的结构形态,感染组中由于细菌大量繁殖,出现大量炎症细胞,(MMT/HA-VA)5组中没有发现炎症细胞,骨小梁结构清晰,见图12。

图10 大鼠模型术后各组TNF-α水平检测

图11 感染组、(MMT/HA-VA)5组和空白组克氏针表面细菌培养(光镜,×4)

图12 感染组、(MMT/HA-VA)5组和空白组骨组织HE染色结果(×200)
3 讨论
在医学技术飞速发展的今天,骨内植入物材料是骨科最常见和最重要的手术耗材,但是由其引发的相关感染问题却严重困扰着广大临床医师。近年来,据相关文献报道,骨折内固定手术后骨感染总体发生率为0.4%~16.1%,其中闭合性骨折手术之后感染发生率为0.4%~2.0%,而开放性骨折手术后感染发生率为1.0%~55.0%,并且骨折情况越严重,手术后相关感染发生率越高[7]。感染发生后,如果不能有效及时处理,将会导致骨髓炎或者骨坏死的发生[8]。究其主要原因是常见的引起感染的细菌,如金黄色葡萄球菌,对各种骨科内植入物材料具有很强的亲和力,非常容易黏附在材料表面上[9]。其次人体受到骨折等创伤后,机体局部免疫系统受损也会促使细菌增殖并进一步形成难以根除的细菌生物膜[10]。现阶段临床医师对骨内植入物相关感染采取的治疗策略主要集中在早期清创和全身应用大剂量抗生素治疗这两个方面[11]。然而从细菌感染的进展过程来看,患者一旦需要清创,说明细菌已经在骨内植入物周围繁殖增长了一段时间,而全身应用大剂量抗生素会对患者的正常组织和脏器产生不良反应[12]。
针对以上问题,研究人员将目光锁定在骨内植入物的表面涂层研发上,希望能在第一时间杀灭黏附在骨内植入物表面的细菌,从而在病情发生发展的起点进行有效干预[13]。这样既可以保证骨内植入物内固定的力学作用,也能预防或者治疗内植入物相关感染,并且减少了全身应用抗生素的不良反应。为此,研究人员和临床医师做出了巨大的研究和努力,并取得了一定的成果。例如:BRAEM等[14]在钛金属表面构建介孔二氧化硅(SiO2)扩散屏障,可以有效实现金属表面释放抗生素。MCMANAMON等[15]采用超声喷涂技术将庆大霉素负载到钛金属表面,并继续涂覆聚乳酸。RADIN等[16]以万古霉素、硅酸乙酯、乙醇、盐酸和去离子水为原料,利用浸泡法成功在骨内植入物表面构建水凝胶-万古霉素涂层。尽管上述骨内植入物表面的抗菌涂层都具备优异的抗感染性能,但是研究人员还是从中发现一部分问题,其中最重要的问题是,上述设计的药物缓释行为不可调控,即在内植入物植入生物体内的起始阶段基本都存在药物的“暴释”现象,难以实现长效的缓释和按需缓释[17]。而长效的药物缓释和按需缓释效果恰恰是预防和治疗骨内植入物相关感染的最理想要求。研究人员希望骨内植入物表面抗菌涂层的药物释放行为能够实现适量可控,在保证杀灭细菌的同时尽量减少不良反应[18]。HAS是一种线性大分子酸性黏多糖,在人体内广泛分布,具有调控细胞增殖分化,润滑关节腔,保护软骨、促进创伤修复等重要生理作用[19]。MMT别名胶岭石,由于特殊的结构构造,具有很强的吸附能力,广泛用作医用材料的载体[20]。VA主要通过干扰细胞壁中肽聚糖的合成,从而达到抑菌效果,在实际临床应用中主要用于骨内植入物相关感染的治疗[21]。笔者认为,本研究所制备的(MMT/HA-VA)5复合物多层膜涂层具备以下优点。在体外实验中,该抗菌涂层具备显著的细菌浓度依赖性特点,可以根据细菌释放的HAS按需释放抗生素。这将在临床上具备实际的应用意义,即在没有细菌感染发生的情况下,抗生素可以比较稳定的“储存”在(MMT/HA-VA)5复合物多层膜结构中,一旦发生细菌感染,其释放的HAS将会触发抗菌涂层发生崩解,该缓释特点不仅可以根据细菌感染发生的严重程度可调控地释放抗生素,同时可以延长抗菌涂层的有效作用时间,我们认为该涂层在一定程度上可以实现基本的“智能”化药物缓释。基于以上体外抗菌特点,本研究经过进一步探索,证实(MMT/HA-VA)5复合物多层膜涂层具有高效的杀菌能力和可靠的生物安全性。在大鼠在体实验中进一步发现,该抗菌涂层依然表现稳定,抗感染效果显著。
综上所述,本研究制备的(MMT/HA-VA)5复合物多层膜涂层具有良好的生物安全性和高效的体内体外杀菌效果。并能够根据感染的严重程度,自动调控抗生素缓释的剂量,在有效保证杀灭细菌的前提下,尽可能减少不良反应并延长抗菌涂层的有效作用时间,是一种相对理想的骨内植入物表面抗感染涂层,对解决临床相关问题具有潜在的应用价值。
