阿米卡星在老年肾功能不全患者中生理药动学模型的建立与应用 Δ
2023-10-09李乔希管宴萍吴莉莉佛山市第一人民医院药学部广东佛山58000中山大学药学院临床药理研究所广州50030
李乔希 ,管宴萍 ,夏 晨 ,吴莉莉 ,王 妍 (.佛山市第一人民医院药学部,广东 佛山 58000;.中山大学药学院临床药理研究所,广州 50030)
阿米卡星是一种氨基糖苷类抗菌药物,在临床上被广泛用于治疗由革兰氏阴性病原菌引起的细菌感染,对铜绿假单胞菌等常见多药耐药菌也有较好的抗菌效果[1]。阿米卡星作为一种浓度依赖性抗菌药物,其体内抗菌效果取决于药动学-药效学指标,即血药峰浓度(cmax)与最小抑菌浓度(MIC)之比[2]。肾毒性是阿米卡星最常见的严重不良反应之一,这与其在肾小管中出现饱和性蓄积有关[3],通常认为稳态谷浓度<4 μg/mL有利于降低其肾毒性的发生风险[2]。因此,每日1次的给药方案有助于增强阿米卡星的抗菌效果,减少肾毒性的发生[4]。
阿米卡星的体内药动学过程具有较大的个体间差异,易受患者年龄、体重、肾功能水平等多种因素影响[1],同时由于阿米卡星的治疗窗较窄且不良反应较严重,所以开展精准用药以保证其临床疗效和避免毒性反应发生就显得非常重要。阿米卡星在体内主要经肾排泄,肾功能水平是影响阿米卡星体内暴露的最主要因素,因此根据血肌酐水平调整阿米卡星给药方案较为常见。老年人因身体机能衰退和免疫功能低下,是住院患者中抗菌药物使用最广泛的特殊人群之一。由于受衰老和基础疾病等因素影响,老年人的解剖学和生理学特征与中青年人存在一定差异,因此有必要根据药物在老年患者体内的药动学过程来调整给药方案[5]。
生理药动学(physiologically-based pharmacokinetic,PBPK)模型是一种以人体的解剖学和生理学特征为基础,结合药物的理化性质和生物化学过程建立的一种用于描述和模拟药物体内药动学过程的数学模型[6]。近年来,PBPK 模型已被广泛用于药物研发和临床应用的各个领域,特别是预测药物在特殊人群体内的药动学过程方面。采用PBPK 模型模拟的方法,根据已有临床研究数据,对部分关键解剖学和生理学参数进行调整,能预测未报道的特殊人群用药后的体内暴露情况[6],可为临床精准用药提供有效信息和安全保障。基于此,本研究建立了阿米卡星在老年肾功能不全患者体内的PBPK模型,估算其暴露情况,从有效性和安全性两方面对模拟的给药方案进行评价,旨在为阿米卡星在老年肾功能不全患者中的临床合理用药提供参考。
1 材料
1.1 软件工具
使用PK-SIM®软件(version 11,Bayer Technology Services)实现PBPK 模型的构建、拟合和模拟。使用Graph Grabber 软件(version 2.0.2,Steven Benbow)获取已发表文献中的药时曲线等数据。使用PkanalixTM软件(version 2021R2,Lixoft)的非房室模型功能计算文献数据或模拟数据的药动学参数。使用R语言软件(version 4.1.2)及相关软件包实现图像的制作、编辑及用单因素方差分析结合事后检验进行多组数据间的统计比较。
1.2 资料来源
检索DrugBank数据库以获取阿米卡星的理化性质参数。以“阿米卡星”“药动学”“老年”“肾功能不全”“amikacin”“pharmacokinetic”“elderly”“renal impairment”为中英文关键词,检索PubMed、Google scholar、Web of Science、中国知网等学术引擎,获取成人体内药动学特性参数以及模型验证所需的临床药动学数据。排除人口学资料欠缺、给药方案模糊、药时曲线缺失、给药方案重复的研究,将收集到并应用于模型建立和验证的临床药动学研究整理汇总(表1)。
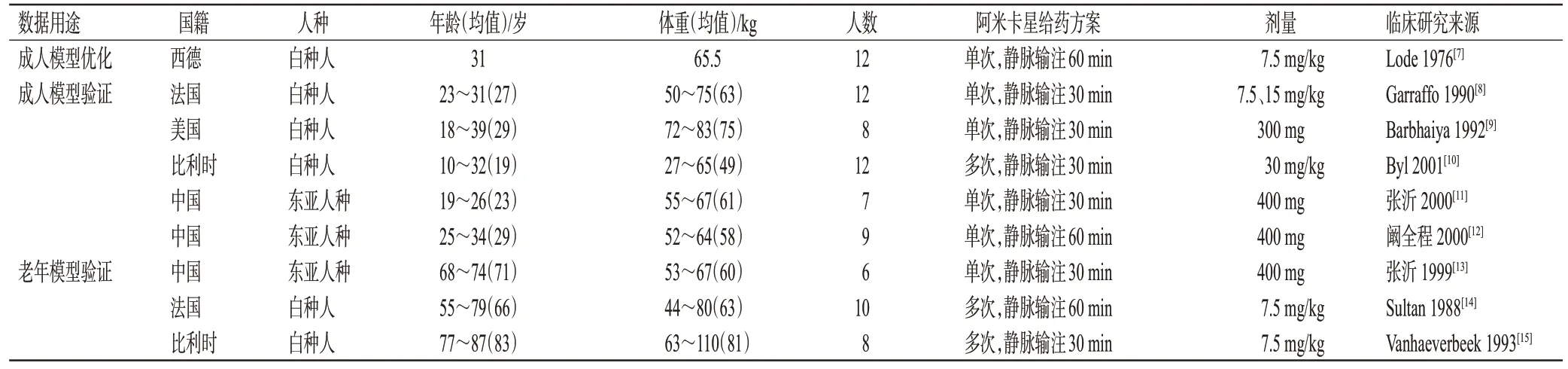
表1 阿米卡星PBPK模型建立与验证中使用的临床药动学研究
2 方法
2.1 PBPK模型研究流程
首先,输入阿米卡星理化性质参数(如脂水分配系数)和体内药动学特性参数(如肾小球滤过比例),建立静脉输注阿米卡星在成人体内的PBPK模型并根据临床研究数据进行参数优化。其次,固定理化性质参数和药动学特性参数设置,将成人模型外推至老年肾功能正常和肾功能不全患者。将模拟得到的数据与真实临床研究数据进行比较,对模型预测性能进行验证。最后,使用最终模型模拟老年不同程度肾功能不全患者静脉输注阿米卡星临床常用剂量后的血药浓度数据,对安全性和有效性进行评估。
2.2 成人PBPK模型建立与验证
根据查询资料所得的理化性质参数和药动学特性参数初始值(表2),建立阿米卡星的“化合物”模块。使用PK-SIM®软件内置的成人模型描述阿米卡星在成人体内的分布情况,该模型包含18 个组织器官形成的隔室,隔室之间由动静脉血液循环连接,组织分配系数和细胞膜渗透性使用默认的“PK-SIM standard”算法计算。由于阿米卡星在健康人体内主要经肾小球滤过消除,剩余约10%通过非肾途径消除[7],故使用肾小球滤过模型(公式1)和非肾的全身清除模型组合描述阿米卡星的体内消除过程(公式2):
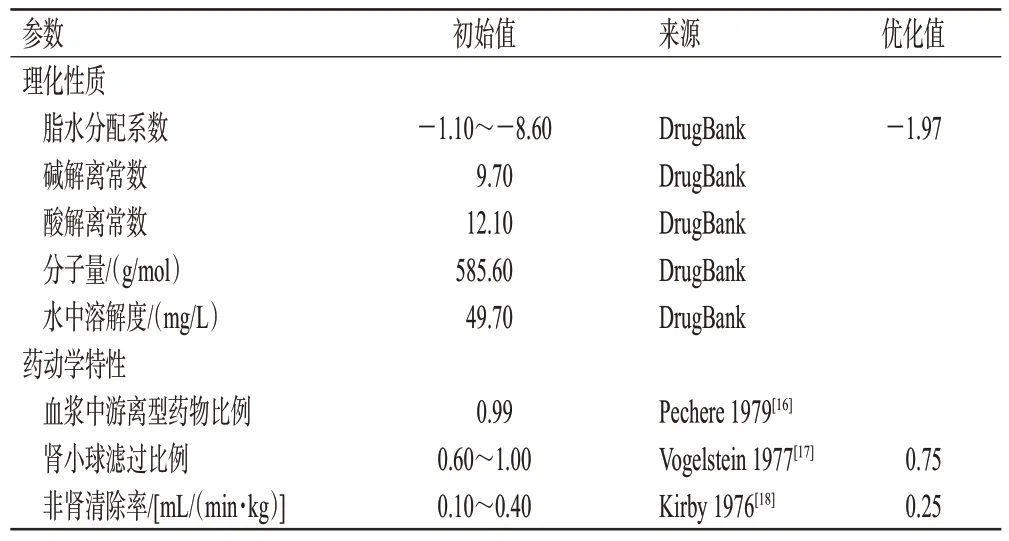
表2 阿米卡星PBPK模型建立中化合物相关参数
其中,GFR为肾小球滤过率;fu为血浆中游离型药物比例;fGFR为肾小球滤过比例,该值用以量化药物在肾小管重吸收或主动分泌对滤过性清除的影响;CLrenal为肾清除率;CLnon-renal为非肾清除率;CLtotal为总清除率。
在“人口模型构建”模块中输入表1中成人药动学研究的人口学资料信息,建立成人个体和群体模型。根据成人药动学研究的给药方案,模拟生成血药浓度数据,并对表2中的部分参数进行拟合优化,得到阿米卡星在成人体内的PBPK模型。
将模拟给药个体模型的血药浓度预测值(Cpre)与观测值(Cobs)进行比较,生成拟合优度图,Cpre与Cobs误差应在2 倍范围以内[19]。按公式3 计算相对残差,以评估模型的准确性,若相对残差绝对值<30%,说明模型预测准确性较好[20]。同时,比较各模拟场合下药动学参数的预测值(Ppre)与观测值(Pobs)的一致性,按公式4计算平均折叠误差(mean fold error,MFE),以评估模型的预测性能,若0.5<MFE<2,则说明模型预测性能良好[21]。
2.3 老年患者模型的外推与验证
通过PK-SIM®软件中内置的年龄相关性算法调整解剖学和生理学参数,输入表1中老年患者药动学研究的人口学资料信息,建立老年患者个体和群体模型。随后,输入优化后的成人模型化合物相关参数,外推生成阿米卡星在老年患者体内的PBPK 模型,使用老年肾功能正常患者[13]、老年肾功能不全患者[15]及重症监护室(ICU)老年患者[14]的临床药动学数据对模型进行验证。
2.4 老年肾功能不全患者给药方案评价
将“人口模型构建”模块中的疾病状态由“健康”更改为“慢性肾病(chronic kidney disease,CKD)”,GFR 范围设置为60~89(CKD2 期)、45~59(CKD3a期)、30~44(CKD3b 期)、15~29(CKD4 期),单位为mL/(min·1.73 m2),建立老年轻度至重度肾功能不全患者群体模型(年龄65~85岁,数量200人,男女各50%)。模拟静脉输注阿米卡星治疗革兰氏阴性菌感染情况下患者的稳态血药浓度。给药剂量为5、7.5、10、15、20 mg/kg,给药间隔为24、36、48 h,输注时间为30 min。对给药后60 min的cmax和下一次给药前的谷浓度进行统计分析[2]。以cmax/MIC≥8作为抗菌效果的药效指标,稳态谷浓度<4 μg/mL 作为避免肾毒性风险的安全指标[1—2]。计算各模拟场合下的目标达成率(probability of target attainment,PTA),预期目标为PTA≥90%。
3 结果
3.1 阿米卡星成人PBPK模型
根据一项成人的临床药动学研究[7]建立个体模型,并利用静脉输注阿米卡星后的药时曲线和尿药排泄数据,对脂水分配系数、fGFR、CLnon-renal进行拟合优化,优化后的参数值见表2,拟合的药时曲线见图1。由图1 可知,建立的阿米卡星成人PBPK模型可较好地对观测数据进行拟合,且能较准确地描述阿米卡星在成人体内的药动学过程。本次拟合中cmax和从0 到无穷大时间的药时曲线下面积(area under the concentration-time curve within infinite time,AUC0-∞)的MFE分别为0.83和0.92。
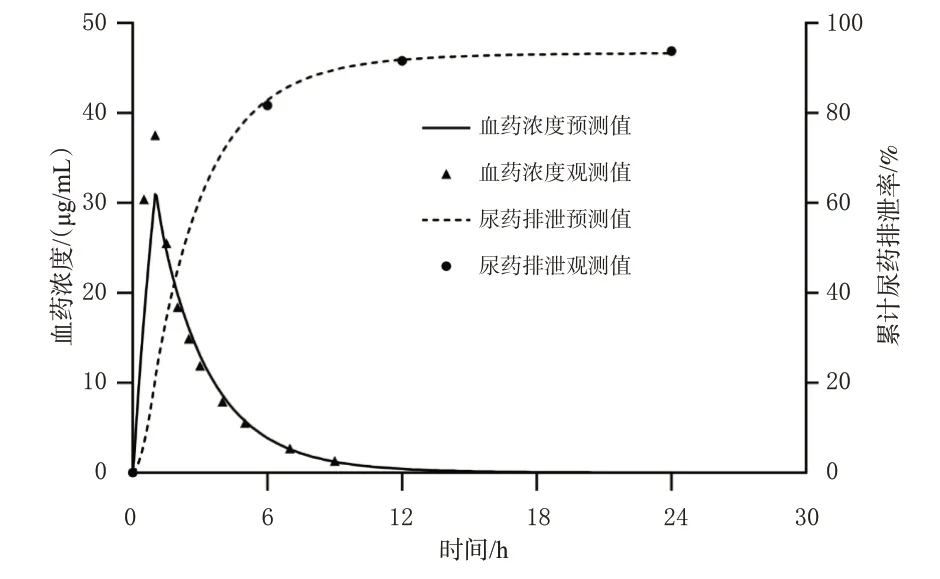
图1 单次静脉输注7.5 mg/kg 阿米卡星后药时曲线和尿药排泄率的预测值与观测值
随后,根据6 项成人临床药动学研究中的数据[8—12],分别建立对应的个体和群体模型,通过外部数据验证的方式对模型预测性能进行评估。结果显示,56个观测值中位于预测值90%置信区间的比例>80%(图2);约95%的预测值位于观测值2 倍误差范围内(图3A);仅6个浓度点相对残差超过±50%,位于±30%区间的浓度点比例>80%,相对残差绝对值均数为25%(图3B)。所有参数的MFE 均在>0.5~<2 范围内(表3)。以上结果说明,模型具有较好的预测性能,可以较准确地预测不同给药方案下阿米卡星的血药浓度数据。
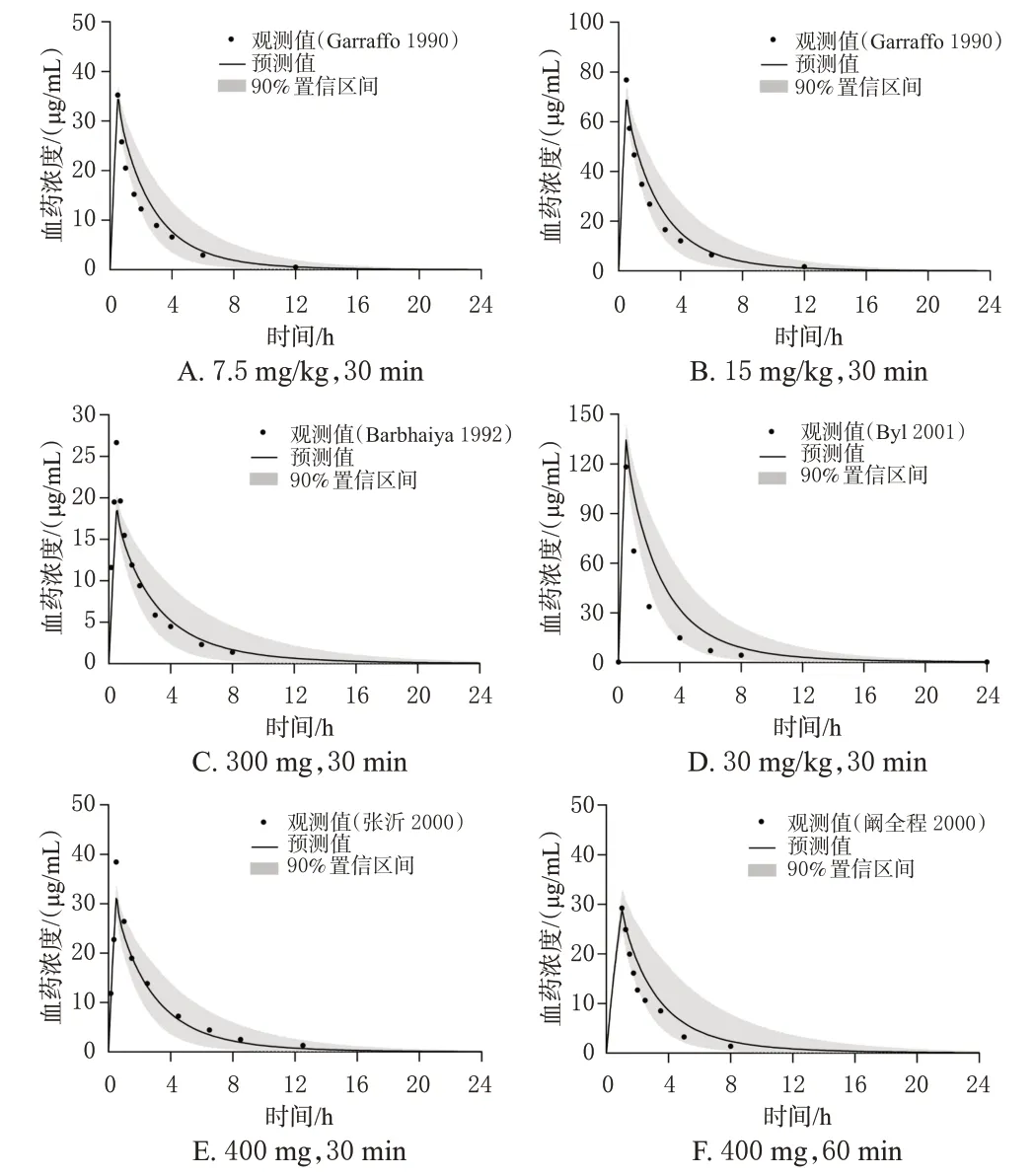
图2 成人静脉输注不同剂量阿米卡星后药时曲线观测值、预测值及预测值的90%置信区间
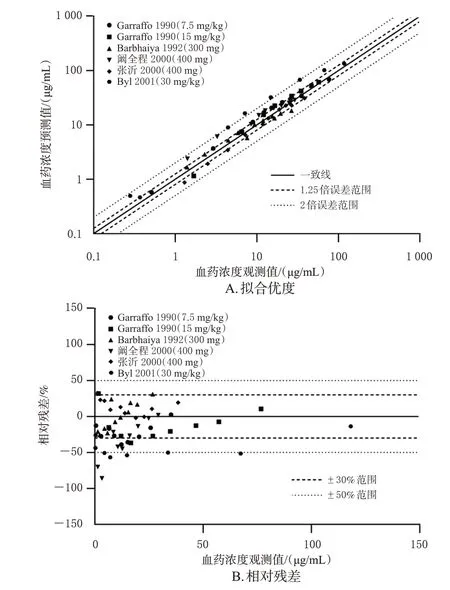
图3 成人PBPK模型验证中的拟合优度和相对残差
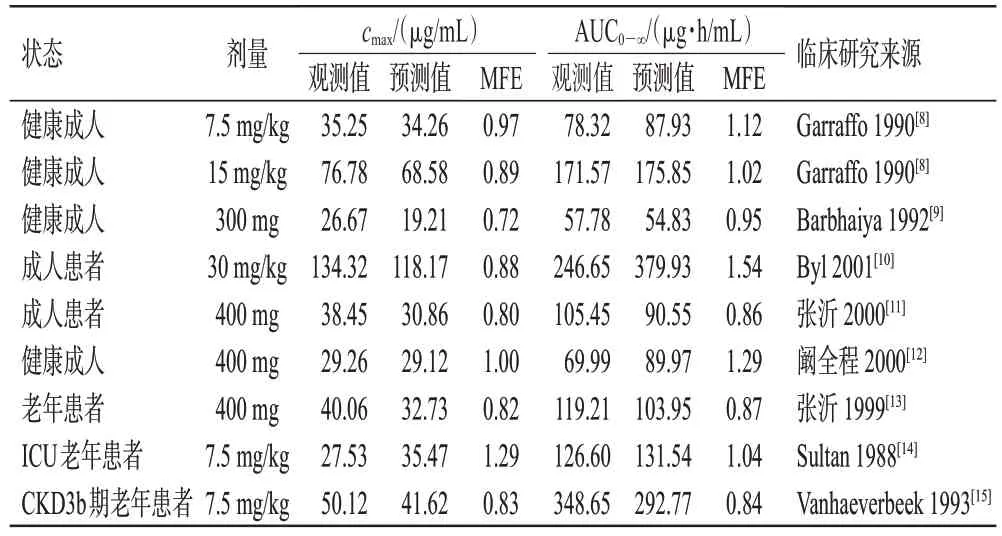
表3 PBPK模型验证中的药动学参数预测值与观测值
3.2 阿米卡星老年患者PBPK模型
在验证的成人PBPK 模型基础上,通过软件内置的年龄算法对解剖学和生理学参数进行调整,建立老年患者PBPK 模型并使用3 项老年患者临床药动学研究[13—15]进行验证(图4)。3 项模拟中cmax和AUC0-∞预测值与观测值比较的MFE 均在>0.5~<2 范围内(表3),说明模型外推至老年患者具有较好的适用性,能合理预测老年肾功能不全患者给药后的体内暴露。
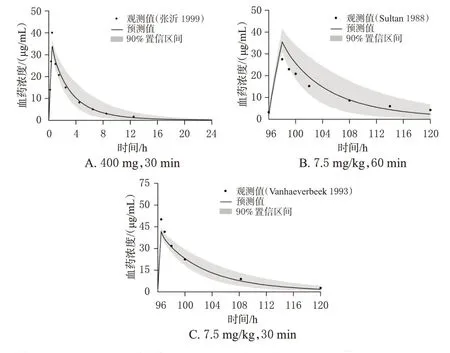
图4 老年肾功能不全患者静脉输注不同剂量阿米卡星后药时曲线观测值、预测值及预测值的90%置信区间
3.3 老年肾功能不全患者给药方案评价
每日给予不同剂量阿米卡星达稳态后,不同CKD分期老年患者的平均药时曲线显示,肾功能不全对稳态谷浓度的影响明显大于对cmax的影响。其中,当阿米卡星为标准剂量(15 mg/kg)时,CKD4期患者相较于CKD2期患者的cmax比值为1.12(P<0.000 1),稳态谷浓度比值为21.05(P<0.000 1)。结果见图5。
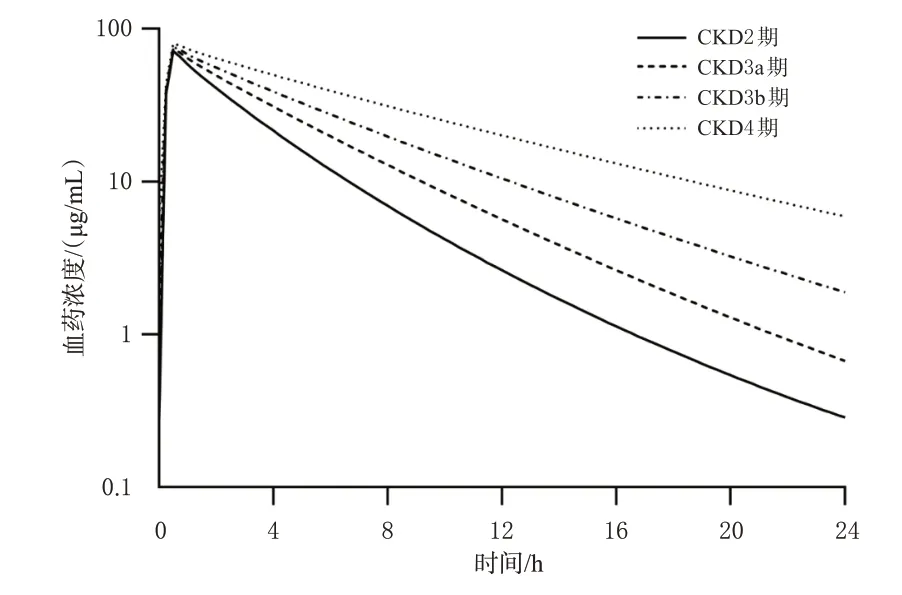
图5 老年不同程度肾功能不全患者静脉输注15 mg/kg阿米卡星后的平均药时曲线
各模拟情况下,不同CKD 分期老年患者稳态谷浓度<4 μg/mL 的PTA 见表4。由表4 可知,CKD2、CKD3a、CKD3b 期老年患者给药剂量为5~15 mg/kg时,可每24 h 给药1 次;CKD4 期老年患者给药剂量为7.5~15 mg/kg时,给药间隔应延长至36 h。当使用超过说明书剂量(≥20 mg/kg)时,CKD3b期老年患者的给药间隔需延长至36 h,CKD4期老年患者应延长至48 h。
老年CKD 患者在不同模拟情况下,cmax/MIC≥8 的PTA见表5。以铜绿假单胞菌为例,对于MIC≤2 μg/mL的敏感菌,阿米卡星5 mg/kg每24 h给药1次即可在所有人群中达到PTA≥90%。当MIC 增至4 μg/mL 时,GFR<45 mL/min 的患者可使用阿米卡星7.5 mg/kg,GFR≥45 mL/min的患者需使用10 mg/kg。当MIC增至8 μg/mL 时,GFR<45 mL/min 的患者可使用阿米卡星15 mg/kg,GFR≥45 mL/min 的患者需使用20 mg/kg(略超过说明书最大剂量)。当MIC增至16 μg/mL时(接近折点),所有模拟场合均无法达成cmax/MIC≥8。
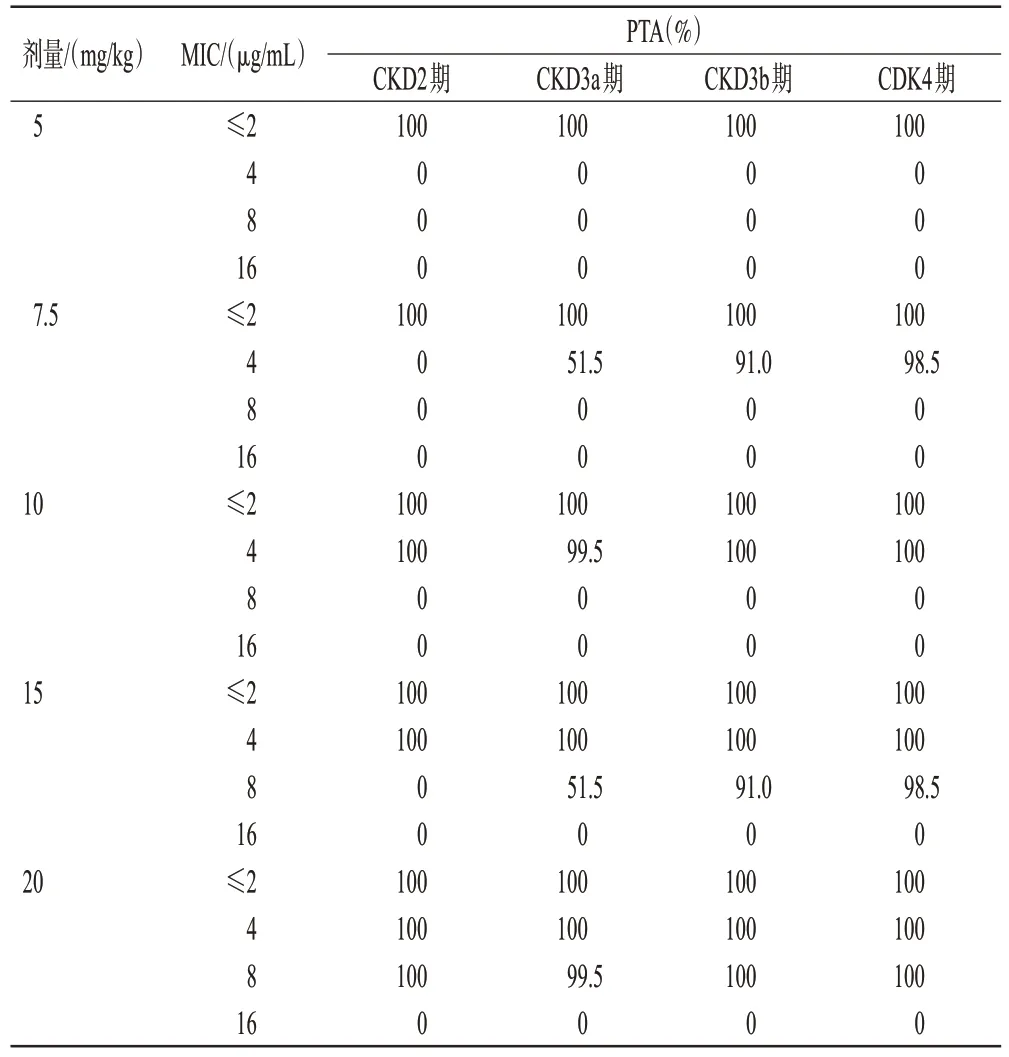
表5 阿米卡星各模拟情况下不同CKD 分期老年患者cmax/MIC≥8的PTA
综合以上结果,在有药敏试验结果作为依据时,推荐老年肾功能不全患者给药方案见表6。

表6 根据药敏试验结果推荐的老年肾功能不全患者阿米卡星的给药方案
4 讨论
约三分之二的老年人会出现不同程度的生理或病理性肾功能减退,这使得主要经肾排泄的药物在体内消除延长,而部分药物的肾毒性还可能使肾功能进一步受损,例如阿米卡星等氨基糖苷类抗菌药物。权衡利弊后,若老年患者必须使用阿米卡星,需在保证治疗效果的同时避免肾毒性发生。PBPK模型与模拟技术的发展为特殊人群精准用药提供了新的思路和工具,可根据已有临床研究数据对成人的药动学模型进行合理外推,在未进行研究或研究不充分的情况下获得特殊人群给药后的体内暴露情况,为其给药方案的制定提供了依据。
阿米卡星几乎不与血浆蛋白结合,可在肾小球处被动滤过,在肾小管处不发生主动分泌,但存在一定的重吸收。尽管以原型经肾排泄是阿米卡星的主要消除方式,但仍有一定比例通过非肾途径从体内消除[17]。该非肾消除机制尚不明确,但在老年肾功能不全患者中可观察到非肾消除比例增加[15]。若按照说明书中推荐的根据血肌酐水平进行剂量调整,将忽略非肾消除部分的影响,可能会低估肾功能不全患者的药物清除速率,导致调整后的药物体内暴露不足。因此,本研究采用肾小球滤过模型与非肾的全身清除模型相结合来描述阿米卡星的消除过程,同时利用尿药排泄数据对关键参数fGFR、CLnon-renal进行优化,较已发表的同类模型中采用固定清除率的方式更为合理[22]。本研究的不足之处在于,观察到部分验证中存在低估cmax预测值的倾向,这或许与未知的体内分布过程相关,有待进一步探讨。
本研究中,模拟的肾功能不全对阿米卡星稳态谷浓度的影响较为显著,而对cmax影响较小,这与以往研究结果相似[22]。在根据肾功能调整给药方案时,需首要考虑避免药物体内蓄积引发肾毒性。本研究结果显示,GFR>45 mL/min 的老年肾功能不全患者,在各模拟给药方案下,因谷浓度蓄积引起肾毒性的风险较低,与以往研究报道相似[23]。而对于CKD4 期老年患者,不削减每次给药剂量,延长给药间隔至36~48 h更有利于保持cmax/MIC≥8,且可避免谷浓度蓄积引起肾毒性的发生风险。老年人是ICU中的主要病患人群,受血管内皮功能紊乱、肾功能减退和大量输液等因素影响,ICU 老年患者常出现体液超载。阿米卡星cmax水平主要由表观分布容积(Vd)决定,由于阿米卡星具有极强的亲水性,ICU患者细胞外液增加可导致阿米卡星的Vd增加,引起cmax降低[24]。本研究在验证中同样发现,ICU 老年患者的血药浓度观测值低于对应的模拟预测值[14],预测值为观测值的1.29倍(表3)。一项针对阿米卡星在危重症患者中的药动学研究发现[25],即便在25 mg/kg 的高剂量下,仍有25%~33%的患者未能达到cmax/MIC≥8(cmax>60~64 μg/mL)。近年来,国际上关于阿米卡星中高剂量用于ICU患者和老年患者的报道不断增加[26]。出于对肾毒性的担忧,高于15 mg/kg 的给药方案在国内应用较少[27]。本研究前期对阿米卡星20~30 mg/kg 剂量范围进行了模拟。从安全性角度考虑,在应用阿米卡星超说明书剂量时,CKD3b 期患者可将给药间隔至少延长至36 h,CKD4 期患者至少延长至48 h。从有效性角度考虑,当ICU老年患者必须使用阿米卡星时,为避免Vd增加导致的暴露不足风险,本研究建议在表6推荐剂量的基础上加量25%~50%,以确保cmax/MIC≥8,然后再根据血药浓度监测进行个体化调整[26]。
综上,本研究较为完整地建立并验证了阿米卡星在老年肾功能不全患者中的PBPK 模型,可为经肾排泄药物PBPK模型的研究和应用提供思路。建立的PBPK模型经临床药动学数据验证,通过合理外推后实现了在老年肾功能不全患者体内的暴露情况模拟,并从有效性和安全性两方面对临床常见给药方案进行了评估和推荐,能够为阿米卡星在老年肾功能不全患者中的合理用药提供参考。
