阿托伐他汀对人胃癌AGS 细胞增殖、自噬和糖代谢的影响及机制 Δ
2023-10-09孙祥瑞崔晨玲汪庆飞蚌埠医学院第二附属医院药剂科安徽蚌埠33000蚌埠医学院第二附属医院肿瘤外科安徽蚌埠33000
孙祥瑞 ,崔晨玲 ,王 畏 ,汪庆飞 (.蚌埠医学院第二附属医院药剂科,安徽 蚌埠 33000;.蚌埠医学院第二附属医院肿瘤外科,安徽 蚌埠 33000)
胃癌是全世界范围内最常见的消化道恶性肿瘤之一。2022年全国最新癌症报告显示,胃癌在我国的发病率仅次于肺癌和结直肠癌,对我国人民的身心健康造成极大威胁[1]。胃癌的发生、发展是一个多阶段、多因素共同作用的结果,研究认为,抑制胃癌细胞的恶性生物学行为是胃癌外科治疗的重要基础[2]。糖酵解是肿瘤细胞能量供应的主要途径,可为肿瘤细胞提供增殖所需的能量及必需的氨基酸等合成原料,抑制糖酵解可阻滞胃癌细胞快速增殖及迁移[3]。自噬是细胞程序性死亡的一种类型,研究发现,促进胃癌细胞自噬可有效抑制胃癌的进展[4]。因此,寻找有效降低胃癌细胞糖酵解水平及促进胃癌细胞自噬的手段对抑制胃癌的发展尤为重要。
阿托伐他汀属于他汀类药物。Shen等[5]通过回顾性研究发现,阿托伐他汀可显著抑制子宫肌瘤的生长,但对胃癌细胞的影响尚不明确。磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(又称Akt)信号通路广泛存在于细胞中,是参与细胞生长、增殖与凋亡等生物学行为的重要信号通路,已被证实与胃癌的发生、发展密切相关[6]。现有研究发现,阿托伐他汀对脑胶质瘤细胞增殖抑制及凋亡促进的作用机制可能与PI3K/Akt信号通路相关[7]。但是阿托伐他汀是否可通过PI3K/Akt 信号通路来影响胃癌细胞的恶性生物学行为尚未可知。本研究探讨了阿托伐他汀对人胃癌AGS细胞增殖、自噬及糖代谢的影响,以及PI3K/Akt 信号通路在其中发挥的作用,以期为阿托伐他汀在胃癌治疗中的作用研究提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括BDS400型倒置荧光显微镜(北京赛百奥科技有限公司)、HWO301型CO2培养箱(美国Forma 公司)、MultiskanAscent 型酶标仪(美国Thermo Fisher Scientific 公司)、OI1000 型凝胶成像系统(广州光仪生物科技有限公司)、BBS-V500 型超净工作台(济南卓隆生物技术有限公司)等。
1.2 主要药品与试剂
阿托伐他汀对照品(批号B09A7R12611)、5-氟尿嘧啶对照品(批号M17GS148678)、PI3K/Akt 信号通路抑制剂LY294002(批号J05GS150604)、激活剂SC79(批号F08J11F115126)均购自上海源叶生物科技有限公司,纯度均不低于98%;胎牛血清(FBS)和F-12K 培养基均购自美国Gibco公司;1%青-链霉素、4%多聚甲醛、聚乙二醇辛基苯基醚(Triton X-100)、牛血清白蛋白(bovine serum albumin,BSA)、三羟甲基氨基甲烷-盐酸-吐温(TBST)均购自北京索莱宝生物科技公司;CCK-8 细胞计数试剂盒(批号C6205060)购自翌圣生物科技(上海)股份有限公司;葡萄糖含量检测试剂盒(批号012522220602)、5-乙炔基-2′脱氧尿嘧啶核苷(EdU)细胞增殖检测试剂盒(批号092321220429)均购自上海碧云天生物技术有限公司;乳酸含量检测试剂盒(批号ATVG20031)购自亚科因(武汉)生物技术有限公司;RIPA裂解液购自美国ABW公司;二喹啉甲酸(BCA)蛋白试剂盒(英国Abcam公司);兔源自噬相关蛋白轻链3Ⅰ(light chain 3Ⅰ,LC3Ⅰ)、LC3Ⅱ抗体(批号分别为00109445、00109011)及鼠源Akt、磷酸化Akt(p-Akt)、PI3K、磷酸化PI3K(p-PI3K)、β-肌动蛋白(β-actin)抗体、HRP 标记的山羊抗鼠IgG 二抗(批号分别为10022173、10022023、10017175、10010983、10021787、20000374)均购自武汉三鹰生物技术有限公司。
1.3 细胞株
人胃癌AGS细胞购自上海酶研生物科技有限公司。
2 方法
2.1 细胞培养
AGS细胞接种于含10% FBS、1%青-链霉素的F-12K培养基中,置于37 ℃、5% CO2培养箱中培养,每隔2~3 d更换一次培养液,待细胞贴壁后生长密度达到80%时传代,选取第4代对数期生长细胞用于实验。
2.2 分组与给药
选取第4 代对数期生长的AGS 细胞,调整密度至2×105个/mL,接种到96 孔板中,每孔100 μL。实验分为预实验和正式实验。预实验分为对照组和低、中、高浓度实验组;对照组不做干预,低、中、高浓度实验组分别加入12.5、25、50 μmol/L 阿托伐他汀[8],干预24 h。根据预实验结果,为避免细胞死亡过多影响实验,选择有显著抑制作用的25 μmol/L 阿托伐他汀(结果详见“3.1”)进行正式实验。正式实验分为对照组、阿托伐他汀组、阳性对照组、抑制剂组和激活剂组;对照组不做干预,阿托伐他汀组加入25 μmol/L阿托伐他汀,阳性对照组加入50 mg/L 5-氟尿嘧啶[9],抑制剂组加入25 μmol/L阿托伐他汀和10 μmol/L PI3K/Akt 信号通路抑制剂LY294002[10],激活剂组加入25 μmol/L 阿托伐他汀和10 μmol/L PI3K/Akt 信号通路激活剂SC79[11],干预24 h,每组设3个复孔。
2.3 测定指标
2.3.1 细胞活力检测
按“2.2”项下预实验分组、给药,另设只含生长培养基不含细胞的空白组,药物干预24 h 后,加入10 μL CCK-8溶液,2 h后,用酶标仪检测450 nm波长处各组的光密度(optical density,OD),每组检测3次,计算细胞活力:细胞活力=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
2.3.2 AGS细胞中糖代谢的检测
按“2.2”项下正式实验分组、给药,干预24 h后,收集细胞,反复冻融进行裂解,取裂解液于4 ℃下12 000×g离心10 min,收集上清液,分别按照葡萄糖和乳酸含量试剂盒说明书进行操作,测定细胞中葡萄糖和乳酸的含量。
2.3.3 AGS细胞的增殖能力检测
采用EdU 法进行检测。按“2.2”项下正式实验分组、给药,干预24 h 后,收集细胞,按照EdU 细胞增殖检测试剂盒说明书用EdU 标记细胞后,弃培养液,用甲醛固定15 min,用含3% BSA的磷酸盐缓冲液(下同)洗涤3次;用Triton X-100 通透10 min,再洗涤3 次;加入200 μL Click 反应液,室温避光孵育30 min,再洗涤3 次;每孔加入0.5 mL Hoechst,反应10 min,再洗涤3 次,装片。用荧光显微镜观察并拍照,使用Image J 1.8.1 软件处理图片,以EdU阳性染色细胞占总细胞的比例表示细胞增殖率。
2.3.4 AGS 细胞自噬及PI3K/Akt 信号通路相关蛋白表达的检测
采用蛋白免疫印迹法进行检测。按“2.2”项下正式实验分组、给药,干预24 h后,收集细胞,加入RIPA裂解液进行裂解,离心;取上清液,提取蛋白,定量后上样,以十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转膜;加入5%脱脂牛奶封闭2 h 后,加入一抗(LC3Ⅰ、LC3Ⅱ、PI3K、Akt、p-PI3K、p-Akt、β-actin 稀释比例分别为1∶ 2 000、1∶2 000、1∶5 000、1∶5 000、1∶1 000、1∶5 000、1∶10 000),4 ℃孵育过夜;用TBST洗涤3次后,加入二抗(稀释比例为1∶5 000),孵育2 h后弃液,用TBST洗涤3次,加显影液,用凝胶成像系统拍照。用Image J 1.8.1 软件进行分析,以目标蛋白与内参(β-actin)的灰度值比值为目标蛋白的表达水平,并以p-PI3K/PI3K、p-Akt/Akt 比值评价PI3K、Akt蛋白的磷酸化水平。试验重复3次。
2.4 统计学分析
3 结果
3.1 阿托伐他汀对AGS细胞活力的影响
对照组和低、中、高浓度实验组细胞活力分别为(100.00±4.91)%、(89.66±5.01)%、(50.16±4.82)%、(36.41±5.35)%(n=3)。与对照组相比,低浓度实验组细胞活力无明显变化,中、高浓度实验组细胞活力均显著降低(P<0.05)。
3.2 阿托伐他汀对AGS细胞糖代谢的影响
与对照组相比,阿托伐他汀组与阳性对照组细胞中葡萄糖和乳酸含量均显著降低(P<0.05);与阿托伐他汀组相比,抑制剂组细胞中葡萄糖和乳酸含量均显著降低(P<0.05),激活剂组细胞中葡萄糖和乳酸含量均显著升高(P<0.05)。结果见图1。
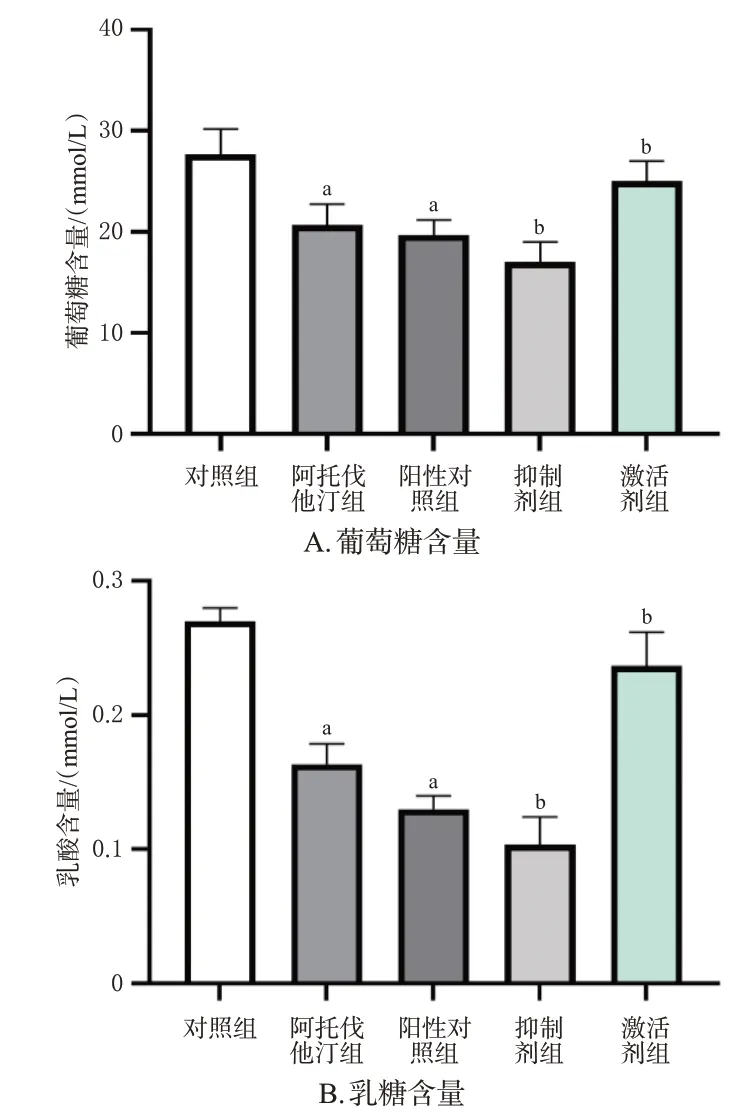
图1 阿托伐他汀对AGS细胞糖代谢的影响(n=3)
3.3 阿托伐他汀对AGS细胞增殖能力的影响
与对照组相比,阿托伐他汀组与阳性对照组细胞增殖率均显著降低(P<0.05);与阿托伐他汀组相比,抑制剂组细胞增殖率显著降低(P<0.05),激活剂组细胞增殖率显著升高(P<0.05)。结果见图2、图3。
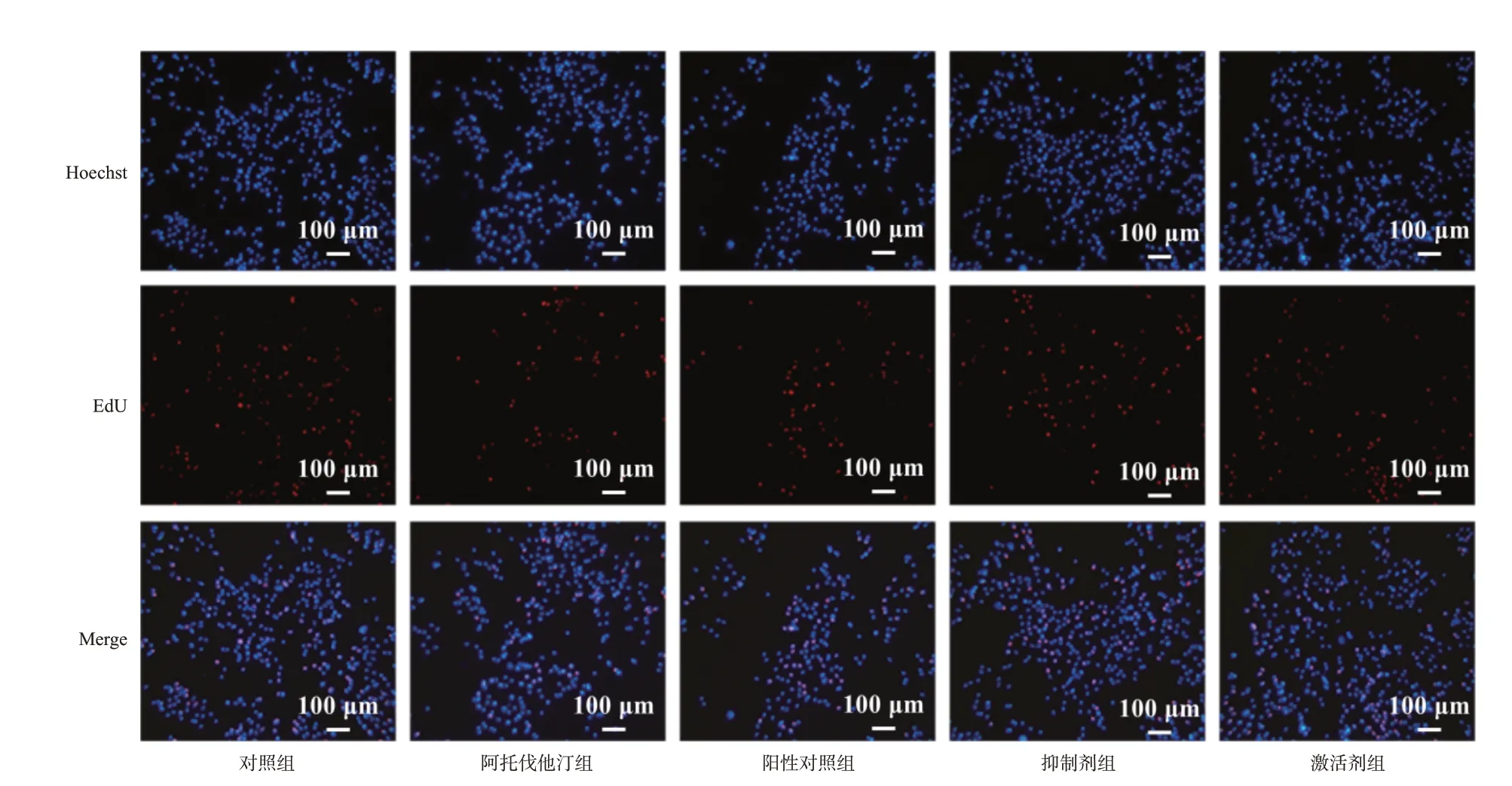
图2 阿托伐他汀对AGS细胞增殖能力影响的显微图(×10)

图3 阿托伐他汀对AGS 细胞增殖能力的影响(n=3)
3.4 阿托伐他汀对AGS 细胞中LC3Ⅰ、LC3Ⅱ蛋白表达的影响
与对照组相比,阿托伐他汀组和阳性对照组细胞中LC3Ⅰ、LC3Ⅱ蛋白表达水平均显著升高(P<0.05);与阿托伐他汀组相比,抑制剂组细胞中LC3Ⅰ、LC3Ⅱ蛋白表达水平均显著升高(P<0.05),激活剂组细胞中LC3Ⅰ、LC3Ⅱ蛋白表达水平均显著降低(P<0.05)。结果见图4。

图4 阿托伐他汀对AGS 细胞中LC3Ⅰ、LC3Ⅱ蛋白表达的影响
3.5 阿托伐他汀对AGS 细胞中PI3K/Akt 信号通路相关蛋白表达的影响
与对照组相比,阿托伐他汀组和阳性对照组细胞中p-PI3K/PI3K、p-Akt/Akt 比值均显著降低(P<0.05);与阿托伐他汀组相比,抑制剂组细胞中p-PI3K/PI3K、p-Akt/Akt 比值均显著降低(P<0.05),激活剂组细胞中p-PI3K/PI3K、p-Akt/Akt 比值均显著升高(P<0.05)。结果见图5。
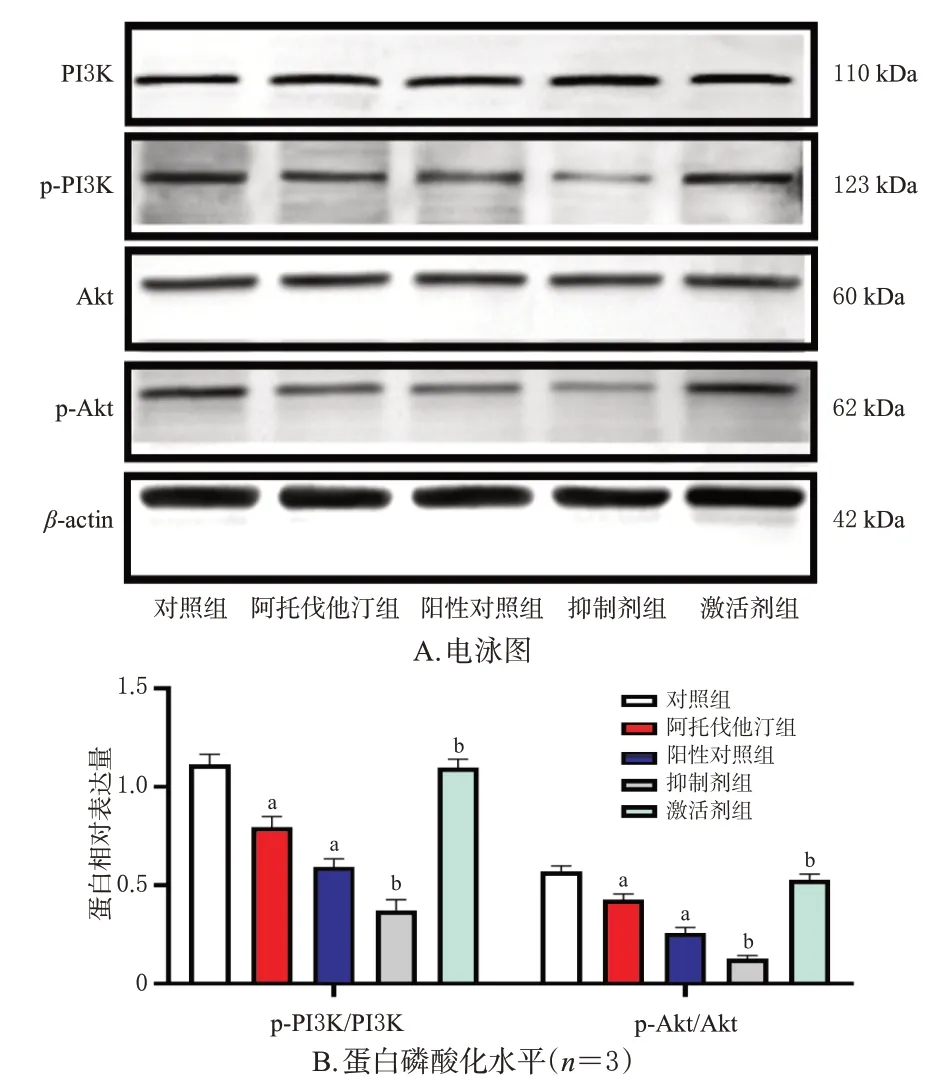
图5 阿托伐他汀对AGS 细胞中PI3K/Akt 信号通路相关蛋白表达的影响
4 讨论
胃癌是消化道常见的恶性肿瘤之一,国内外治疗胃癌的手段主要以手术为主,放化疗为辅,但多数胃癌患者就诊时已处于中晚期,无法接受根治性手术,而放化疗在治疗的同时也会对人体其他器官造成较大危害。因此,探寻有效的治疗药物一直是医学工作者研究的热点。阿托伐他汀是目前临床上应用最广泛的他汀类降脂药之一,其疗效稳定,临床证据充分[12]。近年来研究发现,阿托伐他汀可以抑制脑胶质瘤细胞和宫颈癌细胞的增殖[7,13]。本研究用不同浓度阿托伐他汀干预人胃癌AGS细胞的结果发现,加入25、50 μmol/L阿托伐他汀后细胞活力显著降低,提示25、50 μmol/L阿托伐他汀能有效抑制AGS细胞的活力,但为了避免细胞死亡过多而影响实验,本研究选择25 μmol/L 阿托伐他汀进行后续实验。
自噬是一种细胞自我降解的过程,可通过降解、回收未折叠及老化的蛋白质和细胞器,以维持细胞稳态,通常情况下肿瘤细胞的自噬较正常细胞降低[14]。有研究显示,阿托伐他汀可通过诱导抑制宫颈癌细胞自噬来抑制肿瘤进展[13]。本研究进一步考察了阿托伐他汀对AGS 细胞糖代谢、增殖和自噬的影响,结果发现,加入25 μmol/L 阿托伐他汀后,AGS 细胞中葡萄糖和乳酸含量、细胞增殖率均显著低于对照组,而LC3Ⅰ、LC3Ⅱ蛋白表达水平均显著高于对照组,提示阿托伐他汀可抑制AGS细胞的糖代谢和增殖,促进细胞自噬。
PI3K/Akt信号通路是经典的与肿瘤发生、发展密切相关的重要信号通路,随着对PI3K/Akt信号通路研究的不断深入,发现该通路参与并调控了胃癌的发展进程[15]。崔颖等[7]发现,阿托伐他汀通过上调miR-146a 来阻断PI3K/Akt信号通路,可抑制脑胶质瘤细胞的恶性行为并诱导其凋亡。本研究通过应用PI3K/Akt 信号通路抑制剂LY294002 和激动剂SC79 验证了阿托伐他汀抑制AGS细胞的糖代谢和增殖,促进细胞自噬与PI3K/Akt信号通路的关系,结果发现,LY294002能进一步加强阿托伐他汀对AGS 细胞糖代谢和增殖的抑制作用以及对自噬的促进作用,SC79 能逆转阿托伐他汀对AGS 细胞糖代谢、增殖及自噬的上述作用,提示阿托伐他汀抑制AGS细胞的糖代谢和增殖,促进细胞自噬的作用机制可能与抑制PI3K/Akt信号通路相关。
综上所述,阿托伐他汀可抑制人胃癌AGS细胞的糖代谢和增殖,促进细胞自噬,其作用机制可能与抑制PI3K/Akt信号通路相关。本研究的局限性为:仅在细胞水平初步探讨了阿托伐他汀对AGS 细胞的影响及作用机制,后续可进行体内试验验证,为胃癌的基础研究提供新的思路与参考。
