雷公藤甲素联合吉非替尼对EGFR突变NSCLC细胞的协同效应分析
2023-10-09咸宁市中心医院湖北科技学院附属第一医院呼吸与危重症医学科湖北咸宁437100湖北科技学院临床医学院医学实验实训中心湖北咸宁437100
张 艺 ,郭 芬 (1.咸宁市中心医院/湖北科技学院附属第一医院呼吸与危重症医学科,湖北 咸宁 437100;.湖北科技学院临床医学院医学实验实训中心,湖北 咸宁 437100)
肺癌是癌症致死的首要原因,其中约85%的肺癌为非小细胞肺癌(non-small cell lung cancer,NSCLC),严重影响人类健康[1]。近年来,表皮生长因子受体(epidermal growth factor receptor,EGFR)编码基因分型的鉴定和EGFR 酪氨酸激酶抑制剂(EGFR tyrosine kinase inhibitors,EGFR-TKIs)靶向药物的发展,极大地改变了EGFR基因突变晚期NSCLC患者的治疗结局[2]。然而,几乎所有的EGFR基因突变阳性患者都会在治疗1 年内对EGFR-TKIs 产生获得性耐药[3],故探寻能够预防或克服EGFR-TKIs 耐药的治疗方案成为该领域的主要研究方向。
近期研究证实,某些天然药物成分可通过不同的信号通路来推迟或阻止EGFR-TKIs耐药的发生[4]。雷公藤甲素(triptolide,TPL)是从中药雷公藤中提取分离的一种二萜类化合物,具有显著的抗肿瘤活性,且在逆转化疗药物耐药方面具有一定潜力[5—6],然而其具体机制尚不清楚。既往有研究证实,TPL可调节多种生物学过程关键蛋白的表达,且与磷脂酰肌醇3-激酶(phosphatidylinositol 3 kinase,PI3K)/蛋白激酶B(protein kinase B,又称Akt)通路的关系尤其密切[7];同时,PI3K/Akt通路与EGFR-TKIs 耐药的发生密切相关[8]。为此,本课题组基于PI3K/Akt 通路,以耐药细胞为对象,初步探索TPL 对第一代EGFR-TKIs 吉非替尼获得性耐药的抑制作用及潜在机制,旨在为进一步阐明TPL 的药理作用提供参考,亦为预防或逆转EGFR-TKIs 耐药提供候选治疗策略。
1 材料
1.1 主要仪器
本研究所用主要仪器包括BD Accuri C6 型流式细胞仪(美国BD Biosciences 公司)、XBQ-2H 型细胞培养仪(上海佐研仪器科技有限公司)、LD-96A型酶标仪(山东莱恩德智能科技有限公司)等。
1.2 主要药品与试剂
TPL对照品(批号111567-202005,纯度≥98%)购自中国食品药品检定研究院;吉非替尼片(批号211102,规格0.25 g)购自日本Kagamiishi Plant,Nipro Pharma Corporation。TPL 对照品和吉非替尼片均保存于二甲基亚砜(DMSO)中(最终质量浓度均为100 μg/mL),临用前以无血清培养基稀释至相应质量浓度。
RPMI 1640 培养基购自美国Gibco 公司;核糖核酸酶Ⅰ购自美国Sigma-Aldrich 公司;碘化丙啶(propidium iodide,PI)试剂购自北京百奥莱博科技有限公司;MTT试剂(批号c7062)购自北京博奥森生物技术有限公司;兔源PI3K p85α 单克隆抗体(批号ab191606)、兔源Akt3+Akt2+Akt1 重组单克隆抗体(批号ab32505)、小鼠源哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)单克隆抗体(批号ab87540)、兔源微管相关蛋白1 轻链3α(microtubule-associated protein 1 light chain 3α,MAP1LC3A)单克隆抗体(批号ab52768)、兔源MAP1LC3B 多克隆抗体(批号ab51520)、Alexa Fluor®488 标记的山羊抗兔IgG 二抗(批号ab150077)、Alexa Fluor®488 标记的山羊抗鼠IgG 二抗(批号ab96879)均购自英国Abcam公司。
1.3 实验细胞
人EGFR 低敏感性NSCLC 细胞系H1975(即EGFRT790M/L858R 突变的耐药细胞系)和高敏感性NSCLC细胞系H1299(即EGFR野生型的非耐药细胞系)均购自日本Riken细胞库。
2 方法
2.1 细胞培养
将H1299 和H1975 细胞置于含有10%胎牛血清、L-谷氨酰胺(2 mmol/L)、1%青霉素-链霉素双抗和25 mmol/L HEPES 缓冲液的RPMI 1640 培养基中,在37 ℃、5% CO2条件下培养。待细胞生长融合度达90%时,用0.25%胰酶消化并按照1∶3的比例传代继续培养,取传至第2代的细胞进行后续实验。
2.2 TPL、吉非替尼单用及两药联合对2种细胞敏感性影响的检测
待H1299和H1975细胞铺满培养皿60%左右时,取生长良好的细胞以2.5×105个/孔接种于6 孔板中,在37 ℃、5% CO2条件下培养(培养条件下同)。待细胞完全贴壁后,分为空白组(仅含细胞和培养液)、不同浓度TPL组(1、5、10、15、20、25、30 nmol/L,参考相关文献[6]和预实验结果设置)、不同浓度吉非替尼组(1、2、4、8、12、16、20 µmol/L,参考相关文献[7]和预实验结果设置)、不同浓度TPL+吉非替尼组(5 nmol/L TPL 分别联合2、5、10、20 µmol/L 吉非替尼,10 nmol/L TPL 分别联合2、5、10、20 µmol/L吉非替尼,参考前期MTT筛选结果设置),每组设6个复孔。弃去培养液,各药物组加入相应药液,空白组不作处理。培养24、48、72 h 后,收集各组细胞,加入5 mg/mL MTT 试剂20 μL,在37 ℃下孵育4 h,使用酶标仪于490 nm 波长处检测各孔的光密度(optical density,OD)值并计算细胞存活率:细胞存活率(%)=药物组OD值/空白组OD值×100%。计算吉非替尼(作用24、48、72 h)的半数抑制浓度(IC50)和吉非替尼单用及两药联用(作用48 h)的药物敏感度指数(sensitivity index,SI):SI=ΔX/ΔY(式中,ΔX是细胞存活数,ΔY是正常细胞总数)。若SI=1.0,表示细胞对药物的敏感性不明显;SI>1.0,表示细胞对药物的敏感性较高;SI<1.0,表示细胞对药物的敏感性较低[9]。采用中位药效法(Chou-Talalay法)计算TPL联合吉非替尼作用48 h的联合用药指数(combination index,CI):CI=d1/D1+d2/D2(式中,d1和d2分别为联合用药时吉非替尼和TPL的浓度;D1和D2分别为产生与联合用药相等效应时吉非替尼和TPL 单用的浓度)。CI>1为两药拮抗,CI=1为两药相加,CI<1 为两药协同[6];以受影响的细胞比例(Fa)为横坐标、CI为纵坐标绘制散点图,若Fa 为0.2~0.8 则表示药物有效[7]。
2.3 TPL 联合吉非替尼对H1975 细胞凋亡及周期分布影响的检测
取生长良好的H1975 细胞以2×105个/孔接种于6孔板中,培养,待细胞贴壁后,分为空白组(仅含细胞和培养液),低、高浓度TPL 组(5、15 nmol/L,参考“2.2”项下结果设置),吉非替尼组(2 μmol/L,参考“2.2”项下结果设置),低浓度TPL+吉非替尼组、高浓度TPL+吉非替尼组(5 nmol/L TPL+2 μmol/L 吉非替尼,15 nmol/L TPL+2 μmol/L 吉非替尼,参考“2.2”项下结果设置),每组设6个复孔。弃去培养液,各药物组加入相应药液,空白组不作处理。培养24、48 h后,收集各组细胞,并固定于冷的75%乙醇中,随后用含200 mmol/L Na2PO4和0.1% Triton X-100 试剂的DNA 缓冲液处理,再以含200 μg/mL核糖核酸酶Ⅰ的PI试剂染色,使用流式细胞仪检测各组细胞的凋亡率及周期分布情况。
2.4 TPL与EGFR分子对接分析
从PDB 蛋白质数据库(https://www.rcsb.org/)加载EGFRT790M/L858R 突变型及野生型编码产物的晶体结构,去除水分子后,基于AMBER99 力场对其进行质子化处理;利用MMFF94s 力场优化TPL 的分子结构。利用MOE 分子对接软件模拟TPL 和EGFR 的结合位点。基于结合对接能量对TPL 的所有结合位点进行排序,并选择能量最低的构象进行结合模式展示。
2.5 TPL 联合吉非替尼对H1975 细胞PI3K/Akt/mTOR通路及自噬相关蛋白表达影响的检测
采用流式细胞术检测。取生长良好的H1975 细胞以2×105个/孔接种于6孔板中,培养,待细胞贴壁后,按“2.3”项下方法分组、干预。培养24、48 h后,收集各组细胞,分别用核因子固定液和渗透缓冲液固定和渗透,然后加入PI3K、Akt、mTOR、MAP1LC3A、MAP1LC3B 一抗(稀释比例均为1∶2 000),4 ℃孵育过夜;再加入相应二抗(稀释比例均为1∶1 000),孵育1 h。使用酶标仪检测并使用FlowJo V10 软件分析目的蛋白的荧光强度以表示其表达水平。
2.6 统计学方法
3 结果
3.1 TPL、吉非替尼单用及两药联合对2种细胞敏感性的影响
随着浓度的增加和时间的延长,TPL、吉非替尼对H1975 和H1299 细胞增殖的抑制作用逐渐增强,且具有浓度、时间依赖趋势(图1A、1B)。作用24、48、78 h 时,吉非替尼对H1975 细胞的IC50分别为15.10、11.67、7.31 μmol/L,对H1299 细胞的IC50分别为15.78、12.75、9.48 μmol/L。作用48 h 时,吉非替尼对H1975 细胞的SI 为0.73;与5 或15 nmol/L 的TPL 联用后,SI 分别升至1.88、2.30,提示联用后药物对H1975细胞的敏感性有所增加;此外,两药联合作用48 h 对H1975 细胞的CI 均小于1(Fa 约为0.5),提示两药联合对H1975 细胞的增殖具有协同抑制效应。但两药联用对H1299 细胞的CI 均大于1(Fa多低于0.2),提示两药联合对H1299细胞的增殖并无上述协同抑制效应(图1C、图1D)。

图1 TPL、吉非替尼单用及两药联用对2种细胞敏感性的影响(±s,n=6)
3.2 TPL 联合吉非替尼对H1975 细胞凋亡及周期分布的影响
H1975细胞培养24 h或48 h时,各药物组细胞的凋亡率均较空白组显著升高(P<0.05)。同时,与空白组比较,各药物组G0/G1期细胞的比例均显著升高,S期、G2/M期(仅高浓度TPL组作用48 h和联用组)细胞的比例均显著降低,且高浓度TPL组细胞的凋亡率及周期变化普遍较吉非替尼组,联用组较吉非替尼、TPL单用组,高浓度联用组较低浓度联用组更明显(P<0.05)。结果见表1。
表1 TPL联合吉非替尼对H1975细胞凋亡率及周期分布的影响(±s,n=6,%)
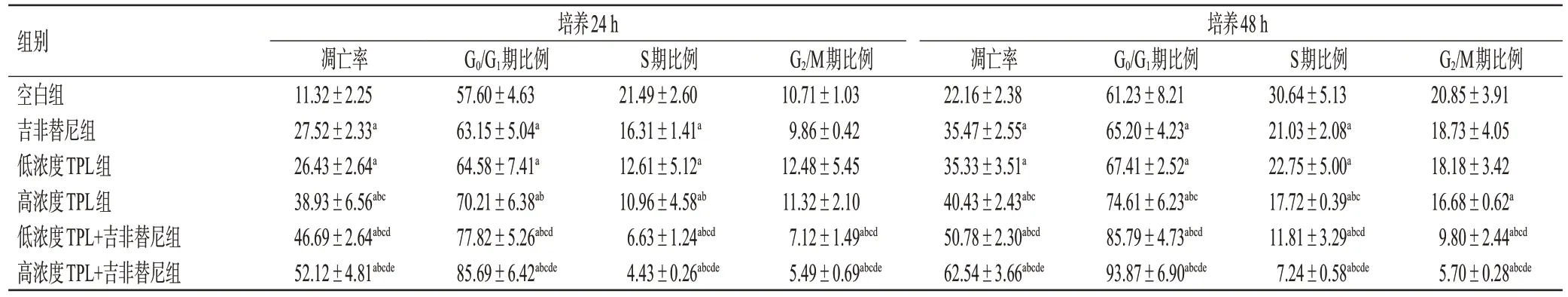
表1 TPL联合吉非替尼对H1975细胞凋亡率及周期分布的影响(±s,n=6,%)
a:与空白组比较,P<0.05;b:与吉非替尼组比较,P<0.05;c:与低浓度TPL组比较,P<0.05;d:与高浓度TPL组比较,P<0.05;e:与低浓度TPL+吉非替尼组比较,P<0.05。
组别空白组吉非替尼组低浓度TPL组高浓度TPL组低浓度TPL+吉非替尼组高浓度TPL+吉非替尼组培养24 h凋亡率11.32±2.25 27.52±2.33a 26.43±2.64a 38.93±6.56abc 46.69±2.64abcd 52.12±4.81abcde G0/G1期比例57.60±4.63 63.15±5.04a 64.58±7.41a 70.21±6.38ab 77.82±5.26abcd 85.69±6.42abcde S期比例21.49±2.60 16.31±1.41a 12.61±5.12a 10.96±4.58ab 6.63±1.24abcd 4.43±0.26abcde G2/M期比例10.71±1.03 9.86±0.42 12.48±5.45 11.32±2.10 7.12±1.49abcd 5.49±0.69abcde培养48 h凋亡率22.16±2.38 35.47±2.55a 35.33±3.51a 40.43±2.43abc 50.78±2.30abcd 62.54±3.66abcde G0/G1期比例61.23±8.21 65.20±4.23a 67.41±2.52a 74.61±6.23abc 85.79±4.73abcd 93.87±6.90abcde S期比例30.64±5.13 21.03±2.08a 22.75±5.00a 17.72±0.39abc 11.81±3.29abcd 7.24±0.58abcde G2/M期比例20.85±3.91 18.73±4.05 18.18±3.42 16.68±0.62a 9.80±2.44abcd 5.70±0.28abcde
3.3 TPL与EGFR分子对接分析
TPL 的羟基可与EGFRT790M/L858R 突变编码产物的Thr854 残基形成氢键,结合对接能量为-6.504 kcal/mol(1 kcal=4.19 kJ);而TPL 与EGFR野生型编码产物之间没有氢键,结合对接能量为-4.460 kcal/mol。结果见图2。
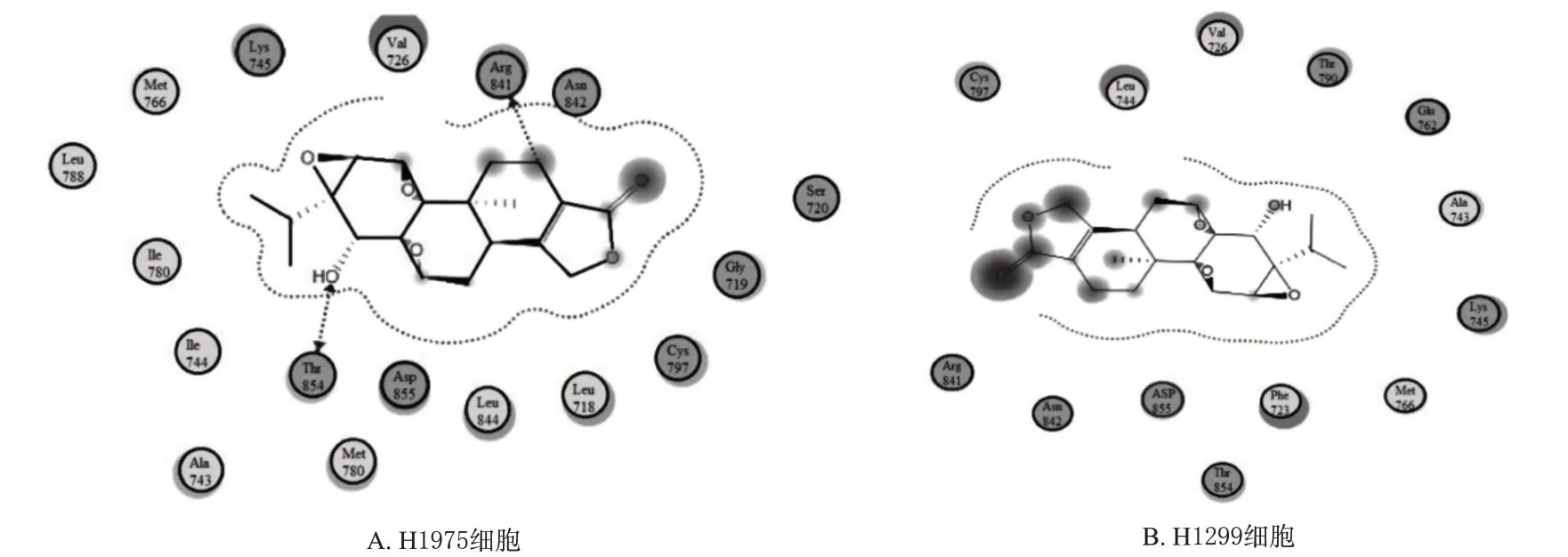
图2 TPL与EGFR T790M/L858R突变和EGFR野生型编码产物结合的二维模型
3.4 TPL 联合吉非替尼对H1975 细胞PI3K/Akt/mTOR通路及自噬相关蛋白表达的影响
与空白组比较,各药物组培养24、48 h 时通路相关蛋白PI3K、Akt、mTOR 的表达均显著下调,而自噬相关蛋白MAP1LC3A、MAP1LC3B的表达均显著上调,且高浓度TPL组上述指标的变化均较吉非替尼组,联用组较吉非替尼、TPL 单用组,高浓度联用组较低浓度联用组更明显(P<0.05),结果见图3。
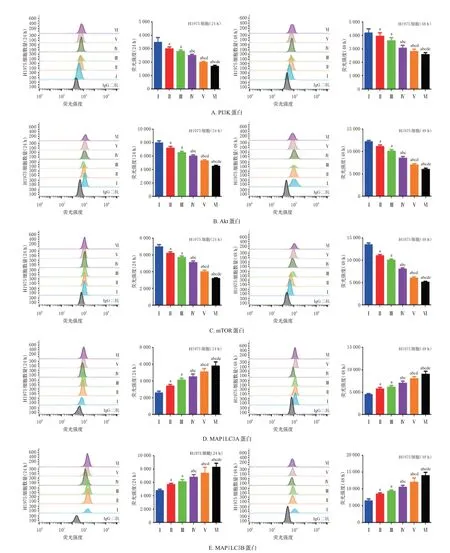
图3 TPL联合吉非替尼对H1975细胞PI3K/Akt/mTOR通路和自噬相关蛋白表达的影响(±s,n=6)
4 讨论
吉非替尼是第一代EGFR-TKIs,可通过竞争性结合EGFR 结构域中的腺苷三磷酸(adenosine triphosphate,ATP)位点而阻止酪氨酸磷酸化,阻断EGFR所介导的信号通路持续激活,从而发挥抗肿瘤作用,该药被广泛用于EGFR基因突变阳性NSCLC 患者的一线治疗[1,7—8]。然而临床实践显示,多数患者用药后不久便会发生EGFR-TKIs耐药,从而导致治疗失败[10—11]。
TPL 是一种具有强烈细胞毒性的环氧二萜内酯化合物,对乳腺癌、前列腺癌、肺癌等肿瘤细胞均有显著的抑制作用,还可增强5-氟尿嘧啶、顺铂、阿霉素等化疗药物的抗肿瘤作用,从而提高化疗药物的治疗效果[6,12]。本研究发现,不同浓度的TPL对H1975、H1299细胞的增殖有一定的抑制作用,且有时间和浓度依赖趋势。
药物相互作用评价在医药学各个领域都具有重要的价值,特别是在需联合用药的恶性肿瘤化疗领域,其中CI分析是评估化疗药物相互作用的常用指标之一,当Fa 值为0.2~0.8、CI<1 则表示联用药物具有协同效应[6—7,13]。本研究结果显示,不同浓度的TPL联合吉非替尼可对H1975细胞的增殖产生协同抑制效应(Fa约0.5,CI<1);而两药联合对H1299 细胞几乎没有上述效应(Fa 多低于0.2,CI>1),同时反映药物敏感度的SI 也从单用的0.73升至联用的1.88、2.30,可能是因为H1299细胞为吉非替尼敏感细胞,而H1975 细胞因存在EGFRT790M/L858R突变而对吉非替尼不敏感,TPL联合吉非替尼增加了耐药细胞的敏感性,提示TPL有逆转吉非替尼耐药的潜力。此外,细胞凋亡和细胞周期检测结果同样显示,TPL联合吉非替尼可明显诱导H1975细胞凋亡并将其阻滞于G0/G1期。这些结果均证实了TPL联合吉非替尼可发挥显著的抗肿瘤作用,能更有效地抑制肿瘤细胞的生长,诱导其凋亡并阻滞细胞周期。
本研究进行的计算机模拟分子对接发现,与EGFR野生型编码产物相比,TPL与EGFRT790M/L858R突变型编码产物的结合更稳定,进一步佐证了TPL 联合吉非替尼的协同抑制作用。有研究表明,TPL 可通过氢键与EGFR 结构域中的ATP 结合,结合自由能为-5.69 kcal/mol,且结合是稳定的[14]。本研究结果与上述研究基本一致,提示化合物的结构特征决定了其与EGFR的亲和力,这可能也是影响联用药物协同效应的重要原因。
由于细胞对药物的敏感性涉及多种因子和途径的复杂交替过程,因此揭示联合靶向治疗的特定分子途径是一项具有挑战性的工作。PI3K/Akt 途径是EGFR 下游的一条重要信号通路,EGFR 磷酸化激活后可形成Shc-Grb2-SOS1 复合物,从而激活PI3K,激活的PI3K 可催化磷脂酰肌醇-3,4,5-三磷酸的生成并进一步促进Akt激活,从而抑制肿瘤细胞凋亡并促进其生长[15—16]。本研究结果显示,吉非替尼、TPL 单用和两者联用均可下调PI3K、Akt 蛋白的表达,且两者联用的效果优于吉非替尼、TPL单用。这提示PI3K/Akt通路可能是TPL的潜在作用靶点之一,TPL 联合吉非替尼具有协同增效的效果。
现代医学研究表明,自噬与化疗敏感性的关系较为复杂,其中MAP1LC3A、MAP1LC3B等蛋白是MAP1LC3/LC3 自噬家族成员,可反映细胞的自噬水平[17]。有研究指出,mTOR 通路与自噬有关,抑制mTOR 通路可部分激活细胞自噬[18];同时,作为PI3K/Akt 通路下游的重要调控因子,mTOR可促使肿瘤细胞对化疗/靶向药物产生耐药性[19]。考虑到诱导自噬与EGFR-TKIs 耐药有关[20],本研究检测了MAP1LC3A、MAP1LC3B、mTOR 蛋白的表达情况。结果显示,吉非替尼、TPL 单用和两者联用均可显著上调细胞中MAP1LC3A、MAP1LC3B的表达,下调mTOR蛋白的表达,且两者联用的效果优于吉非替尼、TPL 单用。这提示H1975 细胞的自噬得以增多,其对药物的敏感性有所提高;同时,PI3K/Akt/mTOR 通路可能是TPL作用的另一潜在靶点。
综上所述,TPL 联合吉非替尼可对EGFRT790M/L858R 突变NSCLC 细胞产生协同抑制作用,其作用可能与下调PI3K/Akt/mTOR 通路和诱导细胞自噬有关。这一结论为TPL的增效作用提供了潜在的研究方向,但仍需后续动物实验予以验证。
