基于气相色谱-质谱技术颌面部间隙感染细菌类型快速诊断方法的建立
2023-10-08吴巍炜张广健宁芮之张言鹏赵瑞华李云鹏延安大学生命科学学院微生物教研室陕西延安76099口颌系统重建与再生全国重点实验室国家口腔疾病临床医学研究中心陕西省口腔疾病临床医学研究中心空军军医大学口腔医院颌面外科陕西西安700西安电子科技大学先进材料与纳米科技学院前沿交叉研究院陕西西安706西安交通大学第一附属医院胸外科陕西西安7006
任 睿,孔 亮,吴巍炜,张广健,姜 雪,宁芮之,张言鹏,赵瑞华,李云鹏(延安大学生命科学学院微生物教研室,陕西 延安 76099;口颌系统重建与再生全国重点实验室,国家口腔疾病临床医学研究中心,陕西省口腔疾病临床医学研究中心,空军军医大学口腔医院颌面外科,陕西 西安 700;西安电子科技大学:先进材料与纳米科技学院,前沿交叉研究院,陕西 西安 706;西安交通大学第一附属医院胸外科,陕西 西安 7006)
颌面部间隙感染(oral and maxillofacial space infections,OMSI)是发生于颜面、颌周、口咽部潜在筋膜的化脓性炎症,也是口腔颌面外科最常见的急重症疾病类型。通常牙源性感染为主要病因,即由于龋齿、牙周炎、智齿冠周炎等未经及时正规治疗,逐渐发展至周围组织引起。而战争时期,创伤后感染为其主要病因,即由于战场环境恶劣,伤口及其周围皮肤污染严重,泥沙、草屑、木屑、碎布屑、血液、污垢等混杂在一起,外加环境中的条件致病细菌可随着皮肤屏障受损入侵人体,如果不能及时清创,可能会导致严重的创伤后感染[1-2]。一旦出现OMSI,需要及时、系统、规范和有效的治疗,否则感染极易扩散,引起严重的并发症。例如组织肿胀压迫气道引起窒息,或向下发展成为纵膈感染,如菌血症、败血症、脓毒血症等引起多器官衰竭,危及患者生命[3-4]。
依据感染细菌类型针对性使用抗菌药物是OMSI治疗的主要手段。在现有的治疗体系中,对于细菌类型的判断,主要依赖于传统的“脓液培养+药敏试验”。该方法检测一般需要3~7 d[5],在此期间治疗主要依赖于“经验用药”。这也导致某些患者治疗效果差,耐药菌出现率高。传统方法同样不适用于快节奏的战时条件。因此急需寻求一种快速诊断感染细菌类型,指导抗菌药物使用的新方法。
气相色谱-质谱(gaschromatography-mass spectrometry,GC-MS)是一种结合气相色谱和质谱的特性,鉴别出样本中各种挥发物成分的方法。GC-MS作为一种高灵敏度和高通量的分析平台,已被证明是在各种应用中进行初级代谢研究的有用工具[6]。通过鼓泡或者顶空的方法检测样本产生的挥发性有机化合物(volatile organic compounds,VOCs)的类型和峰面积,进一步分析得出样本的特异性化合物,并将其作为鉴定细菌类型的靶标物质。该检测方法耗时短、准确率较高、对设备依赖性低,为实现颌面部OMSI细菌类型的快速诊断提供了可能。
本实验拟选取OMSI中最常见的细菌类型[7]金黄色葡萄球菌(Staphylococcusaureus,SA)作为研究对象,对其所产生的特异性靶标化合物(bacterial volatile organic compounds,bVOCs)进行分析,建立SA的特异性挥发物谱库;收集临床OMSI患者的脓液,通过GC-MS技术分析其临床样本特异性靶标化合物(patient volatile organic compounds,pVOCs);通过对bVOCs和pVOCs做一致性分析,结合传统脓液培养法结果,以评估GC-MS技术进行快速诊断OMSI细菌类型的可能性(图1)。
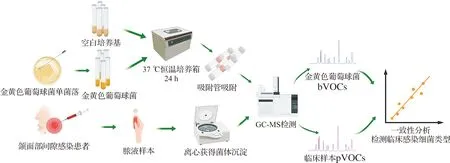
图1 金黄色葡萄球菌与临床样本检测流程图
1 材料与方法
1.1 材料
SA标准菌株(BNCC186053)购自北纳生物河南省工业微生物菌种工程技术研究中心;营养肉汤培养基(HB0108-4)、琼脂粉购自青岛海博生物技术有限公司;GC-MS联用仪(机体型号GCMS-QP2020,热脱附型号TD-30)、Tenax吸附管(外径6.35 mm,2,6-二苯呋喃多孔聚合物组成,吸附材料质量130 mg)购自日本Shimadzu公司;Rtx-ms色谱柱(30 m×0.25 mm×0.25 μm)购自日本岛津公司。
1.2 方法
1.2.1 SA标准菌株的制备 吸取0.2 mL菌悬液打入平板中,涂布均匀;将平板置于37 ℃培养24 h获得SA的单菌落。用接种针挑取SA的单菌落接种于5 mL的营养肉汤培养基中,37 ℃、120 r/min的摇床培养24 h,重复获得多个SA菌悬液。
1.2.2 细菌培养顶空取样 取上述制备的单一培养菌液体400 μL,加入含有20 mL营养肉汤培养液的细菌培养瓶中,将密封的细菌培养瓶放置于37 ℃恒温培养箱培育24 h,记录A450 nm值,并计算菌体数量Y=8.410 6X-0.272 6(Y为菌体量,X为A450 nm值)[8]。用干燥氮气以200 mL/min吹扫,培养瓶顶气体被捕获到tenax吸附管上,吹扫时间10 min。空白样品除培养菌液改为营养肉汤培养液之外,其他步骤同上。获得50个SA测试样品(1-1、1-2……1-50),9个空白对照(nutrient broth,NB)样本(2-1、2-2……2-9)。
1.2.3 临床样品的制备 临床随机纳入4例OMSI患者,在手术过程中抽取脓液,将脓液以1 000 r/min离心5 min去除细胞等固体沉淀,保留上清。随后10 000 r/min离心5 min获得脓液中的菌体沉淀,重悬菌体进行显微镜计数。获得的菌体直接上机检测,一部分脓液送常规菌培养检验。
1.2.4 GC-MS检测参数 tenax吸附管解析温度260 ℃,解析时间5 min,解析流量30 mL/min,冷阱温度-20 ℃,接口温度250 ℃,阀温度250 ℃,传输线温度250 ℃。载气为高纯(纯度大于99.999%)氦气,采用不分流进样模式,保持线速度36.1 m/s,色谱柱流速1 mL/min,吹扫流量3 mL/min。梯度升温程序为40 ℃恒温2 min,5 ℃/min升温到140 ℃,再10 ℃/min升温到270 ℃恒温2 min。质谱条件为电子碰撞源温度200 ℃,溶剂延迟时间为1.5 min,扫描模式为scan,扫描速度为1 666 aum/s,扫描范围为45~500 aum。
1.2.5 SA特异性靶标物的选择 对GC-MS原始数据采用MS-DIAL软件进行峰提取、峰对齐、反卷积分析,进一步处理导出化合物及峰面积数据。采用单变量和多变量结合的方式对数据进行分析,Mann-WhineyU检验计算单变量显著性差异,得到P值,校正后获得错误发现率(false discovery rate,FDR),以FDR和变化倍数(fold change,FC)做SA的VOCs以及NB的VOCs火山图,快速直观地识别变化幅度较大且具有统计学意义的代谢物。将归一化数据进行多维统计分析-正交过滤偏最小二乘方-判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)的多变量分析方法,获得SA与NB的差异化合物变量投影重要性(variable importance in projection,VIP)排序,VIP值>1为两者的差异代谢物,VIP值越大的化合物在两者中差异越大。用FDR<0.05和VIP值以及峰面积的三重标准来筛选SA的特异生物标志物[9],得到SA的bVOCs。
1.2.6 基于SA的临床样本匹配度评估 根据VIP值、FDR值和峰面积选择18种化合物作为SA的bVOCs。依据标准菌和临床感染细菌数量之比,按比例获得临床样本的pVOCs类型及峰面积具体数据。将临床样本菌体所得到的pVOCs与SA的bVOCs进行对比,阈值设置为在bVOCs与pVOCs类型一致的情况下,临床样本某一化合物峰面积(CpVOCs)/SA某一化合物峰面积(CbVOCs)≥1,则认为其化合物相似,评估流程如图2。
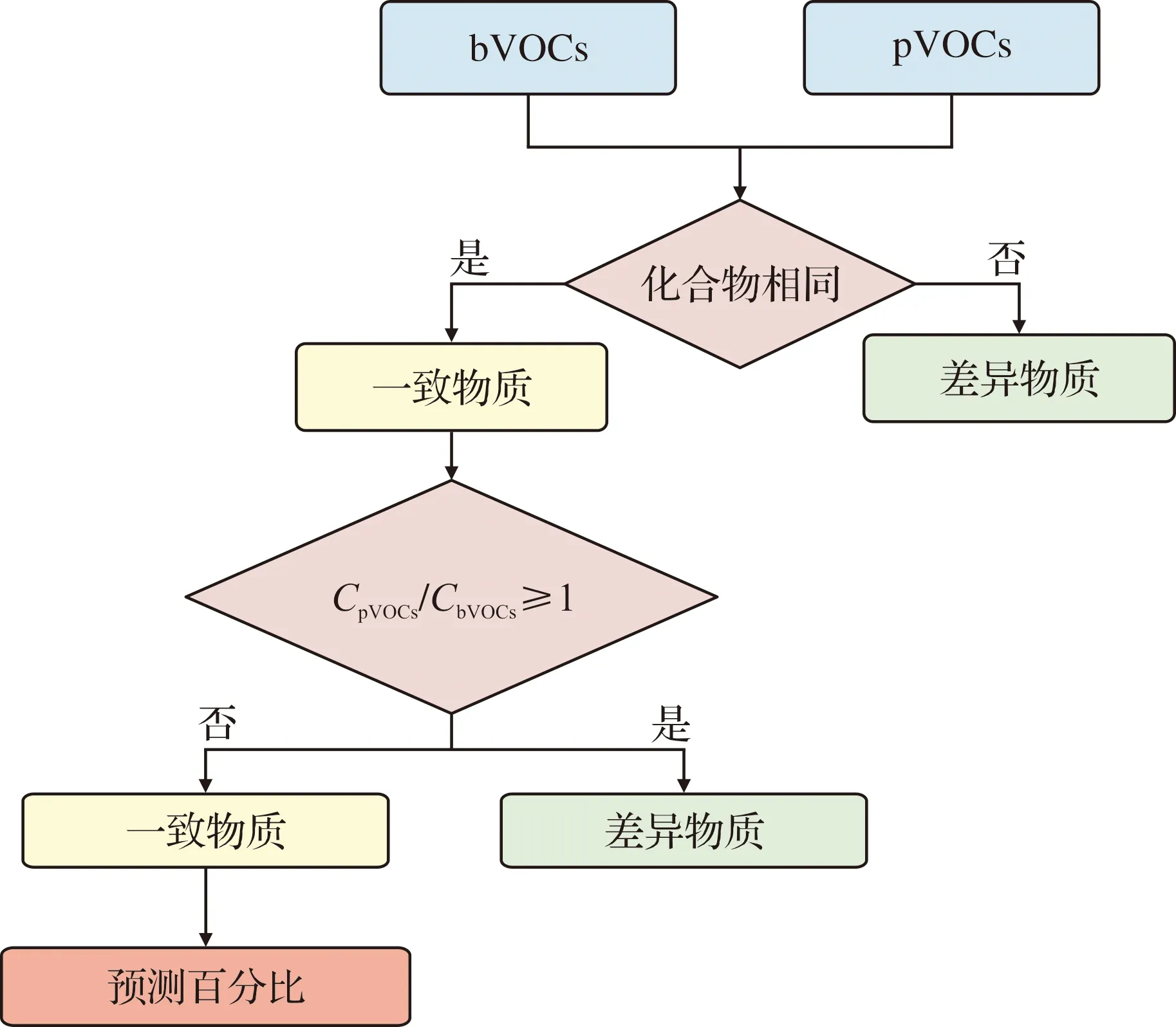
图2 临床样本与金黄色葡萄球菌一致性对比流程
1.2.7 阈值设定及算法的确定 根据前述代谢组学计算方法,CpVOCs/CbVOCs=FC,若FC>1时可认为化合物一致。在18种bVOCs中,与临床pVOCs对比计算出临床感染细菌类型与SA的一致性,用以评估感染SA的可能概率。根据OMSI的特点本研究提出了基于细菌概率的VOCs算法(bacteria probability based VOCs algorithm,BPVA),BPVA计算法计算患者感染SA的概率(x)。将临床常规细菌培养结果作为金标准,验证GC-MS对于临床快速诊断的效果。
(1)
(2)
bVOCs、pVOCs为SA和临床样本;NbVOCs:SA样本菌体数量;NpVOCs:临床样本菌体数量;CbVOCs:SA某一化合物峰面积;CpVOCs:临床样本某一化合物峰面积。
2 结果
2.1 临床OMSI患者信息
OMSI患者为通过随机纳入临床收治患者中诊断为间隙感染的患者,包括单间隙感染和多间隙感染,纳入标准参考口腔OMSI诊疗专家共识[3],准确记录患者性别、年龄以及基础疾病类型。
2.2 SA特异性代谢物数据库的建立
2.2.1 获得SA和空白培养基的色谱峰 通过GC-MS技术分析SA的挥发物以及NB的VOCs色谱峰(图3),分析去除偏离样本的色谱峰获得SA色谱峰。可以观察到SA和NB重复组一致性好。
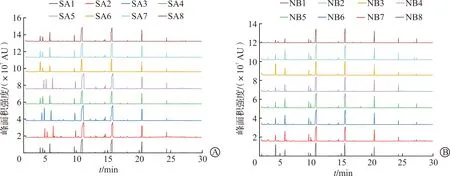
A:SA培养基色谱图;B:NB培养基色谱图。SA:金黄色葡萄球菌;NB:空白对照。图3 SA与NB培养基色谱图
2.2.2 筛选获得SA特异性化合物 将GC-MS获得的50个SA和9个NB结果的原始CDF格式数据用Analysis Base File Converter软件转变为ABF格式,然后导入MS-DIAL软件进行分析,共检测出已知化合物503种。通过Mann-WhineyU检验获得其P值,选择校正后FDR值进行计算。当FDR≥0.05或者当FDR<0.05且0.5≤FC(SA/NB)≤2时认为此类化合物在SA和NB无差异。其余化合物可认为是两者的差异物质,log2(FC)>1为SA特异性化合物,绘制火山图(图4A),获得二者之间差异物质化合物。又根据OPLS-DA降维分析发现SA(绿色)与NB(蓝色)之间有很好的区分(图4B~D),该OPLS-DA模型拟合优度好,符合标准。
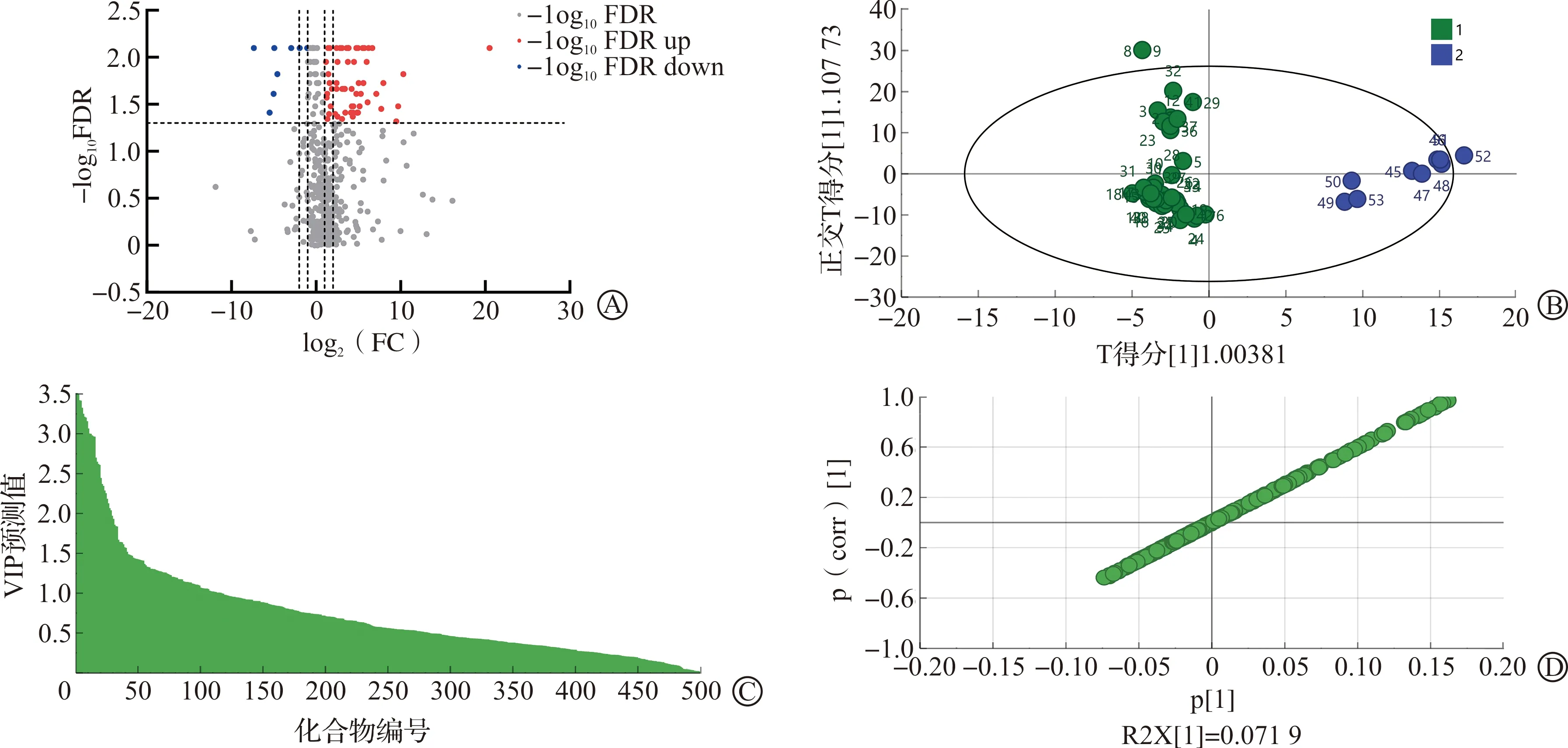
A:SA与NB火山图,FC=SA峰面积/NB峰面积,0.5≤FC≤2时认为化合物在两者之间没有差异(灰色),FC>2时为SA特异性靶标化合物(红色),FC<0.5时为NB特异性靶标化合物(蓝色);B:SA与NB培养基OPLS-DA图;C:VIP图,VIP值>1的化合物为二者差异性化合物;D:SA与NB化合物得分图,越趋向两端的化合物认为其在SA和NB中差异越大。FC:变化倍数;SA:金黄色葡萄球菌;VIP:变量投影重要性。图4 SA与NB培养基火山图、OPLS-DA及VIP图
2.2.3 SA特异性靶标谱库的建立 根据Mann-WhineyU检验获得的统计结果,根据FDR<0.05的化合物有58种,选择峰面积排序前18作为其特异性化合物,对其进行矫正并查找化合物名称,SA的特异性化合物种类及峰面积、保留时间、匹配度、CAS编号见表1。
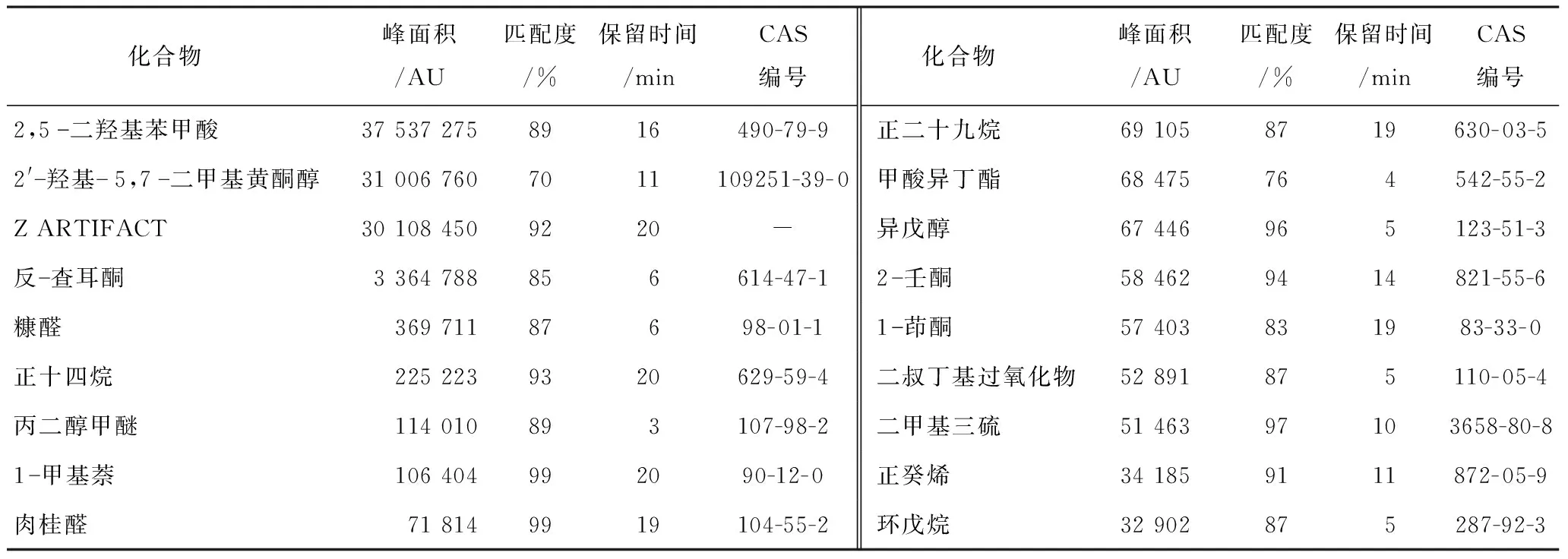
表1 SA特异性挥发物峰面积、匹配度及保留时间
2.3 临床OMSI患者感染细菌类型评估
2.3.1 OMSI患者色谱图 在患者进行手术取脓后多次离心获得菌体沉淀,然后通过GC-MS分析,获得OMSI患者的挥发物色谱图(图5),并通过MS-DIAL软件分析发现pVOCs与SA的bVOCs中一致的化合物峰面积(表2)。
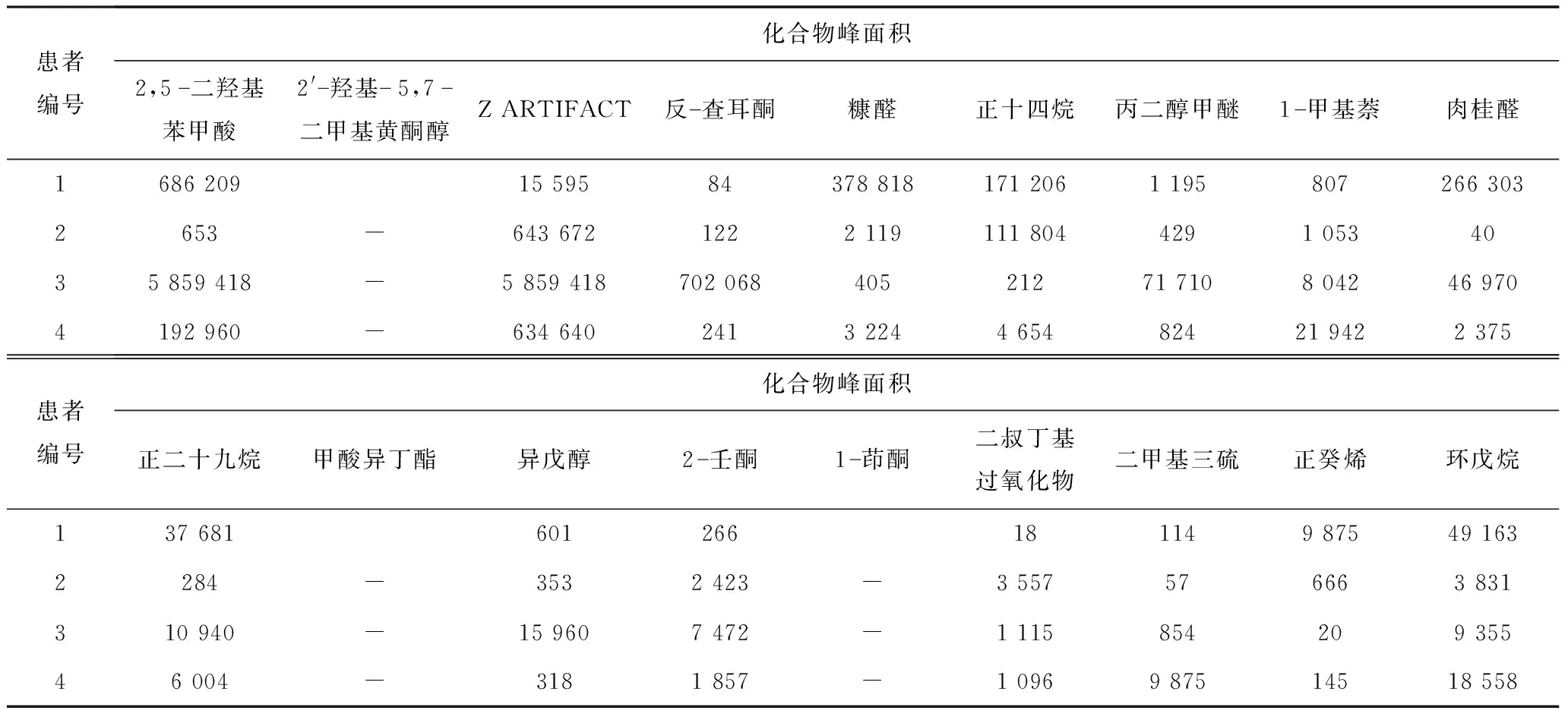
表2 4位OMSI患者pVOCs与SA的bVOCs中一致的化合物峰面积(AU)
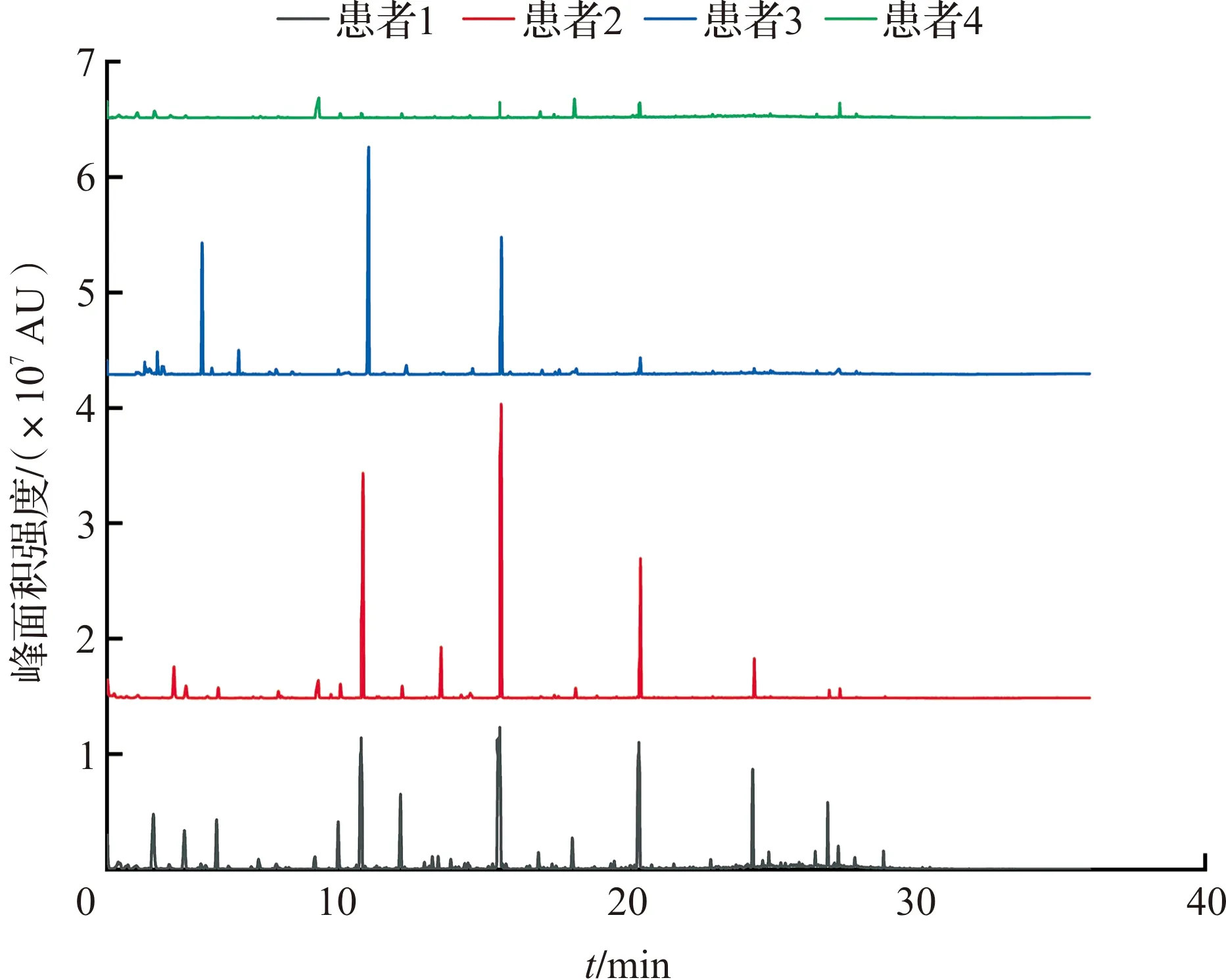
图5 临床OMSI患者色谱图
2.3.2 OMSI患者感染SA概率预测 依据SA的细菌数量与临床菌体样本的数量比值,计算获得pVOCs最终峰面积数据,将临床感染患者获得的CpVOCs与CbVOCs相比较,通过BPVA公式计算以后获得临床感染患者感染SA的概率(表3)。
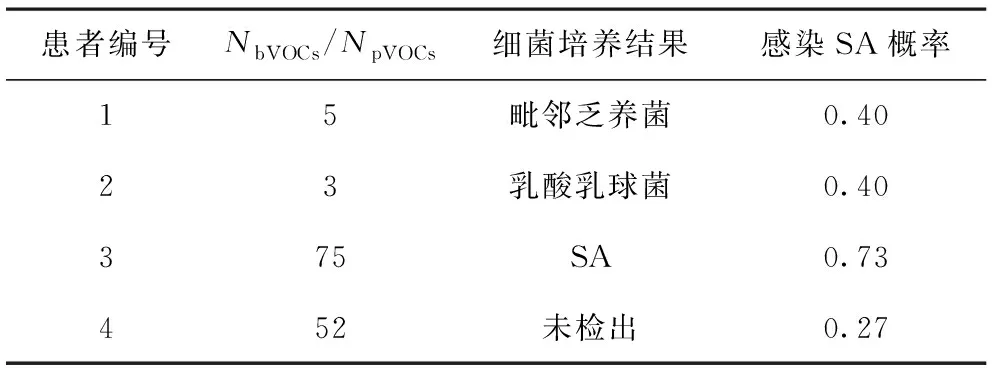
表3 临床结果预测
3 讨论
本研究首次提出了一种基于GC-MS技术的bVOCs和pVOCs的对比匹配算法模型——BPVA计算法,用于诊断OMSI细菌类型。以往的研究仅通过比较细菌与细菌之间化合物的差异,提出通过GC-MS进行区分的可能性。一部分实验通过分析实验室细菌与细菌之间的化合物差异从而将细菌类型区分开来[10],使用方法包括吸气型离子迁移谱仪和气相色谱-质谱联用技术[11]、TD/GC-MS[12]等多种方法,也有研究通过分析混合菌产生的化合物与单一培养细菌之间的差异,发现两者之间产生的化合物不同[13]。该部分结果证实了实验室细菌能通过VOCs进行有效区分。另一部分实验用于分析临床感染患者与健康人之间产生的挥发物是否具有差异性,LI等[14]分析了精神病临床高危人群的血浆代谢改变和潜在生物标志物。MONEDEIRO等[15]使顶空固相微萃取气质联用技术评估口臭和下颌下脓肿的唾液VOCs,使用的方法是气相色谱技术和唾液孵育试验相结合,取患者唾液在37 ℃孵育24 h后进行色谱质谱检测,发现正常患者与口臭患者以及间隙感染患者之间通过气味能进行有效区分。FILIPIAK等[16]用GC-MS分析肺炎克雷伯菌在临床肺炎患者中的挥发性化合物并且通过动态监测挥发物浓度的变化来预测肺炎感染的可能性。相关的临床实验结果都证实了GC-MS在临床应用的可能性。本研究将实验室和临床相结合通过GC-MS技术检测了OMSI中常见细菌SA的bVOCs,根据FDR和VIP值选取了18种作为其特异性的靶标物,设计了BPVA算法,将临床OMSI患者的pVOCs带入计算得出其感染该细菌的可能性,用以预测细菌类型。结果显示4份样本SA感染的可能性分别是40%、40%、73%、27%。实际细菌培养结果为毗邻乏养菌、乳酸乳球菌、SA、未检出,提示基于GC-MS结果与实际细菌培养结果一致性较好,通过GC-MS预测OMSI细菌类型是可行的。
本研究首次将GC-MS技术用于OMSI细菌类型的快速诊断,将传统的5~7 d检测时间缩短至24 h,该方法尤其适用于战时条件下的细菌类型快速诊断。由于战场的地域与时空的选择都在极端恶劣的自然地理、气象环境下进行,受伤后伤员可能会发生严重的创伤后感染,进而引起OMSI。现代战争具有突发性、不熟悉性、未预期性和高强度性等特点,对部队作战人员均会产生急性应激障碍和创伤后应激障碍等心理影响。这些影响在口腔颌面部可进一步表现为唾液分泌障碍(口干)、口腔菌群失调等症状。若该人员同时伴有口腔牙齿相关疾病,例如智齿冠周炎、龋齿、牙周炎、扁桃体炎或颌面部淋巴结炎等,平时可能暂时无影响的疾病会迅速转变成OMSI[17-18]。合理使用抗菌药物是治疗OMSI的主要方法,但由于受到“细菌培养+药敏试验”时间限制,早期OMSI的抗菌药物选择主要采用“经验性用药”。临床上OMSI患者常规根据“经验性用药”进行抗菌药物的选择[19]。该方法虽然具有一定的普适性,但个别患者也会出现效果不佳、后期出现耐药菌的问题。本研究将OMSI细菌检测分为两步,第一步筛选OMSI常见细菌,通过标准菌培养、bVOCs检测、特异性靶标物确定等步骤,建立了该细菌的靶标物数据库;第二步在临床遇到OMSI患者时,通过局部脓液抽吸或手术中收集患者脓液,之后进行标准化的离心、计数、提取、上机检测、数据分析等步骤,理论上可以在24 h之内得到细菌类型预测结果。通过将建库时间前移,进而缩短诊断时间,为早期及时使用抗菌药物治疗提供依据。
本研究探索了通过GC-MS技术进行OMSI细菌类型快速诊断的可行性,但仍存在一些缺陷。首先,纳入的样本量较少。本研究只纳入了1种OMSI常见细菌(SA)和4例OMSI患者样本,虽然结果符合预期,但后期仍需尽快完善OMSI细菌标准库,纳入更多患者样本进行验证,同时优化BPVA算法,提高诊断的准确率。其次,临床上该方法仍不能完全取代“细菌培养+药敏试验”的方法。本研究提出的方法对于细菌类型的诊断是以“可能性”定义的,数学模型上只能得出感染某种细菌的“概率”,用于抗菌药物选择的依据,在进行临床可靠性验证前仅限于科学研究。再次,该研究并没有考虑多重细菌感染的情况,后期拟进一步纳入“需氧菌+厌氧菌”多重感染的情况,分析该方法的可行性。最后,GC-MS设备仍不够便携,不能满足战时需求。本研究团队前期已经通过采用基于GC-MS的小型化传感器应用于膀胱癌的检测[20],后期小型化GC-MS设备也是本研究方向之一。
本研究基于颌面部常见的感染性疾病OMSI这一疾病模型,使用GC-MS技术对比标准菌bVOCs和患者pVOCs差异,通过统计学联合公式进行细菌类型的快速诊断,拟为平时或战时快速确定OMSI细菌类型提供理论依据。
