漆酶基因LACC1经腺苷酸活化蛋白激酶/NOD样受体热蛋白结构域相关蛋白3加重脑梗死缺血再灌注损伤的机制研究
2023-10-08焦俊萍鲍军强史慧敏高超田书娟
焦俊萍,鲍军强,史慧敏,高超,田书娟
目的 探讨漆酶基因LACC1对脑梗死后缺血再灌注损伤的影响及其机制。
方法 ①采购C57BL/6J LACC1基因敲除(LACC1-/-)小鼠20只,野生型小鼠20只,建立大脑中动脉闭塞/再灌注(middle cerebral artery occlusion/reperfusion,MCAO/R)模型各15只,比较两组小鼠的脑梗死体积。采用蛋白质免疫印迹实验检测脑组织中磷酸化腺苷酸活化蛋白激酶(phosphorylate AMP-activated protein kinase,p-AMPK)及NOD样受体热蛋白结构域相关蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)水平,采用微阵列分析外周血中长链非编码RNA(long noncoding RNA,lncRNA)表达谱及探讨可能涉及的信号转导通路。②制备小鼠小胶质细胞氧糖剥夺/再灌注(oxygen glucose deprivation/reoxygenation,OGD/R)模型,并通过小干扰RNA(siRNA)转染技术上调及抑制LACC1的表达,明确LACC1对脑梗死体外模型炎症和氧化应激的调节作用。采用蛋白质免疫印迹实验检测p-AMPK、NLRP3水平,采用酶联免疫吸附测定法检测血清过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、活性氧(reactive oxygen species,ROS)、IL-1β、IL-6、干扰素-γ(interferon-γ,IFN-γ)、TNF-α水平。
结果 MCAO/R模型野生型小鼠组脑梗死体积比例为(21.38%±4.06%),LACC1-/-小鼠组脑梗死体积比例为(19.07%±2.86%),差异有统计学意义(P=0.041),同时LACC1-/-小鼠脑组织中p-AMPK的蛋白表达水平增加,NLRP3蛋白表达水平受到抑制。OGD/R细胞模型中,LACC1的下调抑制了NLRP3蛋白的表达、增加了p-AMPK蛋白的表达。OGD/R细胞模型中,LACC1的过度表达增加了IL-1β、IL-6、INF-γ、TNF-α、MDA和ROS生成,降低了CAT和SOD的水平(P<0.05)。
结论 LACC1可能通过AMPK/NLRP3途径加重小鼠缺血再灌注后的炎症反应,这可能为脑梗死或其他神经系统疾病及其相关并发症提供一种新的治疗方案。
脑梗死的发病率及致残率均较高,神经免疫炎症、氧自由基及细胞内钙超载、自噬等均参与了缺血再灌注损伤的发生、发展[1]。阐明脑梗死的发病机制,寻找有效的治疗干预措施,是临床亟须解决的问题。漆酶基因LACC1与脂质代谢、NOD2复合物、内质网应激和嘌呤核苷酸循环有关[2],有研究显示LACC1可以调节TNF、IL-17等细胞因子的水平[3],LACC1的切割和降解导致巨噬细胞自噬阻滞。有研究证实LACC1对促进腺苷酸活化蛋白激酶(phosphorylate AMPactivated protein kinase,AMPK)下游巨噬细胞的自噬通量很重要[4]。对于缺血性卒中患者,AMPK的上调不但能减轻氧化应激、抑制神经炎症,而且能调节神经元的自噬和凋亡、改善线粒体的功能、抑制谷氨酸兴奋毒性,并且促进新生血管形成。在脑梗死的发生、发展过程中,肠道菌群及IL-17发挥了重要作用[5],LACC1是保持肠道稳态的重要基因[6]。因此,本研究设计推断LACC1对脑梗死急性期的缺血再灌注损伤有一定的影响,其机制可能与参与炎症与免疫调节有关。
1 材料与方法
1.1 材料
1.1.1 大脑中动脉闭塞/再灌注模型建立及分组 选择8周龄雄性C57BL/6J小鼠(购于河北医科大学实验动物中心)和8周龄C57BL/6JLACC1基因敲除(LACC1-/-)小鼠[购于赛业(广州)生物科技有限公司]建立大脑中动脉闭塞/再灌注(middle cerebral artery occlusion/reperfusion,MCAO/R)模型,小鼠质量为18~22 g。向小鼠腹腔内注射水合氯醛溶液进行麻醉,将右侧颈总动脉、颈内动脉和颈外动脉进行分离,结扎颈总动脉近心端及颈外动脉,夹闭颈内动脉的远心端。在颈总动脉距离分叉约0.2 cm处剪一“V”形小口,将栓塞线从切口处插入颈总动脉,将线栓推进至颈内动脉,缝合皮肤伤口。闭塞60 min后,缓慢回撤线栓以实现血流的再灌注。MCAO/R术后24 h,采用Longa评分系统对小鼠进行神经行为检查。0分:无神经功能障碍;1分:完全无法伸展左前爪;2分:向左侧转圈;3分:向左侧倾倒;4分:不能自发行走,意识丧失。Longa评分为1~3分的小鼠是成功的MCAO/R模型。20只野生型小鼠MCAO/R造模成功15只,作为对照组;20只LACC1-/-小鼠MCAO/R造模成功15只,作为实验组。本研究经过河北医科大学第一医院伦理委员会批准(伦理批号:20220221)。
1.1.2 细胞模型建立及分组 将小鼠BV-2小胶质细胞(购于武汉普诺赛生命科技有限公司)在杜尔贝科改良伊格尔培养基(Dulbecco’s modified Eagle medium,DMEM)(购于美国犹他州洛根Hyclone公司)中进行培养。DMEM含有10%胎牛血清、100 U/mL青霉素和100 mg/mL链霉素,培养温度为37 ℃,CO2浓度为5%。根据不同转染序列将细胞模型分为4组:阴性组、LACC1上调组、LACC1下调组及Si阴性组。
1.1.3 试剂 RNA提取试剂盒、反转录试剂盒购自生工生物工程(上海)股份有限公司,单克隆抗体NOD样受体热蛋白结构域相关蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)、磷酸化腺苷酸活化蛋白激酶(phosphorylate AMP-activated protein kinase,p-AMPK)、腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)和羊抗小鼠IgG购自美国Cell Signaling Technology公司,放射免疫沉淀(radio immunoprecipitation assay,RIPA)裂解液购自北京索莱宝科技有限公司,谷胱甘肽(glutathione,GSH)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、IL-1β、IL-6、干扰素-γ(interferon-γ,IFN-γ)、TNF-α酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒购自美国Invitrogen公司。
1.2 方法
1.2.1 动物实验 (1)微阵列分析:造模4周后,采集两组小鼠外周血,采用高通量长链非编码RNA(long noncoding RNA,lncRNA)芯片进行检测,经分数值标准化,去除低质量探针(保留20个样品中至少10个样品标记为表达或未表达的探针),得到脑梗死lncRNA表达谱。将鉴别出的mRNAs[P<0.05,错误发现率(false discovery rate,FDR)<0.05]进行通路富集分析,推断脑梗死发生过程中可能涉及的信号转导通路。
(2)TTC染色:造模4周后,取小鼠脑组织,由视交叉平面开始向后连续切取2 mm冠状切片5张。配制1%的2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)染色液,37 ℃避光浸染15 min后拍照,通过颜色不同评定小鼠的脑梗死体积,红色、白色分别为正常组织、梗死区。使用Image J软件进行梗死区体积统计分析,脑梗死体积比例=总梗死体积/各脑切片体积之和×100%。
(3)蛋白质免疫印迹实验检测小鼠脑组织中的蛋白表达:造模4周后,取小鼠脑组织剪碎经RIPA裂解缓冲液处理,离心后取上清液通过二喹啉甲酸法(bicinchoninic acid,BCA)分析蛋白质浓度。蛋白质通过10%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)分离并转移到聚偏氟乙烯膜上,在室温下采用5%脱脂乳封闭膜封闭1 h,并在4 ℃下采用LACC1、AMPK、p-AMPK、NLRP3和β-肌动蛋白一级抗体孵育过夜,将膜与二级抗体——辣根过氧化物酶结合的山羊抗小鼠二级抗体在室温下孵育2 h。采用电化学发光(electrochemiluminescence,ECL)法测定蛋白质条带,并采用Image J软件进行评估。
1.2.2 细胞模型 (1)细胞复苏、培养与传代:从液氮中取出BV-2小胶质细胞,37 ℃水浴快速复苏后采用完全培养基培养,在完全培养基中加入10%胎牛血清,1%双抗(抗青霉素/链霉素)培养BV-2小胶质细胞。将BV-2置于5% CO2、37 ℃的培养箱中培养2 d,待细胞生长至密度为90%左右时进行传代培养。
(2)siRNA转染序列:①细胞铺板,每孔30万,6孔板,过夜,使转染前密度达到3~5×。②按照说明书,配制转染储存液。③转染终浓度选用50 nM,严格按照Lipofectamine试剂盒说明书,将化学合成的LACC1模拟物、模拟阴性对照物(NC)、si-LACC1和si-NS(广州市锐博生物科技有限公司)利用LipofectamineTM2000工具包瞬时转染到细胞中[赛默飞世尔科技(中国)有限公司]。对LACC1基因和内参基因甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)设计特异性引物,将LACC1进行扩增(引物由深圳华大基因科技有限公司合成):LACC1-F:5′-CCATTCGCTCACCGTCATC-3′,LACC1-R:5′-CCTTTGCCTTCGTTGTTGTTC-3′,GAPDH-F:5′-CGCTCAACAAGAACTTCGTCAA-3′,GAPDH-R:5′-GTAGACAAGGAGGTCACAGA-3′。Si-LACC1基因序列[3](Dharmacon On-Target Plus SMARTpool® siRNA试剂,北京北方同正生物技术发展有限公司):CGAAAGAUGUAGAGGUUUU(J-015653-17),CUAGAUAAGAGGCGAUCAA(J-015653-18),AGACAUUGUUGUUGUACUU(J-015653-19),GGAGAAAUUUUACCGAAUA(J-015653-20)。④按说明书配制转染复合物,加入无双抗培养基中,混匀。⑤将孔板放入37 ℃孵箱培养。⑥24 h后用磷酸盐缓冲液冲洗孔板,更换为完全培养基继续培养24 h,其间可进行加药操作。⑦换液24 h后,进行糖氧剥夺(oxygen and glucose deprivation,OGD)处理及后续操作。
(3)建立OGD/R模型:取对数生长期的BV-2细胞,弃去培养基,用1 mL高糖DMEM冲洗2次,加入胰酶消化细胞,在显微镜下确认细胞已被消化,再加入3 mL DMEM多次吹打,收取细胞悬液。离心后,用1 mL胎牛血清重悬沉淀细胞。将细胞接种于培养板中,加入无糖DMEM(96孔板每孔100 μL,12孔板每孔1 mL)。将细胞培养板和氧浓度检测仪同时放入缺氧小室中,连接缺氧装置与备用气瓶,用含95% N2和5% CO2的混合气体通气,流量为20 L/min,氧浓度监测仪显示缺氧小室内氧浓度≤0.2%时,快速关紧进、出气阀,将缺氧装置放入CO2培养箱中继续培养4 h。除去培养板中培养液,以高糖DMEM冲洗2次,再加入完全培养基,37 ℃、5% CO2培养箱中培养24 h,模拟再灌注损伤。
(4)蛋白质免疫印迹实验检测蛋白表达:通过ECL法测定4组模型中LACC1、p-AMPK、NLRP3的蛋白表达,采用凝胶图像分析系统扫描胶片后进行吸光度分析,通过计算目的条带与其对应的内参条带的比值来表示目的蛋白的表达水平。
(5)ELISA检测炎性因子水平:对细胞上清液中的GSH、SOD、MDA、IL-1β、IL-6、INF-γ和TNF-α水平采用ELISA法进行定量检测。使用微孔板读取器(Bio-Rad)测定450 nm处的吸光密度。
1.3 统计学方法 采用GraphPad Prime 8.0进行数据分析。符合正态分布、方差齐的计量资料以表示,两组间比较采用Turkey法,以P<0.05为差异具有统计学意义。
2 结果
2.1 动物实验
2.1.1 微阵列分析结果 对LACC1-/-小鼠进行微阵列分析,显示其LACC1基因表达水平上调,对靶基因进行通路富集分析得到AMPK/NLRP3信号通路(图1)。
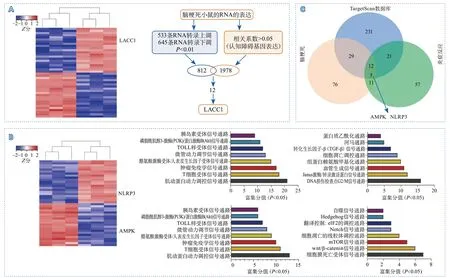
图1 微阵列分析结果Figure 1 Microarray analysis results
2.1.2LACC1基因敲除后的脑梗死体积TTC染色结果显示,野生型小鼠组脑梗死体积比例为(21.38%±4.06%),LACC1-/-小鼠组脑梗死体积比例为(19.07%±2.86%),野生型小鼠组脑梗死体积比例高于LACC1-/-小鼠组,差异有统计学意义(P=0.041),结果提示基因敲除对小鼠的脑梗死体积有显著影响(图2)。
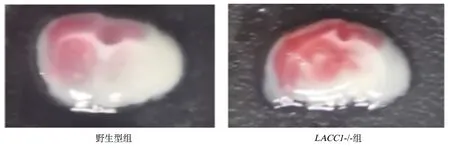
图2 LACC1基因敲除后小鼠脑梗死体积的变化Figure 2 Changes in cerebral infarction volume of mice after LACC1 gene knockout
2.1.3 两组小鼠炎性指标分析 与野生型小鼠相比,LACC1-/-小鼠脑组织中GSH和SOD表达水平增加,MDA、IL-1β、IL-6、INF-γ、TNF-α、I型胶原、E-钙黏蛋白和α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)mRNA表达水平受到抑制,差异有统计学意义(表1)。
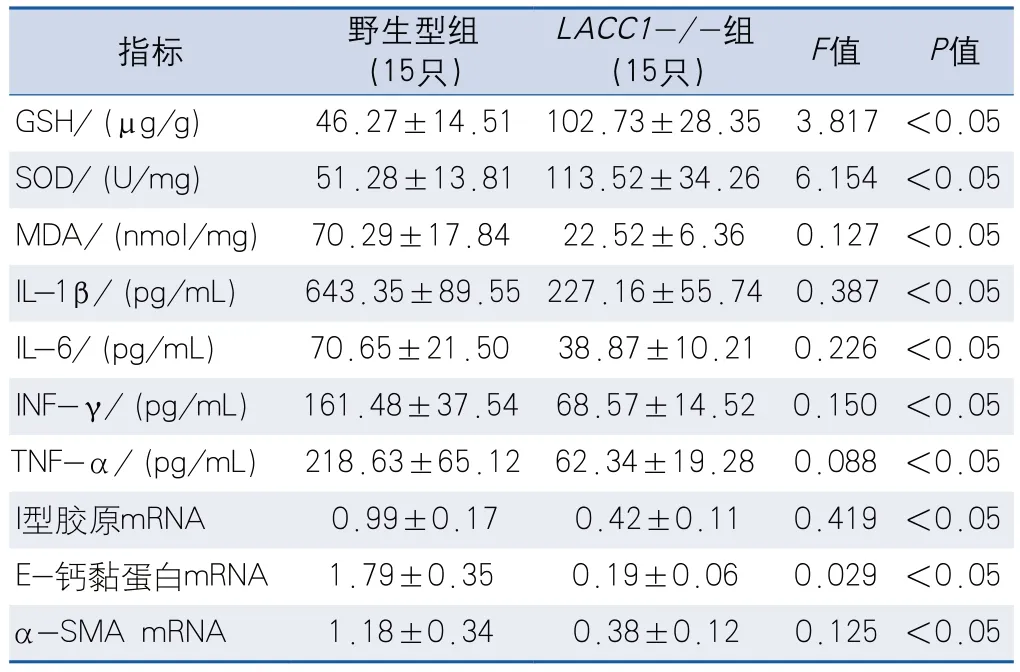
表1 两组小鼠炎性指标比较Table 1 Comparison of inflammatory indicators between two groups of mice
2.1.4 p-AMPK、NLRP3在LACC1-/-小鼠中的表达LACC1-/-小鼠脑组织中p-AMPK蛋白为(3.014±0.817),高于野生型小鼠的(1.277±0.254),差异有统计学意义(F=10.346,P<0.001);LACC1-/-小鼠脑组织中NLRP3蛋白为(0.295±0.058),低于野生型小鼠的(1.782±0.442),差异有统计学意义(F=0.017,P<0.001)。蛋白质免疫印迹实验结果见图3。
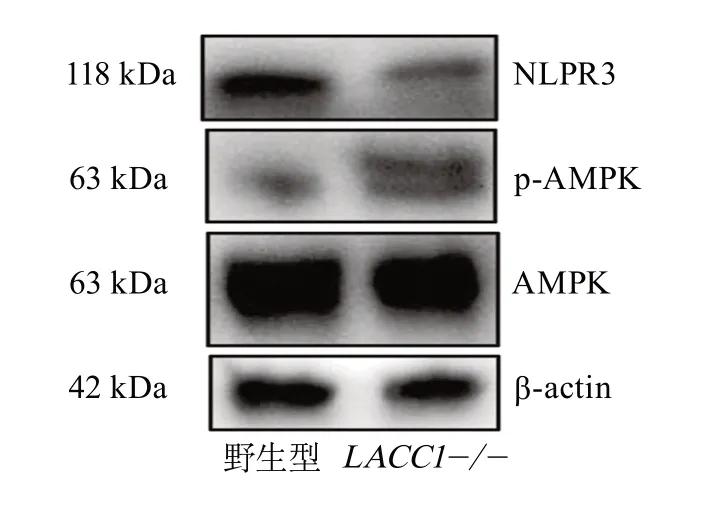
图3 两组小鼠p-AMPK蛋白、NLRP3蛋白的表达Figure 3 Protein expression of p-AMPK and NLRP3 between two groups of mice
2.2 细胞模型
2.2.1 细胞模型ELISA检测结果LACC1上调组MDA、ROS、IL-1β、IL-6、TNF-α和INF-γ水平高于阴性组,CAT和SOD水平低于阴性组,差异有统计学意义(表2)。LACC1下调组MDA、SOD、IL-1β、IL-6、TNF-α和INF-γ水平低于Si阴性组,CAT和SOD水平高于Si阴性组,差异有统计学意义(表3)。
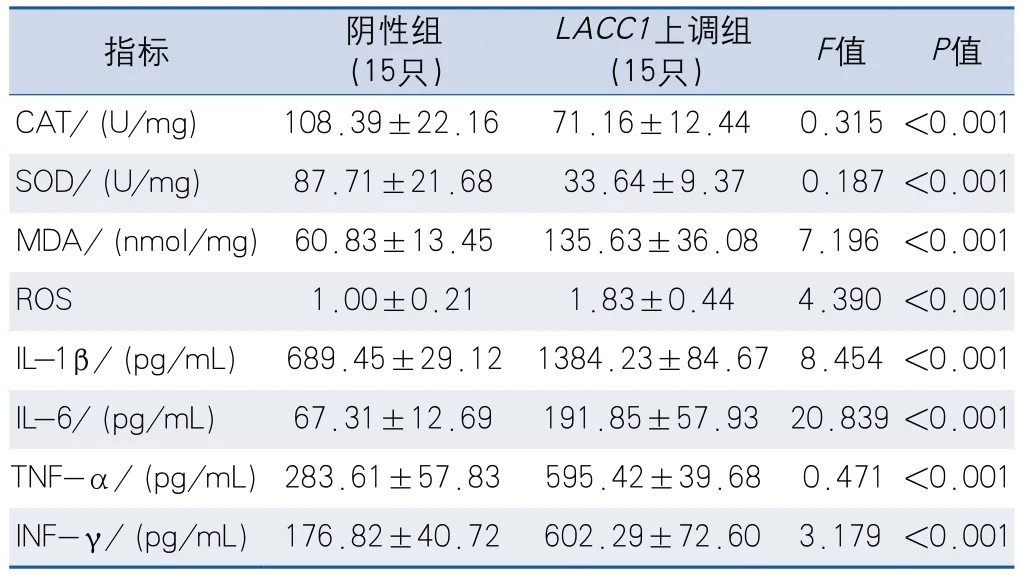
表2 LACC1上调组与阴性组炎性指标比较Table 2 Comparison of inflammatory indicators between the LACC1 up-regulated group and the negative group
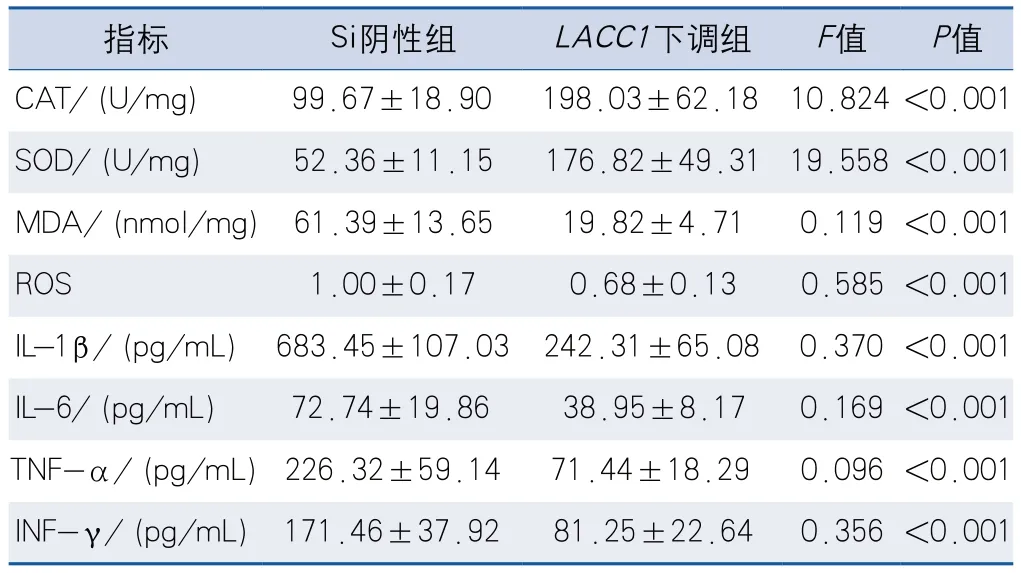
表3 LACC1下调组与Si阴性组炎性指标比较Table 3 Comparison of inflammatory indicators between the LACC1 down-regulated group and the Si-negative group
2.2.2 蛋白质免疫印迹实验检测结果 蛋白质免疫印迹实验结果显示,LACC1下调组p-AMPK蛋白量为(2.204±0.632),高于Si阴性组的(0.913±0.226),差异有统计学意义(F=7.820,P<0.001);NLRP3蛋白量为(0.445±0.078),低于Si阴性组的(0.917±0.245),差异有统计学意义(F=0.033,P<0.001),蛋白质免疫印迹实验结果见图4A。LACC1上调组p-AMPK蛋白量为(0.352±0.113),低于阴性组的(1.092±0.284),差异有统计学意义(F=0.158,P<0.001);NLRP3蛋白量为(0.883±0.226),高于阴性组的(0.237±0.062),差异有统计学意义(F=0.075,P<0.001),蛋白质免疫印迹实验结果见图4B。免疫荧光显示LACC1上调后p-AMPK蛋白的表达较阴性组降低(图4C)。
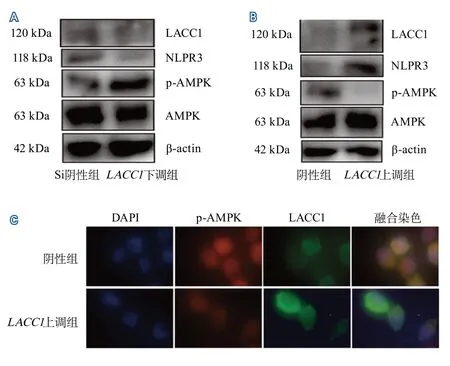
图4 LACC1调节AMPK/NLRP3通路Figure 4 LACC1 regulates the AMPK/NLRP3 pathway
3 讨论
卒中患者会遗留功能残障、社会功能和心理健康受损,严重影响患者的生活质量和生存时间[7]。相关的炎症和免疫反应是脑梗死病理生理学中的关键因素[8]。急性脑梗死患者中氧自由基含量升高,增加了抗氧化酶的降解,因此,机体中的SOD会减少,同时MDA水平会升高,增加了氧自由基对机体的损伤。在缺血开始数小时内,小胶质细胞会对改变的内环境做出反应,表现为形态学改变和与神经元接触的增加,受累神经元会出现兴奋毒性钙超载迹象[9]。伴随着小胶质细胞上模式识别受体的激活,炎症小体所介导的IL-1β释放和TNF水平增加,诱导星形胶质细胞与血管内皮细胞中的趋化因子和细胞因子产生,进而反馈到炎性级联反应。免疫系统在损伤部位发挥免疫抑制参与脑损伤,还会削弱机体抵抗力,导致致命的细菌感染,使卒中患者的预后受到影响,甚至会危及生命[10]。
AMPK在调节全身细胞能量代谢的内稳态中起着至关重要的作用[11]。在正常生理条件下,AMPK可促进大脑发育并调节神经元极化。在脑梗死患者中,AMPK的上调可减轻氧化应激、抑制神经炎症、调节神经元自噬和凋亡、改善线粒体功能、抑制谷氨酸兴奋毒性和促进新生血管形成,AMPK还可促进缺血性卒中的功能恢复[12]。氧化呼吸链在脑缺血期间受损,可产生ROS[13]。ROS使硫氧还蛋白相互作用蛋白与NLRP3受体结合,从而激活NLRP3,NLRP3炎症小体可使caspase-1发生自剪切并产生酶活性,引起细胞凋亡[14-15]。本研究在脑梗死患者及脑梗死模型小鼠的血清中发现AMPK的表达水平降低,NLRP3的表达水平升高,从另一方面证实了AMPK在抗炎、保护神经细胞方面的作用。
LACC1具有下调感染和免疫炎症反应的功能[16]。有研究发现,LACC1可影响TNF及IL-17的水平[3]。LACC1缺乏降低了原代巨噬细胞的自噬通量,而脂蛋白相关磷脂酶A2、巨噬细胞集落刺激因子在急性脑梗死过程中起着重要的作用,二者由血管壁成熟的巨噬细胞和T细胞等分泌而来[4]。在脑梗死的发生、发展中,肠道菌群及IL-17发挥了重要作用[5]。LACC1是保持肠道稳态的重要基因[6]。肠道微生物群与卒中后认知功能障碍的多种危险因素相关,推测二者存在某种联系[17]。本研究证实LACC1基因敲除后,小鼠的梗死体积明显减小,AMPK表达水平升高,NLRP3表达水平降低,显示LACC1可能加重脑梗死后的神经损伤。接下来,研究进一步通过上调及下调LACC1的水平寻找该基因的作用通路,证实AMPK/NLRP3受LACC1的调节,因此推断LACC1可能通过AMPK/NLRP3通路发挥作用,并促进炎症因子IL-1β、IL-6、INF-γ、TNF-α等的表达,加重脑梗死后炎症反应,导致缺血再灌注损伤。
4 结论
本研究结果显示LACC1基因促进炎性因子的表达,抑制AMPK及增加NLPR3表达,从而增加炎症反应和ROS诱导的氧化应激。因此推测LACC1基因可能通过AMPK/NLPR3途径加重缺血再灌注损伤后的炎症反应。这项工作有助于深入理解脑梗死及缺血再灌注的发病机制,通过进一步研究,该通路中的重要蛋白亦可能成为脑梗死急性期新的疾病标志物或治疗靶点。
利益冲突所有作者均声明不存在利益冲突。
【点睛】LACC1基因通过调控AMPK/NLRP3通路,加重炎症及氧化应激反应,导致脑梗死后的缺血再灌注损伤,这可能为脑梗死及其并发症的治疗提供一种新思路。
