金丝桃苷通过作用人胰腺癌细胞对裸鼠体内肿瘤细胞的影响
2023-10-08陈继荣王佳颞纾
陈继荣 王佳 颞纾
(湖北医药学院附属随州医院肝胆胰外科,湖北 随州 441300)
胰腺癌是一种高致命性的恶性肿瘤,虽然接受过包括手术切除在内的多模式治疗的患者的5年生存率超过了20%,但患者的整体生存率仍然较低〔1〕。在胰腺癌治疗过程中,化学疗法和放射疗法的治疗效果较差,因此,迫切需要新的治疗策略来提高患者的生存率和预后。大量研究发现天然草药具有抗肿瘤作用。金丝桃苷具有许多生物学作用,包括心肌保护、抗氧化、抗高血糖、抗炎、镇痛、抗癌等作用〔2~4〕。然而,尚不清楚金丝桃苷在治疗胰腺癌中的作用及可能的分子机制。磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)信号通路是恶性肿瘤转移中最重要的途径之一〔5〕。核因子(NF)-κB是一种在调节肿瘤细胞增殖、侵袭、凋亡和血管生成中起重要作用的核转录因子,在许多癌细胞中经常被激活〔6,7〕。此外,NF-κB的活性受到PI3K/Akt信号通路的调控〔5〕。许多实验结果表明,NF-κB在胰腺癌细胞的生长和增殖中起关键作用。NF-κB可通过诱导生长基因的表达直接刺激细胞增殖,并且NF-κB能够通过抗凋亡作用促进胰腺癌的生长〔8〕。本研究探讨金丝桃苷在体内和体外对胰腺癌细胞生长和凋亡的影响,并考察金丝桃苷对PI3K/Akt/NF-κB信号通路的调控作用。
1 材料和方法
1.1细胞培养 人胰腺癌细胞系PANC-1和人正常胰腺导管上皮细胞系HPDE6-C7购自美国典型培养物保藏中心,将PANC-1细胞在Dulbecco改良的Eagle培养基(DMEM)培养,培养基中添加胎牛血清(10%)、青霉素(100 U/ml)和链霉素(100 mg/ml),培养条件为37 ℃、5%CO2。
1.2细胞处理 将金丝桃苷(美国Sigma-Aldrich公司)以1 000 mmol/L的浓度溶于二甲基亚砜(DMSO,终浓度为0.1%,美国Sigma-Aldrich公司)中,并保存在4 ℃下。在完全细胞培养基中用不同浓度(0~500 μmol/L)的金丝桃苷处理60%~70%融合的细胞72 h。用0.1%DMSO处理的细胞作为对照。
1.3细胞计数试剂盒(CCK)-8测定 按照制造商的说明,通过CCK-8试剂盒(日本Dojindo Laboratories公司)测定细胞活力。将细胞以5×103细胞/孔的密度接种在96孔微量滴定板中,每孔含有200 ml培养基及不同浓度〔0(对照)、50、100、200、500 μmol/L〕的金丝桃苷。然后将CCK-8溶液(10 μl)加入每个孔中,并将96板孔在37 ℃下孵育4 h。然后用酶标仪测量不同培养时间段的450 nm波长下的吸光度(OD)。
1.4细胞凋亡测定 按照制造商的说明,使用膜联蛋白(Annexin)V-异硫氰酸荧光素(FITC)和碘化丙啶(PI)检测试剂盒(北京宝赛生物技术有限公司)通过流式细胞术测定细胞凋亡。将细胞用不同浓度的金丝桃苷溶液〔0(对照)、50、100、200、500 μmol/L〕孵育72 h,然后用胰蛋白酶收获细胞,在磷酸盐缓冲液(PBS)中洗涤并计数。计数后,将细胞以1×106个/ml的浓度重悬于结合缓冲液中,然后添加10 μl的Annexin V和5 μl的PI,并且将细胞在室温下黑暗中孵育15 min。孵育后,通过贝克曼流式细胞仪Epics Altra分析凋亡细胞的百分比。
1.5Western印迹分析 将0 μmol/L和200 μmol/L金丝桃苷溶液处理的细胞在冰冷的PBS中洗涤两次,在放射免疫沉淀(RIPA)缓冲液(碧云天生物技术研究所)中裂解并匀浆,然后在4 ℃下9 500 r/min离心10 min去除碎片,并根据制造商的说明使用二喹啉甲酸(BCA)蛋白测定法确定蛋白浓度。通过在10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离等量蛋白质(50 mg),并电转移到聚偏氟乙烯(PVDF)膜上。将膜用5%脱脂牛奶封闭2 h后,与以下一抗在4 ℃下过夜孵育:裂解的胱天蛋白酶(cleaved-caspase)3(1∶500稀释)、B细胞淋巴瘤(Bcl)-2(1∶1 000稀释)、Bcl-2相关X蛋白(Bax,1∶500稀释)、p-Akt(1∶500稀释,美国Santa Cruz Biotechnology公司)、PI3K(1∶1 000稀释)、Akt(1∶500稀释,美国Cell Signaling Technology公司)、NF-κB p65(1∶2 000稀释,美国Abcam公司)和GAPDH(1∶1 000稀释,美国Abcam公司)。并与相应的辣根过氧化物酶标记的二抗(1∶500稀释,美国Santa Cruz Biotechnology公司)在室温下孵育1 h。使用增强的化学发光(ECL)试剂盒进行显影,GAPDH作为内部对照。
1.6细胞迁移和侵袭测定 通过孔径为8 μm的24孔Transwell(美国Minipore公司)进行细胞迁移测定。分别将2×105个0 μmol/L 和200 μmol/L金丝桃苷溶液处理的PANC-1细胞加入200 μl DMEM中〔含有1%胎牛血清(FBS)〕,然后添加到上室中,下室加入600 μl DMEM(含有10%FBS)。孵育24 h后,用棉签除去上室中的未迁移的细胞,并用4%多聚甲醛固定、结晶紫染色,在200倍放大倍数下计数迁移细胞。将上室预先用基质胶(美国BD Biosciences公司)包被,用于测定细胞PANC-1的侵袭能力,其他步骤与迁移实验相同。
1.7裸鼠肿瘤异种移植模型和治疗 雄性BALB/c nu/nu裸鼠(5~7周龄)购自南京医科大学实验动物中心,体质量20~25 g。将5×106个PANC-1细胞皮下注射到裸鼠的背部建立肿瘤异种移植模型。然后,将裸鼠随机分为对照组和金丝桃苷组(每组6只),对照组裸鼠腹腔注射200 μl 0.1%DMSO溶剂,金丝桃苷组按照30 mg/kg 的剂量注射200 μl金丝桃苷溶液,持续注射28 d。每周监测1次肿瘤生长,持续4 w,用游标卡尺测量肿瘤的短径和长径,肿瘤体积=0.5×短径2×长径。
1.8统计学分析 采用SPSS21.0软件进行方差分析、LSD事后检验及t检验。
2 结 果
2.1金丝桃苷对胰腺癌细胞活力的影响 与对照组相比,随着金丝桃苷浓度的升高,PANC-1细胞活力显著降低,表现为浓度依赖性(P<0.05)。此外,当金丝桃苷浓度为500 μmol/L时,HPDE6-C7细胞活力显著降低(P<0.05)。见表1。
2.2金丝桃苷对胰腺癌细胞凋亡的影响 与对照组〔(1.23±0.07)%〕相比,不同浓度(50、100、200、500 μmol/L)的金丝桃苷处理PANC-1细胞的细胞凋亡率均显著升高〔(7.64±0.40)%、(13.26±0.70)%、(16.12±0.85)%、(21.34±1.13)%〕,并且呈剂量依赖性(P<0.05)。见图1。Western印迹分析显示(图2),与对照组(1.00±0.05、1.00±0.05、1.00±0.05)相比,200 μmol/L金丝桃苷处理PANC-1细胞中cleaved-caspase 3和Bax蛋白表达显著升高(3.45±0.15、2.53±0.11,P<0.05),Bcl-2蛋白表达显著降低(0.44±0.03,P<0.05)。

图1 流式细胞术测定不同浓度的金丝桃苷对PANC-1细胞凋亡的影响

图2 Western印迹分析金丝桃苷对PANC-1细胞中cleaved-caspase 3、Bax和Bcl-2表达的影响
2.3金丝桃苷对胰腺癌细胞迁移和侵袭的影响 与对照组〔(100.00±5.30)%〕相比,200 μmol/L金丝桃苷处理PANC-1细胞的细胞迁移率显著降低〔(23.42±1.24)%,P<0.05〕。与对照组〔(100.00±5.30)%〕相比,200 μmol/L金丝桃苷处理PANC-1细胞的细胞侵袭率显著降低〔(17.85±0.95)%,P<0.05〕。见图3。

图3 Transwells法测定金丝桃苷对PANC-1细胞迁移、侵袭的影响(结晶紫染色,×200)
2.4金丝桃苷对PI3K/Akt/NF-κB信号通路的影响 与对照组(1.00±0.04、1.00±0.05、1.00±0.060、1.00±0.05)相比,200 μmol/L金丝桃苷处理PANC-1细胞中PI3K和NF-κB p65蛋白表达显著降低(0.24±0.01、0.17±0.01;P<0.05),Akt的磷酸化水平显著降低(0.21±0.01;P<0.05),Akt蛋白相对表达无明显变化(0.94±0.04;P>0.05),见图4。

图4 Western印迹分析金丝桃苷对PANC-1细胞中PI3K、Akt、p-Akt和NF-κB p65表达的影响
2.5金丝桃苷对体内肿瘤生长的影响 给药前,对照组体质量为(23.14±1.23)g,金丝桃苷组体质量为(23.09±1.17)g,两组体质量无显著差异(P<0.05)。在给药28 d时,对照组和金丝桃苷组体质量无显著差异〔(21.73±1.09) vs (21.54±1.20)g,P<0.05〕。在接种PANC-1细胞14 d后,与对照组相比,金丝桃苷组肿瘤体积显著降低(P<0.001)。见表2。
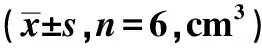
表2 对照组和金丝桃苷组的肿瘤体积比较
3 讨 论
胰腺是具有内分泌和外分泌功能的重要器官。外分泌功能涉及消化酶向小肠的分泌,而内分泌功能涉及激素(包括胰岛素、胰高血糖素和生长抑素)的分泌〔9〕。约95%的胰腺癌靶向外分泌功能,而5%靶向内分泌功能。前者是恶性且生长迅速,而后者是良性且生长缓慢。胰腺癌由于具有进展迅速、早期症状少、诊断时大多处于晚期、对化学疗法的反应差等特征,导致患者的预后非常不理想〔10〕。
越来越多的研究表明,许多中药可用于诱导细胞凋亡和抑制炎症反应〔11〕。黄酮类化合物存在于多种水果、植物来源的饮料和蔬菜中,并因其抗炎、镇痛和解热作用而广为人知。金丝桃苷属于一种黄酮类化合物,具有多种生物活性,包括抗炎活性、心肌保护和抗氧化作用〔12〕。本研究结果也证实,金丝桃苷可在体内明显抑制胰腺癌肿瘤生长。提示金丝桃苷可能对胰腺癌细胞具有抑制作用。
Bcl-2家族的蛋白质在控制细胞凋亡途径中起着至关重要的作用,其中Bcl-2可减少细胞凋亡,相反,Bax则诱导凋亡〔13〕。此外,caspase-3是细胞凋亡过程中的终末剪切酶,也是一种促凋亡信号分子,cleaved-caspase 3是caspase-3的活化形式。另外,caspase-3的促凋亡作用可被Bcl-2阻断〔14~16〕。本研究结果说明,金丝桃苷可能通过调控caspase 3、Bax和Bcl-2来发挥抗凋亡作用。
胰腺癌的高致死率和高转移性与胰腺癌细胞的迁移和侵袭能力直接相关。本研究发现,金丝桃苷处理降低了PANC-1细胞的迁移和侵袭能力。众所周知,PI3K/Akt信号通路是恶性肿瘤转移中最重要的传导途径之一〔17〕。PI3K/Akt通路在调节恶性肿瘤的生长和转移的重要作用已得到充分证明。AKT是P13K的下游靶标,也是一种原癌基因,活化的PI3K可激活蛋白激酶AKT并导致细胞进入分裂周期并开始增殖。本研究结果说明金丝桃苷可能通过抑制PI3K/Akt信号通路来降低胰腺癌细胞的增殖和转移能力。
此外,PI3K/Akt信号通路的激活可以进一步活化NF-κB〔18〕。NF-κB参与胰腺癌致癌过程的不同阶段,并且在许多恶性肿瘤中均有报道〔19〕。 NF-κB诱导基因参与抗凋亡、侵袭、血管生成、转移和增殖,并且在胰腺癌中起重要的调节作用〔17〕。大量天然化学活性化合物,例如紫草素、七叶皂苷、双氢青蒿素、姜黄素、厚朴酚等都可通过调控NF-κB抑制细胞增殖并诱导细胞凋亡。在细胞质中活化的NF-κB可以转运到细胞核中并与DNA序列中的特定反应元件结合,并控制与凋亡有关的基因表达〔20〕。本研究结果说明,金丝桃苷可能通过抑制PI3K/Akt/NF-κB信号通路来发挥抗肿瘤作用。
