基于NLRP3/caspase-1通路沉默I-Aβ1基因对肾小球肾炎系膜增殖的影响
2023-10-08董丽娜刘国平刘艾芹于磊
董丽娜 刘国平 刘艾芹 于磊
(内蒙古自治区人民医院肾脏内科,内蒙古 呼和浩特 010017)
肾小球肾炎是一类常见的肾脏炎症类疾病,其中依据病理类型又可分为膜性肾小球肾炎、系膜增生性肾小球肾炎等,且大多数患者治疗后预后性较差〔1,2〕。近年来肾小球肾炎发病年龄逐渐降低,其发病率逐年加剧升高,严重危害着患者的身心健康〔3~6〕。肾小球肾炎特点是发病快,前期大多主要表现为上呼吸道感染,随后表现为无症状性血尿等症状,严重者可发展为肾病综合征〔7~9〕。肾小球肾炎是根据病理检查、病理形态学诊断的肾炎,是一种以弥漫性肾小球系膜细胞增生和多种程度系膜基质增多为特征的肾脏类炎症〔10〕。NOD受体(NLRP)3是近些年新出现的有关基因表达调控的信号通路,在炎症的发生、发展过程中起着明显的控制作用〔11〕。NLRP3的激活是肾小球肾炎病理过程中的重要步骤,研究NLRP3对于治疗肾小球肾炎具有重要意义。半胱氨酸天冬氨酸蛋白水解酶(caspase)-1是半胱氨酸蛋白酶家族中的一种,其存在于人体各种细胞质当中,其起着监督炎症发生、监测细胞死亡的作用〔12〕。caspase-1是一种重要的转录因子,病理反应主要是提高炎性因子分泌量,使患者病情加重。基于上述研究背景,在本文研究中基于NLRP3/caspase-1信号通路研究沉默免疫应答基因(I-Aβ1)是否会优化肾小球肾炎,对肾小球肾炎系膜细胞的增殖功能产生了如何影响,以便为诊断、控制、预防肾小球肾炎提供理论参考。
1 对象与方法
1.1材料 研究细胞:人系膜增生性肾小球肾炎细胞(MsPGN),购自上海雅吉生物科技有限公司,货号:E01666,本研究操作已获医院伦理委员会审批同意,且严格按照伦理要求相关规定进行。主要试剂:RPMI1640由上海吉至生化科技有限公司提供,货号:A90022S;胎牛血清由上海江林生物科技有限公司提供,货号:10270-106;I-Aβ1基因由上海彩佑实业有限公司提供,货号:YS-2191F;Trizol试剂由武汉纯度生物科技有限公司提供,货号:CD-102523GM;磷酸盐缓冲液(PBS)由上海广锐生物科技有限公司提供,货号:PR694;NLRP3抗体由武汉菲恩生物科技有限公司提供,货号:FNab10120;caspase-1抗体由武汉益普生物科技有限公司提供,货号:ATA25867。
1.2方法
1.2.1肾小球肾炎MsPGN细胞培育 先用双抗的RPMI1640、12%胎牛血清完全培养基,保存温度为37 ℃培养已购买的人系膜增生性肾小球肾炎MsPGN细胞,每隔4 d替换新鲜培养液,当细胞融合度达到在72%以上时,开始传代培养。选择人系膜增生性肾小球肾炎MsPGN细胞,并分为对照组、过表达组、沉默组。
1.2.2肾小球肾炎MsPGN细胞内I-Aβ1指标转染 对照组不做处理,过表达组转染I-Aβ1模拟物(mimics)上调载体,沉默组转染I-Aβ1抑制剂(inhibitor)下调载体。I-Aβ1 mimics序列:上游引物5′-CAUUGCACUUGUCUCGGUCUGA-3′,下游5′-AGACCGAGACAAGUGCAAUGUU-3′;I-Aβ1 inhibitor序列:上游引物5′-UAUUGCACUCGUCCCGGCCUCC-3′,下游5′-AGGCCGGGACGAGUGCAAUAUU-3′,在转染过程中,每组培养基浓度均保持在120 nmol/L。
1.2.3肾小球肾炎MsPGN细胞内I-Aβ1指标检测 采用实时荧光定量PCR法检测I-Aβ1指标。选取转染72 h对照组、过表达组、沉默组I-Aβ1细胞,并用Trizol试剂提取,将采集到的总RNA通过逆转录合成cDNA,配制反应体系需选用各组2 μl的RNA样本,0.78、1.23、4.56、0.27 μl的RNA的反转录(RT)、脱氧核苷酸三磷酸酯(dNTPs)、5 ml缓冲液、逆转录酶(MMLV),保持在15 ℃下,35 min。组建RT-PCR体系,其中包含1.33 μl、7.67 μl、1.2 μl、0.1 ml的无核酸酶水、cDNA、引物、探针混合物及通用混合物,小核RNA作为内部。其中,I-Aβ1序列:上游引物5′-GGGCGGAATTGCACTTGTC-3′,下游5′-CTCAACTGGTGGTGTCGTGGAGTC-3′,反应20 min,保持温度在80 ℃,接着50 ℃下反应10 min,循环40次,记录数值,即为I-Aβ1表达量。
1.2.4双荧光素酶报告基因实验 采用Targetscan靶基因软件利用荧光素酶系统分析I-Aβ1和NLRP3/caspase-1信号通路的关系,检测荧光素酶活力,将组建的NLRP3/caspase-1野生型与NLRP3/caspase-1突变型的双荧光素酶报告载体均与I-Aβ1 mimics、I-Aβ1 inhibitor一起转染到放置肾小球肾炎细胞的培养皿中,经转染2 d后,采集细胞,并在室温下,进行裂解,加入荧光素酶底物,其中,内参为荧光素酶活性,读取、记录荧光素酶活性数值。
1.2.5检测肾小球肾炎系膜细胞增殖、凋亡方法 使用MTT法检测肾小球肾炎系膜细胞增殖率,每个组胰酶进行分解,形成单细胞悬液,离心7 min,丢弃上清液,使用5 ℃的洗液,洗涤2次。取配制的单细胞悬液,加0.23 ml、0.5 ml的噻唑蓝(MTT)、70%乙醇,在-24 ℃下固定,并在5 ℃下,放置12 h并离心9 min,洗液洗涤3次,置于无光环境下,用碘化丙啶液染色,用SpectraMax Paradigm卡盒式多功能酶标仪(美谷分子仪器有限公司 上海)测定OD值,计算增殖率。用Agilent NovoCyte 流式细胞仪(安捷伦科技公司 美国)检测肾小球肾炎系膜细胞凋亡率。
1.2.6检测肾小球肾炎MsPGN细胞迁移、侵袭 使用Transwell小室检测每组肾小球肾炎MsPGN细胞侵袭数,培养板置于Transwell小室,下室倒入120 ng/ml反应溶液、上室倒入细胞悬液、静放2 d,用三羟甲基丙烷溶液对培养板进行处理,PBS洗涤5次,每次洗涤5 min,固定并用苏木素染色,洗涤后显微镜下观察上室细胞数,记录6个视野内细胞数的平均值,重复4次,取MsPGN细胞侵袭数平均值。用划痕实验检测MsPGN细胞迁移数,选取MsPGN细胞用胰蛋白酶分解,获取细胞悬液接种到6孔板上,并用0.013 ml移液器枪头将全部单层MsPGN细胞,从上至下画一条划痕,用PBS洗涤刮下细胞,向干净培养基中加入3 ml的溶液,37 ℃下培育30 h,弃去培养液,显微镜下观察并记录4个视野平均值,重复4次,取MsPGN细胞迁移数平均值。
1.2.7检测NLRP3/caspase-1信号通路表达量方法 采用Western印迹法检测NLRP3/caspase-1信号通路表达量。选取系膜细胞,采集20 μg蛋白质样本,电泳95 min,转移到聚偏氟乙烯(PVDF)膜,室温下,封闭处理,添加1∶1 500的TBST供给稀释的NLRP3一抗,使用浓度为0.08%的辣根过氧化氢酶标记caspase-1二抗,于室温下培育,在避光环境下,采用电化学发光(ECL),进行显色30 min,然后采用LABWORK凝胶图像,进行扫描操作,获取胶片,计算NLRP3、caspase-1表达量。
1.3统计学处理 采用SPSS26.0统计软件进行独立样本t检验、F检验。
2 结 果
2.1I-Aβ1转染效率分析 如表1所示,与对照组比较,过表达组I-Aβ1表达量升高及沉默组I-Aβ1表达量降低,具有统计学差异(P<0.05);与过表达组比较,沉默组I-Aβ1表达量降低,具有统计学差异(P<0.05),说明I-Aβ1转染成功。
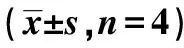
表1 各组I-Aβ1转染效率分析及系膜细胞增殖、凋亡率、MsPGN细胞迁移、侵袭数比较
2.2系膜细胞增殖、凋亡率 如表1所示,与对照组比较,过表达组24、48、72 h系膜细胞增殖率降低,凋亡率升高,沉默组24、48、72 h系膜细胞增殖率升高,凋亡率降低,具有统计学差异(P<0.05);与过表达组比较,沉默组24、48、72 h系膜细胞增殖率升高,凋亡率降低,具有统计学差异(P<0.05)。
2.3MsPGN细胞迁移、侵袭数 如表1所示,与对照组比较,过表达组MsPGN细胞迁移数、侵袭数增多,沉默组MsPGN细胞迁移数、侵袭数减少,具有统计学差异(P<0.05);与过表达组比较,沉默组MsPGN细胞迁移数、侵袭数减少,具有统计学差异(P<0.05)。
2.4双荧光素酶报告基因结果 如表2所示,双荧光素酶报告基因结果显示,与沉默组相比,过表达组NLRP3/caspase-1野生型荧光素酶活性升高,具有统计学差异(P<0.05);NLRP3/caspase-1突变型荧光素酶活性无统计学差异(P>0.05)。
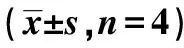
表2 两组荧光素酶活性比较
2.5NLRP3/caspase-1信号通路蛋白表达量分析 如表3所示,与对照组比较,过表达组NLRP3、caspase-1升高,沉默组NLRP3、caspase-1降低,具有统计学差异(P<0.05);与过表达组比较,沉默组NLRP3、caspase-1降低,具有统计学差异(P<0.05)。
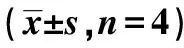
表3 各组NLRP3/caspase-1信号通路蛋白表达量比较
3 讨 论
临床研究证实〔13〕,I-Aβ1基因可以调节人体大约1/4微小RNA表达,其中I-Aβ1在肾小球肾炎、肾结石、肾动脉狭窄等疾病呈现异常,同时与炎症的出现、进展、增加、迁移有着密切联系。I-Aβ1参加肾小球肾炎细胞的发展、产生、侵袭及迁移过程,多种肾脏类疾病与其表达水平关系密切,如在肾萎缩中,经下调I-Aβ1水平增强肾脏稳态健康细胞的抗凋亡、侵袭、迁移能力。I-Aβ1经靶向刺激肾小球肾炎细胞大面积转移、增殖,也可通过沉默NLRP3/caspase-1信号通路蛋白表达,改变MsPGN细胞的迁移、侵袭速度,进而影响肾小球肾炎系膜细胞的增殖表现。本研究结果表示,沉默I-Aβ1基因可改变MsPGN细胞、系膜细胞的生物活性,当抑制I-Aβ1表达,MsPGN细胞的感染能力将会大幅度减弱,对患者病情治愈起到促进效果。
NLRP3信号通路可调控多数炎性因子、逆序靶基因的活性,刺激炎症相关的细胞活化,致使转录因子加速诱导细胞增殖、分化、转移、侵袭能力,增强细胞抗凋亡作用。有研究证实〔14~16〕,NLRP3信号通路参加炎症有关调控,经常与促炎性因子、I-Aβ1基因等表达物质相互反应,使炎性因子分泌增加,进而加快疾病进展。NLRP3信号通路调控靶基因细胞周期蛋白失常,可对肾小球肾炎MsPGN细胞转移进行预测,起到对肾脏类疾病的预测作用〔17~19〕。本研究结果表示,NLRP3信号通路通过与细胞膜受体结合,刺激受体蛋白,影响炎症细胞的分解,改变肾小球肾炎疾病进展。NLRP3信号通路可通过与I-Aβ1基因反应,刺激健康稳态细胞信号传导,发挥调控细胞分化、增殖的极性作用。临床可调控NLRP3信号通路蛋白表达,从而实现控制肾小球肾炎MsPGN细胞的各项能力,加速患者病情治愈。
研究证实〔20~22〕,caspase-1分布于除红细胞外的各种细胞中,其本身是半胱氨酸蛋白酶家族的一种,形态以酶原形式存在,在肾小球肾炎细胞中起着引诱炎症发生、促进健康稳态细胞死亡等功能。通过本研究可发现,caspase-1、NLRP3两者互相协调,两者兼具促炎性。caspase-1可通过对炎性因子控制,影响患者肾小球肾炎疾病发展,同时破坏着患者肾小球肾炎系膜细胞的存活,严重影响着患者肾脏系膜细胞的增殖率〔23〕。caspase-1信号通路表达升高能促进病毒感染情况下免疫逃逸,因而判定caspase-1信号通路能降低肾脏中健康稳态细胞效应功能,成为MsPGN细胞的一种逃逸方式,进而影响肾小球肾炎的治疗进展。本研究结果表示,NLRP3/caspase-1信号通路影响着肾小球肾炎的进程,NLRP3/caspase-1信号通路对肾小球肾炎耐受机制提供了临床研究线索,对肾小球肾炎的治疗、联合治疗具有重要意义。虽然本研究认为,沉默I-Aβ1基因可改变肾小球肾炎系膜增殖情况,但目前临床上并未有研究经其应用于肾小球肾炎NLRP3/caspase-1信号通路的研究中,因此上述研究需后续研究进一步分析验证。
综上所述,基于NLRP3/caspase-1信号通路中的I-Aβ1基因互相表达、呈紧密联系,其对肾小球肾病细胞增殖、凋亡、迁移、侵袭等各项指标起到明显的调节作用,通过调控NLRP3/caspase-1信号通路表达,从而使肾小球肾病炎症细胞凋亡,优化系膜细胞增殖表达,为临床诊治肾小球肾病提供理论依据。
