再生水补水对城市河流水体细菌群落的影响研究
2023-10-07刘德荣闻钟
刘德荣 闻钟


摘 要:为了探明再生水补水对河流水体细菌群落结构的影响,以珠江某支流再生水补水河段为例,基于Illumina Miseq 测序平台探究河流水体不同空间细菌群落结构的差异,并借助单因素方差分析、Spearman 相关分析和典型对应分析(CCA) 方法分析河流水体细菌群落结构空间差异的形成原因。结果表明:再生水补水对河流水体细菌群落结构具有显著影响;河流各采样点优势门类菌群均为变形菌门,相对丰度为68%~82%,上游采样点T1、T2 的优势菌属为黄杆菌属,中游采样点T4、T5、T6 的优势菌属为热单胞菌属,下游采样点T7 和T8 的优势菌属分别为毛螺菌属和陶厄氏菌属;NH+4 -N、TN 和TP 等是采样点T1 和T2 水体中黄杆菌属的主要负影响因子,是采样点T4、T5 和T6 水体中热单胞菌属的正影响因子;pH 值和TDS 是影响水体毛螺菌属的主要因子,TN 和TP 是影响陶厄氏菌属的主要因子;再生水中碳、氮、磷和有机物含量高是补水口附近细菌具有丰富群落结构的直接原因。
关键词:再生水;城市河流;细菌;群落结构;环境因子
中图分类号:X522 文献标志码:A doi:10.3969/ j.issn.1000-1379.2023.10.018
引用格式:刘德荣,闻钟.再生水补水对城市河流水体细菌群落的影响研究[J].人民黄河,2023,45(10):101-105,117.
再生水在缓解城市水资源供需矛盾的同时,改变了河流水体水质特性、生态水文过程,促进了污染物的迁移和转化,进而产生了多种生态环境效应[1-3] 。再生水中多种形态的氮素和有毒物质是影响河流水体细菌群落结构的关键因素,尤其影响补水口附近细菌丰度,进而致使水体中细菌在空间尺度上存在明显差异[4] 。目前,关于再生水补水对底泥、植物根际细菌群落结构的影响已有较多研究[5-6] 。然而,关于再生水补水对河流水体细菌群落结构的影响鲜有报道。本研究联合T-RFLP 技术和16S RRNA 基因克隆文库技术对再生水补水河流水体细菌群落多样性及结构组成进行解析,采用实时荧光定量核酸扩增检测方法探讨再生水补水口及上下游水体细菌群落差异,揭示导致细菌群落结构产生空间变异的污染物及关键环境要素,以及对关键环境要素起降解作用的优势菌,以期为河流水环境改善和维护提供科学依据。
1 材料与方法
研究河流位于广东省西部,生态景观再生水补水工程于2019 年3 月建成,再生水补水段全长约8.05km。研究区位于热带气候边缘,年平均气温22 ℃,年平均降水量约1 600 mm,年降水总量的80%集中在4—10 月。研究河流补给水源主要为再生水、大气降水和上游水库生态下泄水,其中共设有上下游两个常态化再生水补水口(间隔约5 km),上游日补水量约4万m3,下游日补水量约5 万m3,补水水质为Ⅴ类水。研究河流通过雨污分流、控源截污、生态补水及生态修复等措施较大程度解决了水体污染问题,基本消除了外源污染,水体水质主要受再生水及降水影响。
1.1 样品采集与处理
2019 年9 月在补水口上下游布设8 个采样点,每个采样点均采集3 个平行样,采样点布设示意见图1。
采用有机玻璃采样器在水面下1/4 水深处采集水样,单个采样点采集约1 L 水样,置于干净无菌有机玻璃瓶中,对样品编号后带回实验室。样品分为两部分,一部分水样用0.22 μm 滤膜过滤,截留物用于生物分析;另一部分水样进行水质常规检测,其中总有机碳(TOC) 采用总有机碳分析仪(TOC-90) 测定,氨氮(NH+4 -N)、总氮(TN)、总磷(TP)采用紫外可见光分光光度计测定,硝酸盐及亚硝酸盐采用离子色谱仪(ICS- 90) 测定,溶解性总固体(TDS) 采用质量法测定。
1.2 细菌DNA 提取及PCR 扩增
水样中细菌DNA 采用Power Water DNA Isolationkit 试剂盒提取。提取并纯化后的DNA 样品采用荧光光谱仪、凝胶电泳仪和TBS380 微型荧光计等测定污染物浓度和纯度,浓度和纯度达到PCR 扩增及基因测序要求,DNA 样品储存温度为-20 ℃。以提取的DNA为模板,进行PCR 擴增,并使用磁珠法纯化,对纯化后的PCR 产物进行Qubit 定量。按照PCR 产物的浓度进行等量混样,在Illumina Miseq 测序平台测序。
1.3 数据分析
通过Illumina Miseq 测序平台对采集的水样进行细菌多样性检测,采用Vsearch 软件,根据序列的相似性,以97% 的序列相似度进行可操作性分类单元(OTUs)划分,获得OTUs 数量。根据OTUs 的数量、韦恩图以及α-多样性指数进行生物多样性分析,采用不同水平细菌群落结构柱状图进行细菌群落结构分析。另外,利用CANOCO 5.0 软件对细菌及水质数据进行典型对应分析(CCA)及Spearman 相关性分析。
2 结果与分析
2.1 河流水质现状
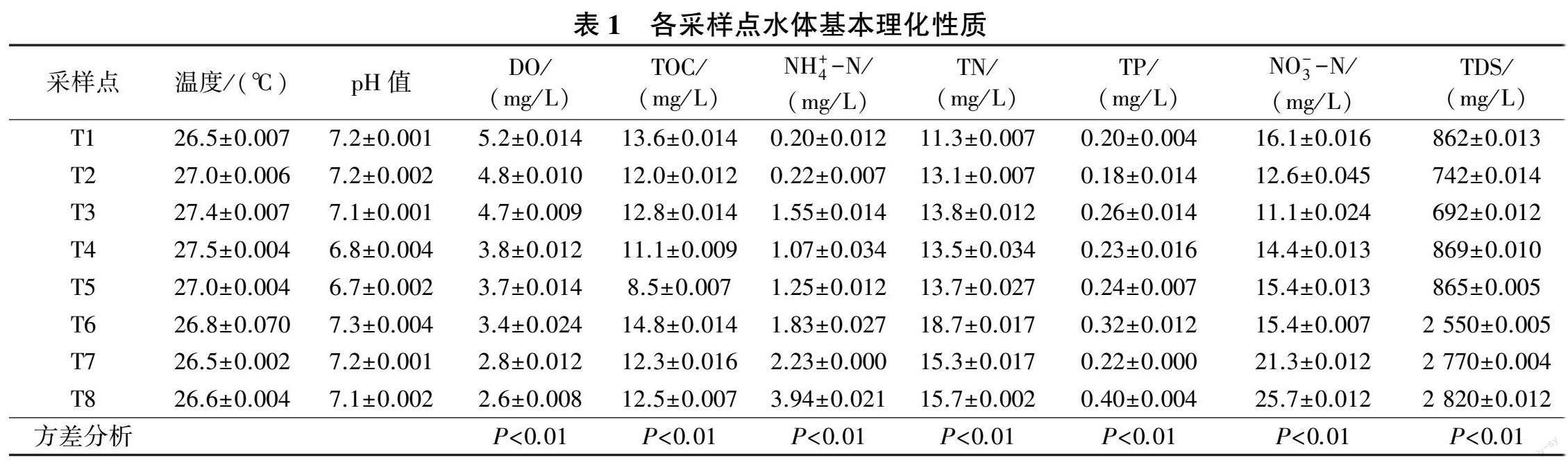
基于8 个采样点水样的理化参数,采用SPSS 21.0软件对河流水体水质指标进行单因素方差分析。各采样点水体基本理化性质见表1(其中P<0.01 表示各采样点具有显著性差异)。
水体呈中性或弱碱性,采样点T7、T8 的NH+4 -N质量浓度大于2.0 mg/ L,高于Ⅴ类水标准。另外,由于再生水中含有丰富的营养物质,因此补水口采样点T6营养盐含量明显增大,而采样点T5 受补水冲击影响营养盐含量变化不大,采样点T6 的TOC、NH+4 -N、TN 质量浓度较采样点T5 的分别增加74. 1%、46. 4%、36.5%。下游接近珠江口处采样点T6、T7、T8 的TDS含量比中上游的高2 倍多,可能原因是下游为感潮河段,受珠江水顶托影响,大量溶解性固体被带到河流水体。
2.2 细菌多样性分析
对所采集水样进行测序,以97%的序列相似度对得到的基因序列进行OTUs 划分,各采样点OTUs 数量和多样性指数见表2。8 个采样点的OTUs 数为11 897个,单个采样点OTUs 数为1 269~1 688 个,所有采样点相同的OTUs 数为590 个,占总OTUs 数的5%,表明该河流8 个采样点细菌群落结构组成差异性较为显著。
各样本文库DNA 与数据库对比覆盖度为97.20% ~98.65%,平均为98.14%,表明测序深度可以真实反映该河流水体中细菌群落的情况。Chao1 指数在生态学中通常用来估计物种总数,由Chao1 指数可知,除采样点T5 外,补水口处(采样点T1、T6、T7、T8)细菌丰度较大。其原因是再生水中有多种有机元素,为细菌的生长提供了营养物质,而采样点T5 距离补水口太近,水体流动性强,不利于细菌种群生存。8 个采样点的辛普森指数为0.96 ~0.99,香农多样性指数为7.58 ~8.73,其中除采样点T5 外,补水口处两种指数值较大,说明补水口处水体较其他水体具有更丰富的群落结构。
2.3 细菌群落结构空间分布特征
再生水补水致使河流水体细菌种类和丰度具有明显异质性,且各采样点水体细菌群落结构在门的水平上具有多样性。细菌门类为30 种,其中变形菌门(Proteobacteria)的相对丰度(68% ~82%)显著高于其他门类的,属于优势菌群;其他主导菌群有拟杆菌门(Facteroidetes,相对丰度18% ~27%)、放线菌门(Acti?nobacteria,相对丰度3% ~10%)、厚壁菌门(Firmicutes,相对丰度0.5% ~2%)和蓝细菌门(Cyanobacteria,相对丰度0.5%~1%),这与水环境的细菌群落丰富度基本相似。
在门分类水平上,采样点T1~T8 细菌群落丰度分布存在一定相似性。8 個采样点变形菌门属于绝对的优势菌群,变形菌门类细菌可以去除水体中磷,还可以将亚硝酸盐转化为硝酸盐,在水体氮素循环转化过程中起重要作用[7] 。河流经过整治及补水后,水质较好,水体中检测到了大量拟杆菌门类细菌,此类细菌属于革兰阴性菌,在恶劣环境中耐受性较差,而在水质较好的水体中大量生存。另外,各采样点,次优势菌还有放线菌门、厚壁菌门和蓝细菌门,其中放线菌门类细菌对有机物质具有良好的代谢功能,可以促进河流水体净化及水环境修复[8] ;厚壁菌门类细菌在污水处理厌氧系统中大量存在,可以较好地处理有机物,再生水补水将污水处理厂生物处理中的细菌携带到河流水体中,因此补水口附近厚壁菌门类细菌的丰度比其他采样点的高,在河流中起二次降解有机物的作用;蓝细菌门是水体富营养化的主要指示生物之一[9] ,在河流入珠江口处蓝细菌门丰度较高,说明此处存在潜在富营养化风险,其主要原因是入海口处水体流动性弱,且有珠江水中营养物质倒灌河流,水体再度恶化风险较高。这些细菌的分布主要与河流补水水质及环境状况有关。
在属分类水平上,对相对丰度排前位30 位的菌属进行分析。各采样点菌属存在一定差异,从优势菌属来看,采样点T1、T2 的优势菌属为黄杆菌属(Flavobac?___6__?H%_terium),占比分别为6%、8%,此菌属为反硝化细菌,可以将水体中的硝酸盐转化为氮气,降低水体中硝酸盐浓度[10-12] ;采样点T4、T5、T6 的优势菌属为热单胞菌属(Thermomonas),占比分别为2%、5%、3%,其主要来源于污水处理厂的活性污泥;采样点T7、T8 的优势菌属分别为毛螺菌属( Lachnospira ) 和陶厄氏菌属(Thauera)。除了优势菌属外,其他主要菌属差异较大。红细菌属(Rhodobacter)为8 个采样点共有的主要菌属,其丰度在整个河流水体中占比较大。另外,采样点T1、T2 的主要菌属还包括噬氢菌属(Hydrogenopha?ga)、砂单胞菌属(Arenimonas),不同水样中的优势菌属、主要菌属均不同。
2.4 细菌群落与关键环境因子相关性分析
基于河流水体菌属及水质数据,对菌属与水体理化数据进行主成分分析(PCA)及Spearman 相关性分析,探究再生水补水对河流水体细菌的环境影响。由图2 可知,绝大多数菌属解释显示在PC1 轴上,PC1轴解释总变异的83.7%,PC2 轴解释总变异的13.6%。采样点T8 与其他采样点的细菌群落为互异点,主要原因是T8 受感潮影响较大,采样点T4、T5、T6 细菌群落具有较高相似度,采样点T1、T2 细菌群落结构也具有较高相似度。水体理化性质与细菌群落有较大关联,采样点T4、T5、T6 红细菌属和采样点T8 陶厄氏菌属与无机氮含量具有显著相关性,这两种菌属均属于反硝化细菌,对降低无机氮含量有一定促进作用[13] ;pH值、TDS、TOC 是采样点T7 细菌群落的主要影响因子。
由主要菌属与环境因子Spearman 相关性分析(见表3)可知,河流水体各采样点细菌菌属受水体理化性质影响差异性较大。水体噬氢菌属除与温度正相关外,与其他环境因子均负相关;采样点T1、T2 优势菌属黄杆菌属与NO-2 -N、DO 正相关,但相关性较弱,与NH+4 -N、TN、TP 等负相关,且相关性较强,说明NH+4 -N、TN 和TP 等对采样点T1、T2 的黄杆菌属有抑制作用;采样点T4、T5、T6 的优势菌属热单胞菌属主要受NH+4 -N、TN、TP 的影响,与其正相关,且相关性较强,说明NH+4 -N、TN、TP 对采样点T4、T5、T6 的热单胞菌属具有促进作用;采样点T7 优势菌属毛螺菌属和采样点T8 优势菌属陶厄氏菌属受pH 值、DO、TOC、NH+4 -N、TN、TP、TDS 等的影响,其中pH 值和TDS 是毛螺菌属的主要环境影响因子,TN 和TP 是陶厄氏菌属的主要环境影响因子。说明在不同水环境下细菌受环境因子的影响具有明显差异性。
3 讨论
3.1 再生水补水对河流水体细菌多样性的影响
细菌菌群种类和数量与水体水质直接相关[14-15] 。引再生水补水河段水体有机物含量大幅增加,无机离子相对减少,水体环境变化较大,细菌菌群种类及其群落结构在空间上具有明显差异[16-17] 。根据多样性分析结果,补水口处采样点T1、T6、T7、T8 的Chao1 指数、辛普森指数、香农多样性指数较大。随着离补水口距离越来越远,再生水对水体细菌多样性的影响减小。另外,细菌群落结构中的优势菌属及主要菌属与再生水水质密切相关,在再生水作用下补水口处具有较高的克隆文库覆盖度和较丰富的细菌群落结构,说明再生水对补水口处细菌群落结构的影响极为显著,与细菌多样性指数计算结果一致。由于再生水中的碳、氮、磷、有机质等营养物质可以促进水体中细菌的生长和繁殖,因此再生水中的无机元素和有机质是补水口处细菌多样性、丰富细菌群落结构产生的直接原因[18] 。沿着水流方向,采样点T2~T5 细菌多样性和相对丰度呈下降趋势,下游(T6~T8)细菌多样性和相对丰度相对上游增大,其主要受补水水质和珠江口处潮水顶托影响。受潮水顶托影响,珠江水倒灌入河,大量底泥及珠江水中的悬浮物进入河流,导致河流水体TDS 急剧升高,进而提高了水体中细菌多样性和相对丰度。
3.2 再生水补水对河流水体细菌的环境影响
细菌群落结构的变化是碳、氮、磷和有机物等物质自然循环转化的结果,并在物质降解过程中发挥着重要作用[19] 。营养物质在环境中的迁移、转化致使细菌群落结构在时空上存在显著差异[20] 。再生水中含有多种形态的氮素,这对补水口处植物根际的硝化、反硝化和氨化过程具有促进作用。补水口处占克隆文库21.3%的红细菌属和陶厄氏菌属克隆与水环境中氮素有关,这两种NIRs 型反硝化细菌对补水口处硝酸盐的降解起重要作用[21] 。氮素通过生物固氮作用(植物根际固氮)进入生物圈,并由反硝化作用重新回到大气中,实现氮素循环[22] 。本研究中,补水口水体中30%的主要菌属与硝态氮的反硝化作用有关,红细菌属和陶厄氏菌属均可还原硝酸盐。采样点T1、T2 的优势菌属黄杆菌属,占比分别为6%、8%,T8 中的陶厄氏菌属占比3.4%,都具有很强的脱氮功能。
再生水含有污水处理厂处理后残留的病原菌和抗生素等,其对细菌群落产生负面影响[23] 。受再生水补水影响, 河流检测到大量苯基杆菌(Phenylobacterium)、管道杆菌属(Cloacibacterium)和假单胞菌(Pseudomonas)等,且补水口附近占比较大。补水口丰富的有机质为该类细菌的生长提供了良好的环境条件。在水体中植物根际固氮主要受伯克氏菌属(Burkholderia)等共生固氮作用影响,而本文补水口附近固氮作用主要通过红细菌属、陶厄氏菌属还原作用和植被光合作用来实现[6] 。
4 结论
在再生水补水作用下,研究河流水体中细菌具有丰富的群落结构,且不同空间水体细菌群落结构差异显著。在门的水平上,河流8 个采样点优势菌群为变形菌门,相对丰度为68%~82%。在属分类水平上,采样点T1、T2 的优势菌属为黄杆菌属,占比分别为6%、8%;采样点T4、T5、T6 的优势菌属均为热单胞菌属,占比分别为2%、5%、3%;采样点T7、T8 的优势菌属分别为毛螺菌属和陶厄氏菌属。红细菌属为8 个采样点共有的主要菌属。
河流各采样点细菌受水体理化性质影响差异较大。NH+4 -N、TN 和TP 等对采样点T1、T2 中的黄杆菌属有抑制作用,而对采样点T4、T5 和T6 中热单胞菌属具有促进作用。pH 值和TDS 是水体主要菌属毛螺菌属的主要环境影响因子,TN 和TP 是陶厄氏菌属的主要环境影响因子。河流水体中优势菌属及主要菌属与再生水水质密切相关,再生水中碳、氮、磷和有机物含量高导致补水口细菌类群显著增多,是补水口细菌具有丰富群落结构的直接原因。
参考文献:
[1] 刘川,闫金霞,刘家乐,等.青龙湖浮游植物群落与环境因子相关性分析[J].人民黄河,2021,43(7):104-109.
[2] 王帅帅,韩晓,刘麟菲,等.黄河干流济南段浮游植物与环境影响因子研究[J].人民黄河,2021,43(2):95-99.
[3] 赵阳国,任南琪,王爱杰,等.有机污染物对水体真细菌群落结构的影响[J].微生物学报,2007,47(2):313-318.
[4] 邸琰茗,王广煊,黄兴如,等.再生水补水对河道底泥细菌群落組成与功能的影响[J].环境科学,2017,38(2):743-751.
[5] 黄兴如,张琼琼,张瑞杰,等.再生水补水对河流湿地香蒲根际细菌群落结构影响研究[J].中国环境科学,2016,36(2):569-580.
[6] 马栋山,郭羿宏,张琼琼,等.再生水补水对河道底泥细菌群落结构的影响[J].生态学报,2015,35(20):6742-6749.
[7] CHEN T,PENG T,FENG C P,et al.The Feasibility of anUpflow Partially Aerated Biological Filter(u-Pabf) for Ni?trogen and Cod Removal from Domestic Wastewater [ J].Bioresource Technology,2016,218:307-317.
[8] 王俊华,冯贵颖,唐艳,等.放线菌处理皂河水体的应用研究[J].西北农业学报,2007,16(1):82-86.
[9] 陈丙法,冯慕华,尚丽霞,等.聚积蓝藻不同打捞强度下藻源污染物释放特征研究[J]. 环境科学学报,2016,36(11):4077-4086.
[10] 洪璇,洪有为,陈仲巍,等.九龙江河口区nirS 型反硝化细菌多样性及系统发育学分析[J]. 微生物学通报,2015,42(9):1639-1650.
[11] 王春香,刘常敬,郑林雪,等.厌氧氨氧化耦合脱氮系统中反硝化细菌研究[J].中国环境科学,2014,34(7):1878-1883.
[12] 程建华,窦智勇,孙庆业.铜陵市河流沉积物中硝化和反硝化微生物分布特征[J].环境科学,2016,37(4):1362-1370.
[13] 赵昕燕,卞伟,侯爱月,等.季节性温度对短程硝化系统微生物群落的影响[J].中国环境科学,2017,37(4):1366-1374.
[14] HENRIQUES I S,ALVES A,RACO M,et al. Seasonal andSpatial Variability of Freeliving Bacterial Community Composi?tion Along an Estuarine Gradient(Riade Aveiro,Portugal)[J].Estuarine,Coastal and Shelf Science,2006,68(1-2):139-148.
[15] LAQUE T,FARJALLA V F,ROSADO A S,et al.Spatiotem?poral Variation of Bacterial Community Composition andPossible Controlling Factors in Tropical Shallow Lagoons[J].Microbial Ecology,2010,59(4):819-829.
[16] 李虎,黄福义,苏建强,等.浙江省瓯江氨氧化古菌和氨氧化细菌分布及多样性特征[J].环境科学,2015,36(12):4659-4666.
[17] 曹新垲,杨琦,郝春博.厌氧污泥降解萘动力学与生物多样性研究[J].环境科学,2012,33(10):3535-3541.
[18] 龚雪,王继华,关健飞,等.再生水灌溉对土壤化学性质及可培养微生物的影响[J].环境科学,2014,35(9):3572-3579.
[19] 王彩霞,王毅波,刘鹏远,等.渤海三湾表层水域细菌群落结构多样性及其环境因子分析[J].微生物学通报,2018,45(9):1956-1971.
[20] 李玉华,许其功,赵越,等.松花湖水体中不同空间分布的细菌群落结构分析[J].农业环境科学学报,2013,32(4):764-770.
[21] 陈兆进,丁传雨,朱静亚,等.丹江口水库枯水期浮游细菌群落组成及影响因素研究[J].中国环境科学,2017,37(1):336-344.
[22] PHILIPPOT L,PIUTTI S,MARTIN?LAURENT F,et al.Mo?lecular Analysis of the Nitrate?Reducing Community fromUnplanted and Maize?Planted Soils[J].Applied and Envi?ronmental Microbiology,2002,68(12):6121-6128.
[23]GELDREICH E E,LITSKY W.Fecal Coliform and FecalStreptococcus Density Relationships in Waste Dischargesand Receiving Waters[J].CRC Critical Reviews in Envi?ronmental Control,1976,6(4):349-369.
【责任编辑 吕艳梅】
