苍术素调节Notch信号对EGFR-TKI耐药的非小细胞肺癌细胞株H1975增殖、凋亡的影响
2023-10-07张琳朱琳李晨
张琳 朱琳 李晨
肺癌仍是全世界范围内发病率和死亡率最高的恶性肿瘤,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)占大多数[1]。虽然在过去的十年中,NSCLC在筛查、诊断和治疗方面均取得了显著进展,但由于NSCLC早期症状不典型,多数患者确诊时已处于疾病晚期,无法进行手术治疗,导致患者生存时间仍较短[2-3]。另外,随着表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor,EGFR-TKI)的上市,尽管EGFR突变的晚期NSCLC患者治疗疗效有所提高,但耐药成为了EGFR-TKI治疗的瓶颈,绝大部分患者经一线治疗后数月即出现疾病进展[4-5]。因此,开发新的治疗药物以降低EGFR-TKI耐药性是NSCLC患者有效治疗的关键,也是目前NSCLC治疗的热点和难点问题。近年来,天然中草药因其高效、低毒等优势而在各个研发领域广受欢迎。苍术素作为茅苍术根茎所含精油中的一种活性成分,其抗肺纤维化[6]、抗炎[7]、抗癌[8]等作用已被报道。然而,苍术素对EGFR-TKI耐药NSCLC的作用及分子机制尚不明确。此外,已有研究表明在EGFR-TKI治疗下EGFR突变肺腺癌的Notch改变可导致组织学小细胞癌转化[9];在EGFR-TKI治疗后,一半EGFR突变的NSCLC肿瘤组织中Notch1和HES1上调,且Notch抑制剂可削弱体外和体内奥希替尼(三代EGFR-TKI)耐药性,并表明Notch抑制剂和奥希替尼联合可能是EGFR突变NSCLC的潜在治疗方法[10]。基于此,本研究以人肺腺癌细胞H1975为研究对象,探讨苍术素对EGFR-TKI耐药的NSCLC细胞增殖、凋亡的影响以及Notch信号通路在此过程中的作用。
资料与方法
一、主要材料
1 实验细胞 人NSCLC细胞系H1975细胞(人肺腺癌细胞,ATCC-172)、人正常肺上皮细胞BEAS-2B(ATCC-539)来源于美国ATCC公司。将H1975细胞重悬于含10%胎牛血清和1%双抗(青霉素和链霉素)的RPMI-1640培养基中,置于37℃,5% CO2培养箱中培养,待细胞融合度达到80%左右时进行消化传代,2~3 d换液一次,取对数生长期细胞进行后续实验。
2 主要试剂 苍术素(纯度:HPLC≥98%,B20128-20 mg)购自上海源叶生物科技有限公司;Notch抑制剂1(一种Notch抑制剂,纯度99.81%,HY-12860)购自美国MCE公司;MTT试剂(FS-RT2568)、BCA蛋白浓度测定试剂盒(FS-E9680)购自上海抚生实业有限公司;膜联蛋白V(Annexin V)-异硫氰酸荧光素(FITC)/碘化丙啶(PI)双染细胞凋亡检测试剂盒(FY600003-20T)购自上海弗元生物科技有限公司;cDNA链合成试剂盒(XY-PCR-1590)购自上海烜雅生物科技有限公司;TRIzol试剂(LM-0010)、荧光定量PCR MasterMix(SYBR Green)(LM-0017)、RIPA裂解液(LM801001C)购自上海酶联生物工程有限公司;ECL发光试剂(WBKlS0100)购自美国Millipore公司;兔源一抗Notch1(ab52627,1∶1 000)、Notch3(ab23426,1∶1 000)、Hes1(ab71559,1∶1 000)、HEY1(ab154077,1∶1 000)、β-actin(ab8227,1∶1 000)和二抗HRP标记羊抗兔IgG(ab205718,1∶3 000)购自英国Abcam公司。
二、实验方法
1 EGFR-TKI耐药细胞株构建 以人肺腺癌细胞H1975为亲本细胞,采用低浓度逐步加量诱导法构建EGFR-TKI耐药细胞株H1975/吉非替尼耐药(gefitinib resisitant,GR)[11],具体操作为:将处于对数生长期且生长状态良好的亲本细胞H1975接种于24孔板中,第1 d添加0.5 μmol/L吉非替尼,第2 d添加1.0 μmol/L吉非替尼,第3 d添加1.5 μmol/L吉非替尼,第4 d添加2.0 μmol/L吉非替尼,以后每天均添加2.0 μmol/L吉非替尼进行培养,直到添加吉非替尼后细胞不会出现死亡为止,此时说明EGFR-TKI耐药细胞株H1975/GR构建成功。
2 MTT法检测亲本细胞H1975和耐药细胞H1975/GR对吉非替尼的敏感性以及苍术素对H1975、H1975/GR细胞的毒副作用 将处于对数生长期的H1975和H1975/GR细胞以每孔5000个细胞接种于96孔板中(每孔100 μL),待细胞贴壁后添加不同浓度吉非替尼(终浓度为0、0.1、0.5、2.5、5.0、10.0、15.0、20.0、25.0、30.0 μmol/L),其中0 μmol/L吉非替尼处理组为对照组,在37℃、5% CO2培养箱中培养48 h后每孔添加20 μL MTT溶液(5 mg/mL),继续培养2 h后使用酶标仪检测各孔在490 nm波长处的吸光度值(OD490 nm),计算细胞存活率以及吉非替尼抑制细胞增殖的半数抑制浓度(IC50)。细胞存活率(%)=实验组OD490 nm/对照组OD490 nm×100%。
将处于对数生长期的BEAS-2B、H1975和H1975/GR细胞以每孔5000个细胞接种于96孔板中(每孔100 μL),待细胞贴壁后添加不同浓度苍术素(终浓度为0、10、20、40、60、80 μmol/L)[12],其中0 μmol/L苍术素处理组为对照组,常规培养48 h后每孔添加20 μL MTT溶液(5 mg/mL),继续培养2 h后使用酶标仪检测各孔的OD490 nm,计算细胞存活率。
3 细胞分组与药物干预 H1975/GR细胞分为正常组、苍术素(低、中、高)浓度组、Notch抑制剂组。其中,正常组细胞不添加任何药物;苍术素(低、中、高)浓度组细胞分别添加终浓度为20、40、60 μmol/L的苍术素;Notch抑制剂组细胞添加终浓度为7.8 nmol/L的Notch抑制剂1[13]。
4 MTT法检测各组H1975/GR细胞增殖活力 H1975/GR细胞以每孔5000个细胞接种于96孔板中(每孔100 μL),待细胞贴壁后按照实验方法3中分组与处理方法进行干预,常规培养24 h、48 h、72 h后每孔添加20 μL MTT溶液(5 mg/mL),继续培养2 h后使用酶标仪检测各孔的OD490 nm,并以OD490 nm表示细胞增殖活力。
5 流式细胞仪检测各组H1975/GR细胞周期分布 H1975/GR细胞以每孔5×105个接种到6孔板中(每孔2 mL),待细胞贴壁后按照实验方法3中方法干预,常规培养48 h收集细胞,并将细胞重悬于PBS溶液中,计数1×106个细胞,添加500 μL PI染色液室温避光染色20 min,使用流式细胞仪自带软件分析细胞周期。
6 流式细胞仪检测各组H1975/GR细胞凋亡率 H1975/GR细胞以每孔5×105个接种到6孔板中(每孔2 mL),待细胞贴壁后按照实验方法3中方法干预,常规培养48 h收集细胞,PBS洗涤后加入Annexin V-FITC结合液重悬细胞,随后加入5 μL Annexin V-FITC和10 μL PI染色液室温避光染色15 min,使用流式细胞仪自带软件分析细胞凋亡率。
7 qRT-PCR检测各组H1975/GR细胞中Notch信号通路相关基因表达水平 收集按照实验方法3中方法干预48 h后的各组H1975/GR细胞,TRIzol试剂提取细胞中总RNA,并按cDNA链合成试剂盒说明将RNA逆转录为cDNA,随后以cDNA为模板,将其与基因特异性引物(引物由上海吉玛制药技术有限公司设计并合成,引物序列见表1)和荧光定量PCR MasterMix(SYBR Green)等试剂相混合配制qRT-PCR反应体系,最后置于qRT-PCR仪上扩增。以GAPDH为内参,采用2-ΔΔCt法定量分析细胞中Notch1、Notch3、Hes1、HEY1 mRNA表达水平。

表1 引物序列信息
8 Western Blot检测各组H1975/GR细胞中Notch信号通路相关蛋白表达水平 收集按照实验方法3中方法干预48 h后的各组H1975/GR细胞,使用RIPA裂解液充分裂解提取细胞中总蛋白,BCA法测定蛋白浓度并加热煮沸使蛋白变性。通过SDS-PAGE电泳分离蛋白,并在切胶后将蛋白转移至PVDF膜,5% BSA室温封闭膜1 h,随后加入一抗(Notch1、Notch3、Hes1、HEY1、β-actin抗体)4℃冰箱中孵育过夜,PBST洗涤后加入二抗(HRP标记羊抗兔IgG)37℃培养箱中孵育45 min,ECL发光试剂显色。以β-actin为内参,Image J软件半定量分析蛋白条带灰度。
三、统计学方法
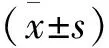
结 果
一、亲本细胞H1975和耐药细胞H1975/GR对吉非替尼的敏感性
与0 μmol/L吉非替尼比较,(2.5、5.0、10.0、15.0、20.0、25.0、30.0 μmol/L)吉非替尼均可显著降低H1975细胞存活率(P均<0.05),而(10.0、15.0、20.0、25.0、30.0 μmol/L)吉非替尼可显著降低H1975/GR细胞存活率(P均<0.05)(见表2)。经计算,吉非替尼抑制H1975/GR细胞的IC50为(24.84±2.37)μmol/L,显著高于抑制H1975细胞的IC50[(13.05±1.86)μmol/L](t=9.586,P<0.05)。表明本研究所构建的EGFR-TKI耐药细胞株H1975/GR可以用于后续实验。
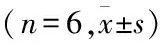
表2 不同浓度吉非替尼干预后H1975和H1975/GR细胞存活率比较
与0 μmol/L苍术素比较,80 μmol/L苍术素可显著降低BEAS-2B细胞存活率(t=9.048,P<0.001),而(20、40、60、80 μmol/L)苍术素均可显著降低H1975、H1975/GR细胞存活率(tH1975细胞=8.828、15.967、22.195、28.151,tH1975/GR细胞=6.850、13.230、19.155、24.666,均P<0.001),且60、80 μmol/L苍术素干预下,H1975/GR细胞存活率显著高于H1975细胞(t=2.661、3.368,P=0.024、0.007)(见表3)。因此,选用20、40、60 μmol/L苍术素作为低、中、高浓度进行下一步实验。
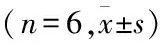
表3 不同浓度苍术素干预后BEAS-2B、H1975和H1975/GR细胞存活率比较
二、各组H1975/GR细胞增殖活力比较
药物干预24 h后,与正常组比较,苍术素(中、高)浓度组和Notch抑制剂组H1975/GR细胞增殖活力降低(P均<0.05);与苍术素低浓度组比较,苍术素高浓度组和Notch抑制剂组H1975/GR细胞增殖活力降低(P均<0.05)。药物干预48 h、72 h后,与正常组比较,苍术素(低、中、高)浓度组和Notch抑制剂组H1975/GR细胞增殖活力降低(P均<0.05),且苍术素各浓度组呈浓度依赖性(P均<0.05);与苍术素(低、中)浓度组比较,Notch抑制剂组H1975/GR细胞增殖活力降低(P均<0.05)(见表4)。
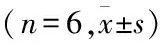
表4 各组H1975/GR细胞增殖活力比较
三、各组H1975/GR细胞周期分布比较
与正常组比较,苍术素(低、中、高)浓度组和Notch抑制剂组H1975/GR细胞中G0/G1细胞比例降低(P均<0.05),G2/M细胞比例升高(P均<0.05),且苍术素各浓度组呈浓度依赖性(P均<0.05);与苍术素(低、中)浓度组比较,Notch抑制剂组H1975/GR细胞中G0/G1细胞比例降低(P均<0.05),G2/M细胞比例升高(P均<0.05);与苍术素高浓度组比较,Notch抑制剂组H1975/GR细胞中G2/M细胞比例降低(P<0.05)(见图1和表5)。
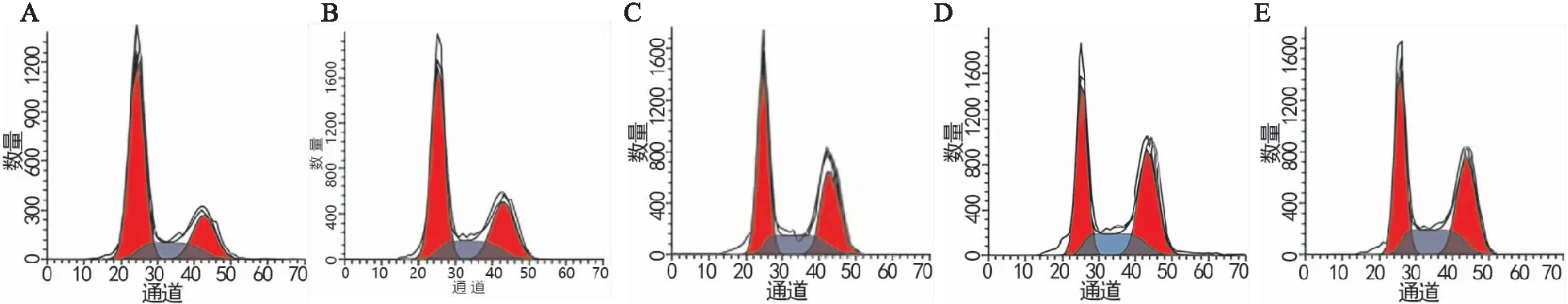
图1 流式细胞仪检测各组H1975/GR细胞周期分布情况 A为正常组;B为苍术素低浓度组;C为苍术素中浓度组;D为苍术素高浓度组;E为Notch抑制剂组
表5 各组H1975/GR细胞周期分布比较
四、各组H1975/GR细胞凋亡率比较
与正常组比较,苍术素(低、中、高)浓度组和Notch抑制剂组H1975/GR细胞凋亡率升高(P均<0.05),且苍术素各浓度组呈浓度依赖性(P均<0.05);与苍术素(低、中)浓度组比较,Notch抑制剂组H1975/GR细胞凋亡率升高(P<0.05)(见图2和表6)。
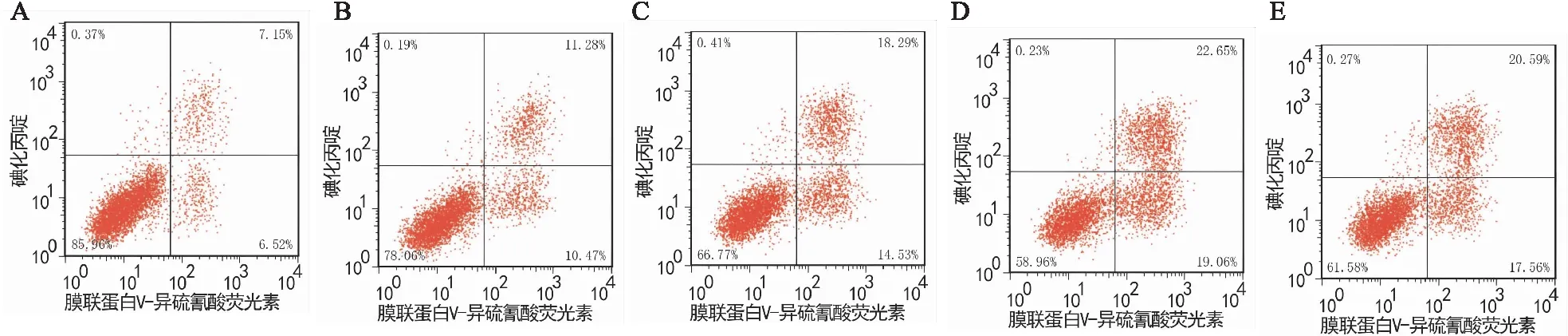
图2 流式细胞仪检测各组H1975/GR细胞凋亡情况 A为正常组;B为苍术素低浓度组;C为苍术素中浓度组;D为苍术素高浓度组;E为Notch抑制剂组
表6 各组H1975/GR细胞凋亡率比较
五、各组H1975/GR细胞中Notch信号通路相关基因表达水平比较
与正常组比较,苍术素(低、中、高)浓度组和Notch抑制剂组H1975/GR细胞中Notch1、Notch3、Hes1、HEY1 mRNA表达水平降低(P均<0.05),且苍术素各浓度组呈浓度依赖性(P均<0.05);与苍术素(低、中)浓度组比较,Notch抑制剂组H1975/GR细胞中Notch1、Notch3、Hes1、HEY1 mRNA表达水平降低(P<0.05)(见表7)。
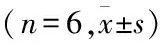
表7 各组H1975/GR细胞中Notch1、Notch3、Hes1、HEY1 mRNA表达水平比较
六、各组H1975/GR细胞中Notch信号通路相关蛋白表达水平比较
与正常组比较,苍术素(低、中、高)浓度组和Notch抑制剂组H1975/GR细胞中Notch1、Notch3、Hes1、HEY1蛋白表达水平降低(P<0.05),且苍术素各浓度组呈浓度依赖性(P<0.05);与苍术素(低、中)浓度组比较,Notch抑制剂组H1975/GR细胞中Notch1、Notch3、Hes1、HEY1蛋白表达水平降低(P<0.05)(见图3和表8)。

图3 Western Blot检测各组H1975/GR细胞中Notch1、Notch3、Hes1、HEY1蛋白表达 泳道1为正常组;泳道2为苍术素低浓度组;泳道3为苍术素中浓度组;泳道4为苍术素高浓度组;泳道5为Notch抑制剂组
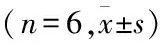
表8 各组H1975/GR细胞中Notch1、Notch3、Hes1、HEY1蛋白表达水平比较
讨 论
EGFR-TKI靶向治疗是晚期EGFR突变NSCLC患者一线治疗的标准方式,可显著改善患者预后,延长无进展生存期[14]。但使用EGFR-TKI治疗期间不可避免地会出现耐药性,获得性耐药已成为导致NSCLC患者治疗失败的重要原因,且这对患者和临床医生来说目前仍是一个重大挑战[15]。因此,进一步阐明EGFR-TKI治疗NSCLC的耐药机制,并寻找新药物靶点和开发新药物成为临床中急需解决的问题。
研究表明,苍术素作为一种天然中草药,具有抗肿瘤、抗炎等多种药理活性[16-17]。苍术素对肺癌细胞A549、NCI-H23、NCI-H460、HCC827的增殖均具有抑制作用,尤其A549细胞,并可诱导A549细胞凋亡和抑制细胞迁移[18]。然而,苍术素在EGFR-TKI耐药NSCLC中的作用尚有待探索。吉非替尼是第一代EGFR-TKI的一线治疗药物[19],本研究通过低浓度逐步加量诱导法构建EGFR-TKI耐药细胞株H1975/GR,结果显示H1975/GR细胞对吉非替尼的IC50显著高于H1975细胞对吉非替尼的IC50,表明本研究所构建的EGFR-TKI耐药细胞株H1975/GR可以用于后续实验。此外,本研究发现(20、40、60 μmol/L)苍术素均可显著降低H1975、H1975/GR细胞存活率,但对BEAS-2B细胞存活率无显著影响,故选用20、40、60 μmol/L苍术素作为低、中、高浓度进行下一步实验。进一步分析显示,低、中、高浓度苍术素均可降低H1975/GR细胞增殖活力,且呈浓度依赖性。表明苍术素可抑制EGFR-TKI耐药细胞株H1975/GR增殖。此外,靶向调节细胞周期,从而诱导细胞周期阻滞是抑制肿瘤细胞增殖的主要特征之一,也是一种重要的抗肿瘤机制[20]。本研究结果显示,苍术素可呈浓度依赖性降低H1975/GR细胞中G0/G1细胞比例,并升高G2/M细胞比例。提示苍术素可能通过诱导EGFR-TKI耐药细胞株H1975/GR G2/M期阻滞,进而抑制细胞增殖。细胞凋亡亦可影响细胞生长、分化等生理过程,与癌症等病理过程密切相关,且近三十多年来,临床肿瘤学的支柱和目标一直是开发通过促进细胞凋亡而有效消除癌细胞的疗法[21]。本研究中,苍术素可呈浓度依赖性升高H1975/GR细胞凋亡率,表明苍术素可能是通过促进EGFR-TKI耐药细胞株H1975/GR凋亡而杀死癌细胞的潜在药物。
Notch信号通路是一条进化上十分保守的信号转导途径,Notch受体(包括Notch1、Notch2、Notch3和Notch4)通过与配体相互作用激活Hes、HEY等碱性-螺旋-环-螺旋转录抑制因子家族的靶基因,从而转导细胞信号调控细胞增殖、分化和凋亡等生物学过程,且Notch信号通路的异常激活与肝癌[22]、肺癌[23]等肿瘤的发生发展密切相关。研究表明,Notch信号通路与肺腺癌化疗耐药有关,且Notch1可促进NSCLC细胞的吉非替尼耐药[24]。Notch3在肺腺癌组织和EGFR-TKI耐药细胞系(HCC827/GR6)中表达上调,且Notch3蛋白高表达的患者与较短的总生存期相关[25]。本研究结果显示,苍术素可呈浓度依赖性降低H1975/GR细胞中Notch1、Notch3、Hes1、HEY1 mRNA和蛋白表达水平,表明苍术素可能通过抑制Notch信号通路激活调控EGFR-TKI耐药细胞株H1975/GR增殖、细胞周期和凋亡。为了进一步验证Notch信号通路的作用,本研究使用Notch抑制剂干预H1975/GR细胞,结果显示Notch抑制剂既可抑制Notch信号通路激活,又能够降低H1975/GR细胞增殖活力和G0/G1细胞比例,并升高G2/M细胞比例和凋亡率,且其作用效果与高浓度苍术素几乎相当。这进一步表明Notch信号通路可能参与苍术素调控EGFR-TKI耐药细胞增殖、细胞周期和凋亡的过程。
综上所述,苍术素可抑制EGFR-TKI耐药的NSCLC细胞株H1975增殖,并诱导细胞周期阻滞和凋亡,其作用机制可能与抑制Notch信号通路激活有关。本研究为苍术素在EGFR-TKI耐药NSCLC治疗中的应用提供了一定实验依据。
