体脂率作为预测胃癌手术后并发症和生存率新指标的研究探讨*
2023-10-07赵海远刘刚李阳刘奔杨万超赵军
赵海远 刘刚 李阳 刘奔 杨万超 赵军
胃癌是全球常见的恶性肿瘤之一,在东亚国家和地区尤为高发,在中国的发病率位居恶性肿瘤的第2 位,手术是主要的治疗方式[1]。近年来,肥胖问题已成为全球公共卫生关注的焦点,内脏脂肪的积聚可能影响手术视野,增加手术时间和术中出血量,提高术后并发症发生率并影响手术后生存期。传统的肥胖评估指标体质指数无法准确反映体内脂肪积聚和分布情况。因此,基于影像学的评估方法,内脏脂肪面积在胃癌、肝癌、食管癌等多种肿瘤的预后评估中被证实为有效[2]。然而,内脏脂肪面积(visceral fat area,VFA)的测量需要使用昂贵的螺旋CT 扫描设备和相关软件,并且存在主观误差和测量的变异性,不适用于大规模的人群流行病学调查[3]。相比之下,通过生物电阻抗法(bioelectrical impedance analysis,BIA)测量体脂率(body fat ratio,BFR)操作简单、成本低廉,无辐射危害,适合大规模应用[4]。因此,本研究旨在验证和探讨BFR 是否能够准确有效地评估肥胖,是否可以作为胃癌术后并发症发生的风险因子以及其是否对远期生存期产生影响,并有助于改善远期生存。
1 材料与方法
1.1 临床资料
前瞻性选取2017 年6 月至2019 年7 月期间在皖南医学院第一附属医院确诊为胃癌并计划手术的患者进行调查。纳入标准:1)经过影像和病理检查确诊为胃癌且无远处转移;2)无明显手术禁忌证,适合接受胃癌根治术;3)未接受新辅助放化疗;4)临床资料完整且能提供术后远期门诊和电话随访资料。排除标准:1)经影像和病理检查证实非胃癌或有远处转移;2)一般状况差以至无法接受手术治疗或未接受胃癌根治术;3)未进行腹部CT 检查;4)在术前与主管医师商讨接受新辅助放化疗;5)BFR、体质指数(body mass index,BMI)、内脏脂肪密度(visceral fat density,VFD)和VFA 值不完整的病例。根据上述标准,共纳入402 例患者进行分析,其中男性303 例,女性97 例,年龄38~81 岁,平均年龄(64.25±10.26)岁。本研究经本院伦理委员会审批通过[编号:(2022)伦审研第(20)号],患者均知情同意。
1.2 方法
1.2.2 测量方法 收集患者的BFR、BMI、VFD、VFA值以及临床病理资料、术后并发症情况、手术相关指标、术后恢复情况和远期生存状况。身高和体质量采用SECA213 型身高尺和TANITA BC601 型人体成分测量仪,计算BMI(kg/m2)。BFR 值测量采用TANITA BC601 型人体成分测量仪(BIA 法)[5]。VFD 测量方法:取出术后病理标本,在大网膜上随机取3 处5 cm2大小网膜组织,进行体积和重量测量,体积放置容量杯中测量,VFD 值=重量(g)/体积(cm2),最后取平均值作为最终VFD 值。VFA 测量通过腹部螺旋CT 扫描,采用Slice-O-Matic 软件提取第三腰椎层面的腹部CT 图片,根据CT 值(Hounsfield unit,HU)区分脂肪和肌肉组织,得到内脏脂肪面积。
1.2.3 术前准备和手术方式 所有患者完成术前检查,围手术期前评估和对症处理。采用传统的腹腔镜手术,全麻下取平卧分腿位。置入镜头行腹腔探查,确定肿瘤位置、胃周情况和淋巴结转移。传统开腹手术组经上腹部切口操作,淋巴结清扫和消化道重建参考相应技术指南[6]。
1.2.4 术后并发症和随访 术后并发症观察包括切口脂肪液化、术后出血、吻合口瘘、吻合口出血、胰瘘、胃排空延迟、乳糜漏、呼吸道感染、泌尿系感染和血栓形成。生存状况以手术为起始点,每3 个月常规电话随访,随访截至2022 年6 月。
1.3 统计学分析
采用R 4.2.1 软件及Bioconductor 包分别进行Spearman 相关性分析其相关性,诊断性ROC 曲线分析,Kaplan-Meier 生存分析和单因素多因素Logistic分析并构建诊断Nomogram 图,对分析结果分别进行可视化。采用SPSS 23.0、Excel 2019 和GraphPad Prism 9.3 软件进行统计学分析。计数资料以例数或百分比统计,组间比采用成组χ2检验或Fisher 精确检验。计量资料行正态分布检验,符合正态分布,采用均数±标准差()表示,组间比较采用t检验;不满足正态分布,两组采用Wilcoxon 法进行比较。以P<0.05 为差异具有统计学意义。
2 结果
2.1 评估内脏脂肪指标间的Spearman 相关分析
结果表明,BFR 与BMI 以及VFA 呈正相关(R=0.731、R=0.784),差异具有统计学意义(均P<0.001)。BFR 与VFD 之间存在显著的负相关(R=-0.814,P<0.001)。BFR、BMI、VFD 和VFA 之间差异具有统计学意义(P<0.05),见图1。
2.2 术后并发症
与BFR-Low 组相比,BFR-High 组的术后并发症总发生率显著增加。切口脂肪液化、术后出血、吻合口瘘和乳糜漏在两组之间具有显著性差异(P<0.05)。然而,两组之间的Clavien-Dindo 分级差异无统计学意义(P>0.05),表明BFR-High 组和BFR-Low 组在术后并发症的严重程度上相似(表1)。
2.3 评估内脏脂肪指标诊断患者并发症风险的准确率
针对预测胃癌术后并发症的指标,分别以BFR、BMI、VFD 和VFA 绘制诊断ROC 曲线。结果显示,各项指标在预测胃癌术后并发症方面均具有一定的价值。相应的ROC 曲线下面积(area under curve,AUC)分别为0.822、0.758、0.760 和0.766,均>0.7(图2)。根据ROC 曲线的分析,确定BFR、BMI、VFD 和VFA预测胃癌术后并发症的cut-off 值分别为28.950、25.120、0.695 和111.150(表2)。
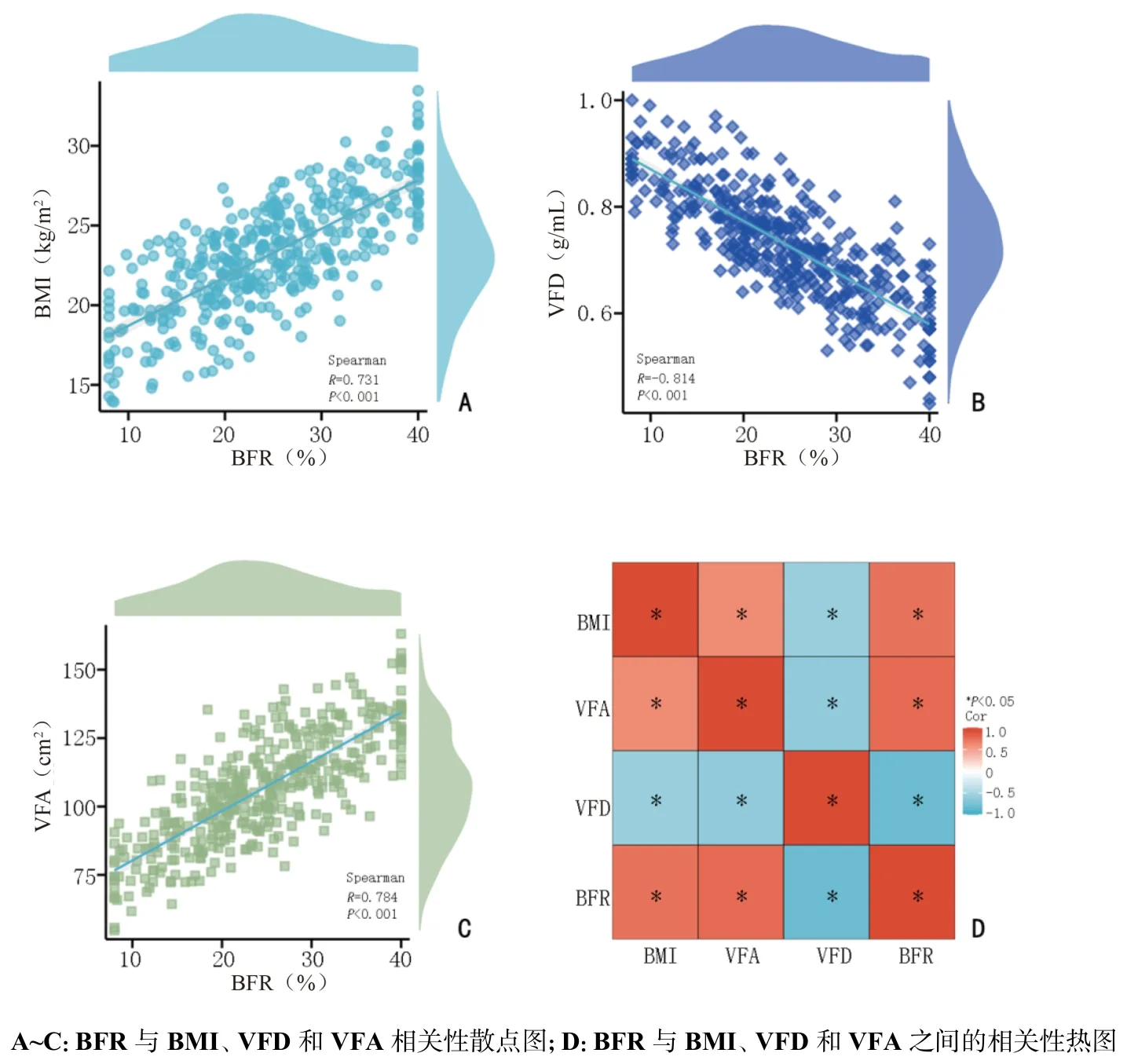
图1 BFR、BMI、VFD 和VFA 指标之间的相关分析
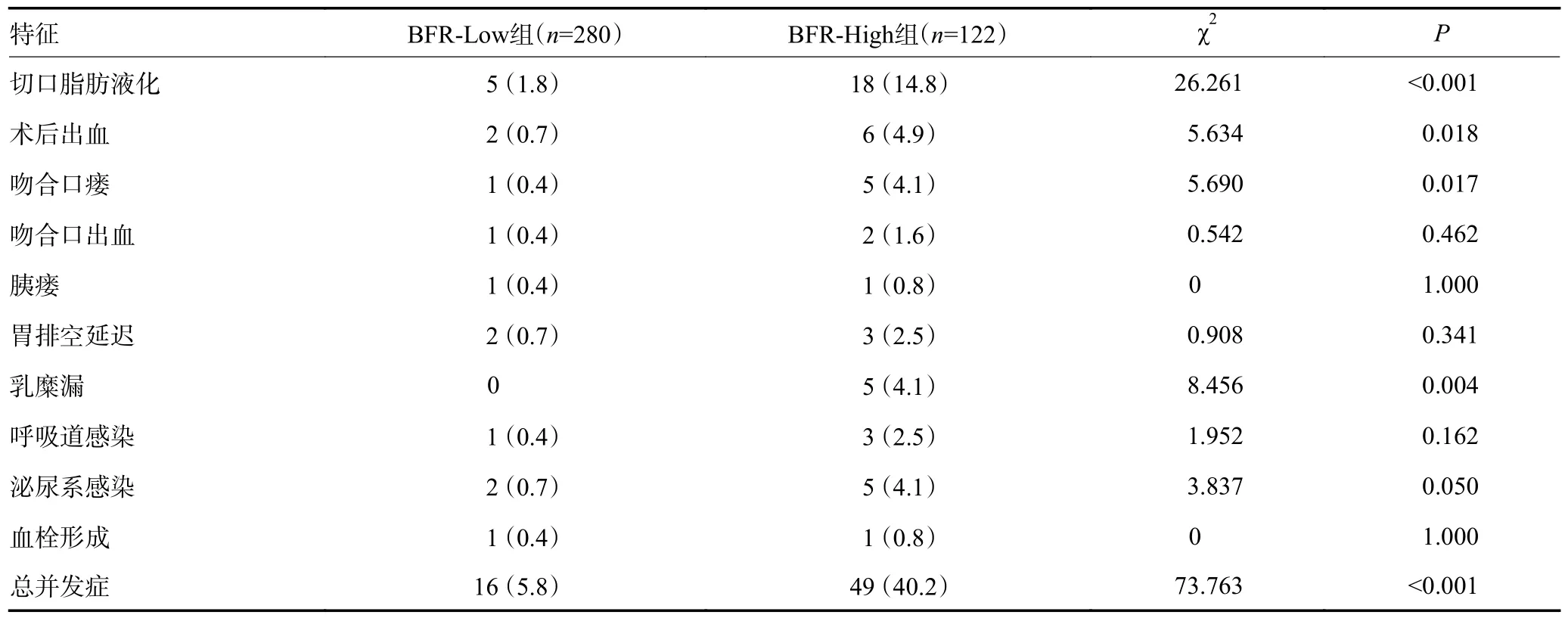
表1 术后并发症
2.4 不同BFR 分组临床基础资料和病理结果的比较
全部患者根据BFR 的cut-off 值28.95 将患者分为BFR-Low 组(280 例)和BFR-High 组(122 例)。在性别和合并疾病(包括肺部疾病、高血压、糖尿病、其他和多发合并疾病)的比较中,差异无统计学意义(P>0.05)。在合并疾病的具体分类中,心血管疾病的两组比较差异具有统计学意义(P<0.05)。两组患者在术中和术后情况方面比较,结果显示BFR-High 组的手术时间较长[(217.88±61.65)minvs.(194.27±66.27)min]、术中出血量较多[(207.53±63.19)mLvs.(192.93±61.42 mL)]、住院时间较长[10.2(9.5~10.9)dvs.8.85(8.1~9.6)d]、住院费用较高[(4.98±0.36)万元vs.(3.92±0.81)万元]、肛门首次排气时间[(3.37±0.92)dvs.(2.6±0.81)d]和首次进食流质时间[(3.32±0.68)dvs.(3.13±0.62)d]较晚,差异具有统计学意义(P<0.05)。然而,ASA 分级(1 级58.2%、2 级40.2%、3 级1.6%vs.1 级67.5%、2 级32.1%、3级0.4%)、首次排便时间[(9.41±3.43)dvs.(9.25±3.41)d]和拔除导尿管时间[(1.67±0.99)dvs.(1.57±0.78)d]的比较差异无统计学意义(P>0.05)。在术后病理结果方面,BFR-High 组的淋巴结清扫数目明显较少[(25.64±5.46)枚vs.(28.0±6.08)枚],差异具有统计学意义(P<0.05)。而在T 分期、N 分期、分化程度、神经侵犯、脉管癌栓阳性淋巴结枚数和肿瘤最大直径[5(3.25~6)cmvs.5(3~6)cm]的比较中,差异无统计学意义(P>0.05),见表3。
另外,说者为了讲解清楚来龙去脉,往往不得不把重要的信息,如重要的事实、迂回的说理、得出的结论,放在后面。
2.5 诊断胃癌术后并发症多种诊断预测模型建立
通过Lasso 回归筛选5 个非零系数的变量(BFR、BMI、VFR、VFD、淋巴结清扫数)进行建模(图3A,3B,表4)。Nomogram 图展示了各个预测因素对并发症风险事件的影响,并以可视化方式将其转化为患者预后概率,C-index 指数为0.837(95%CI:0.790~0.883),提示模型的区分度较高(图3C)。诊断Calibration 校准曲线图贴近对角线表明此次预测模型的拟合优度较好,风险评分ROC 曲线中的AUC 为0.837(0.790~0.883),表明该列线图预测结局上诊断效果越好,DCA 曲线中风险评分曲线在概率阈值区间内高于参考线的说明Nomogram 图的准确性较高(图3D~3F)。进而对这5 个变量进行单因素多因素Logistic 分析,结果显示BFR 被确定为并发症发生的独立风险因素(P<0.05),见表5。
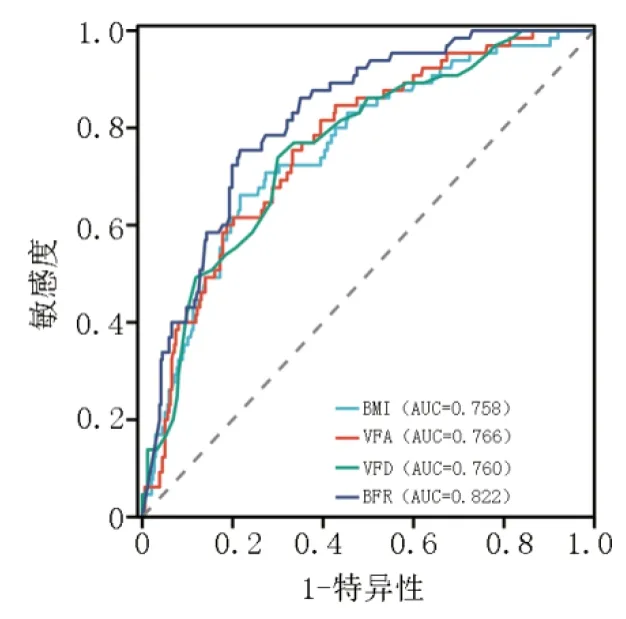
图2 术后并发症诊断ROC 曲线
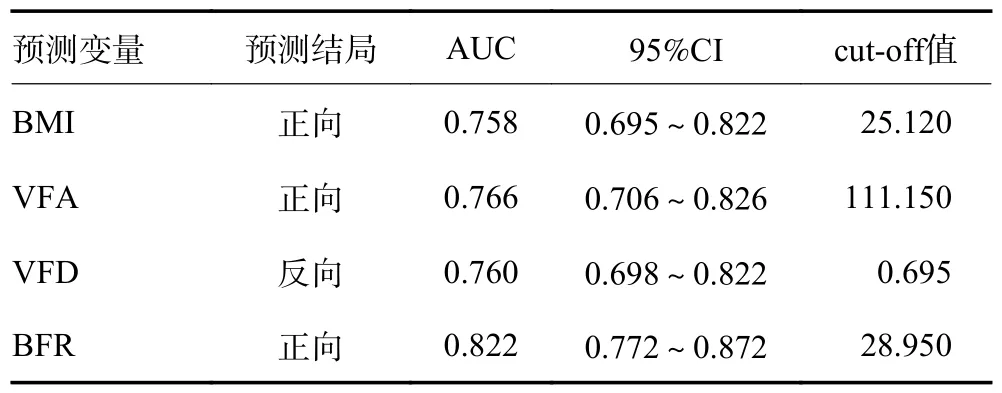
表2 诊断Roc 曲线的AUC 和cut-off 值
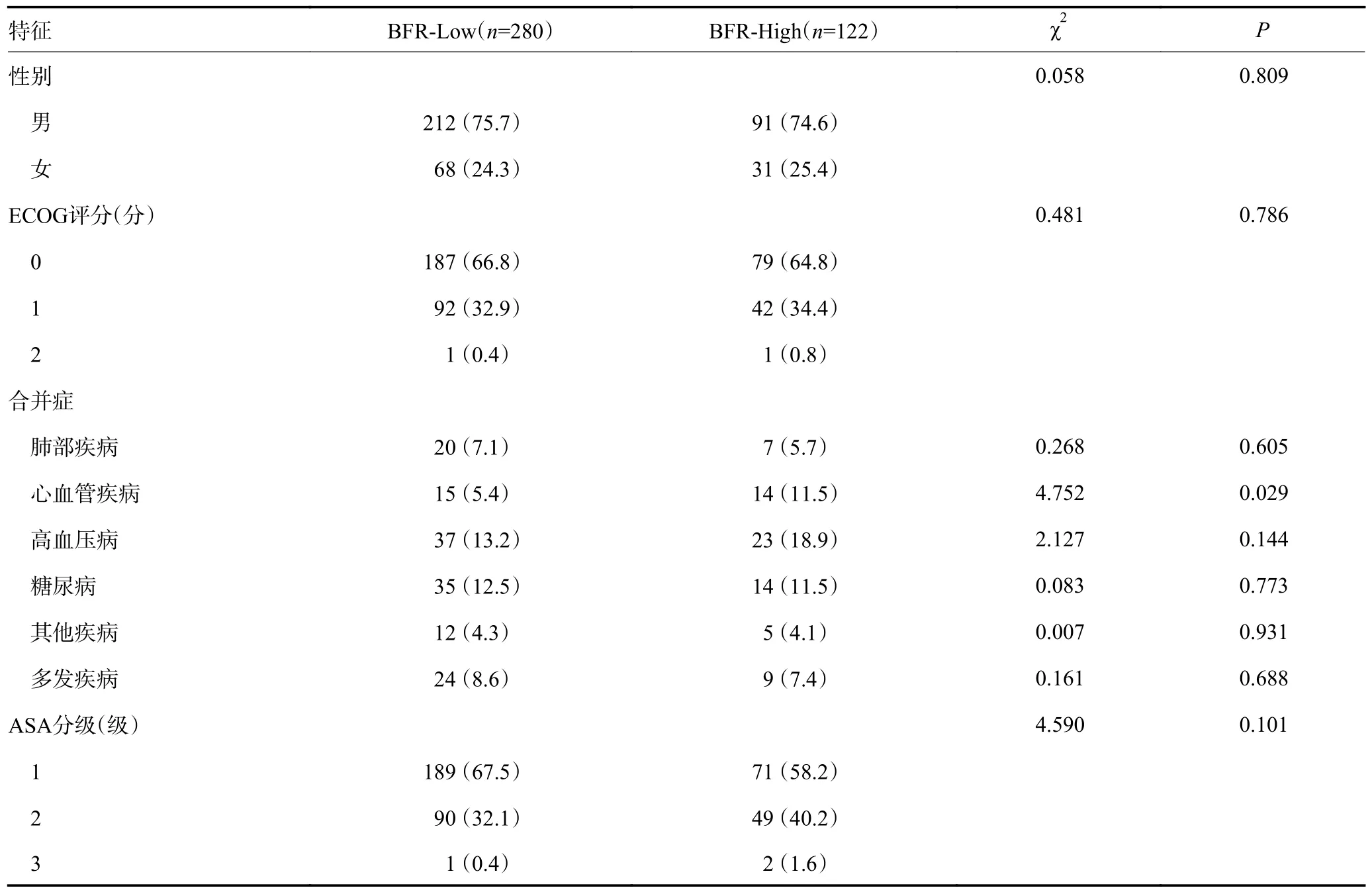
表3 两组临床数据
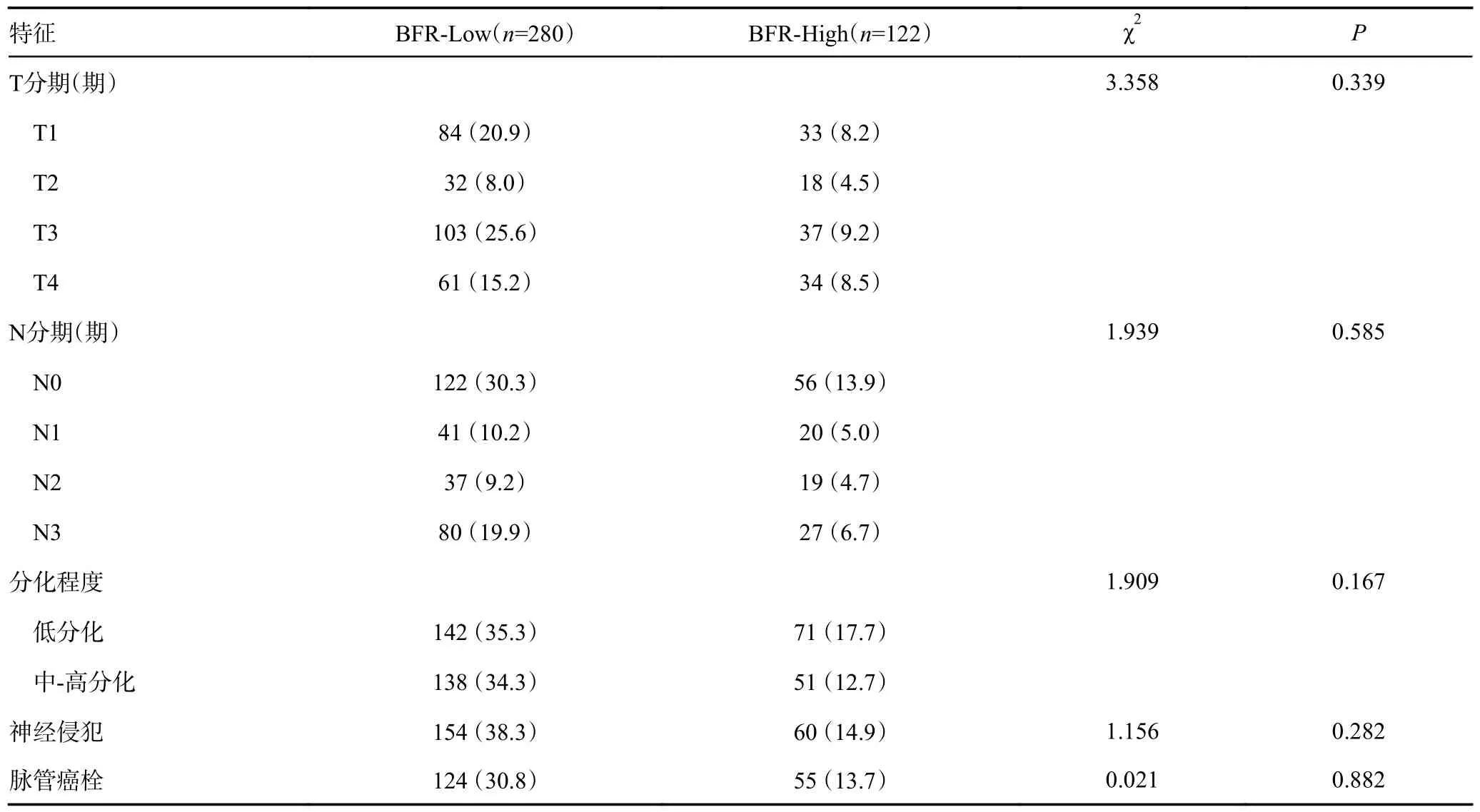
表3 两组临床数据 (续表3)
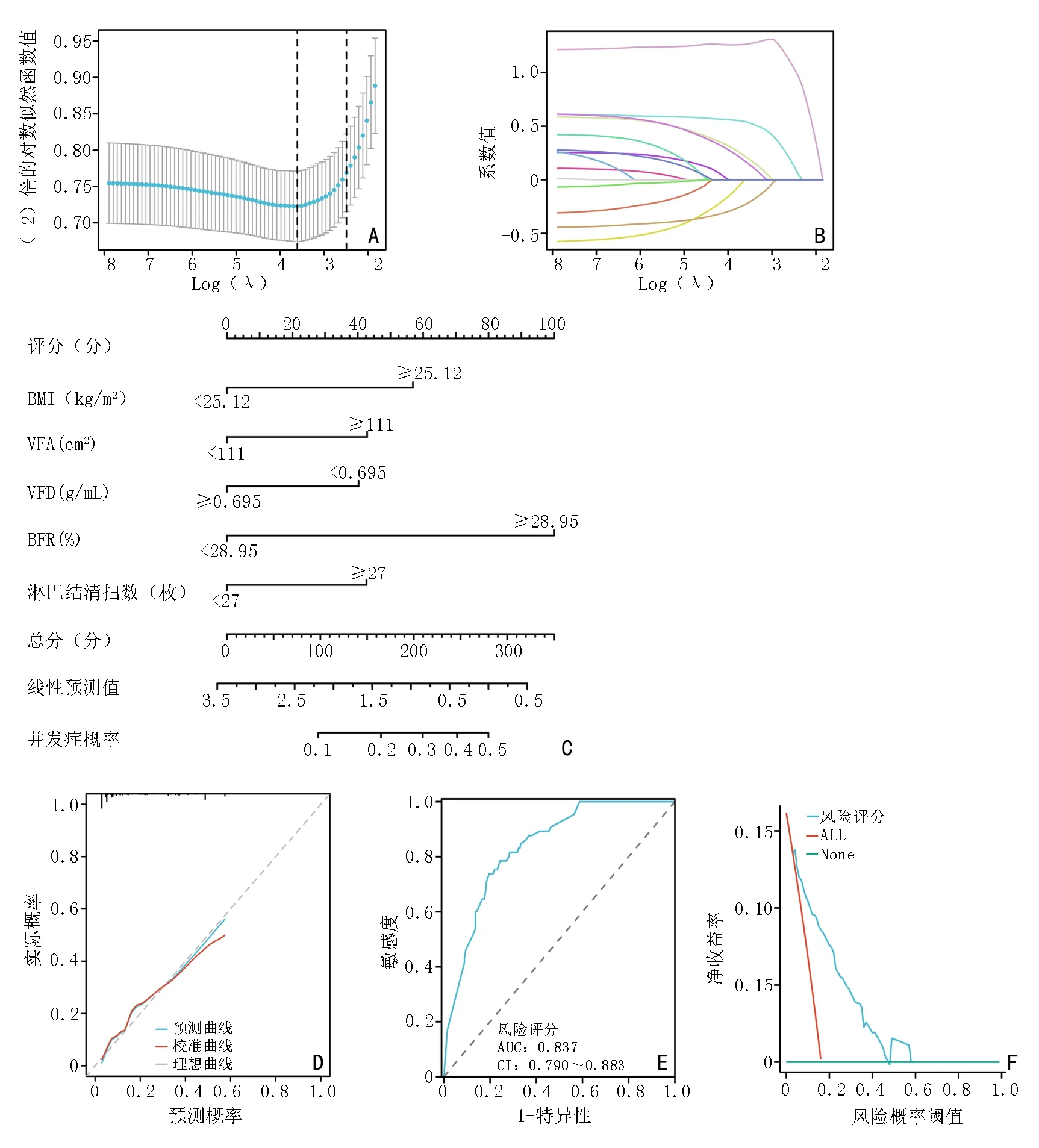
图3 Nomogram 模型及Lasso 回归分析预测胃癌患者术后并发症风险因素
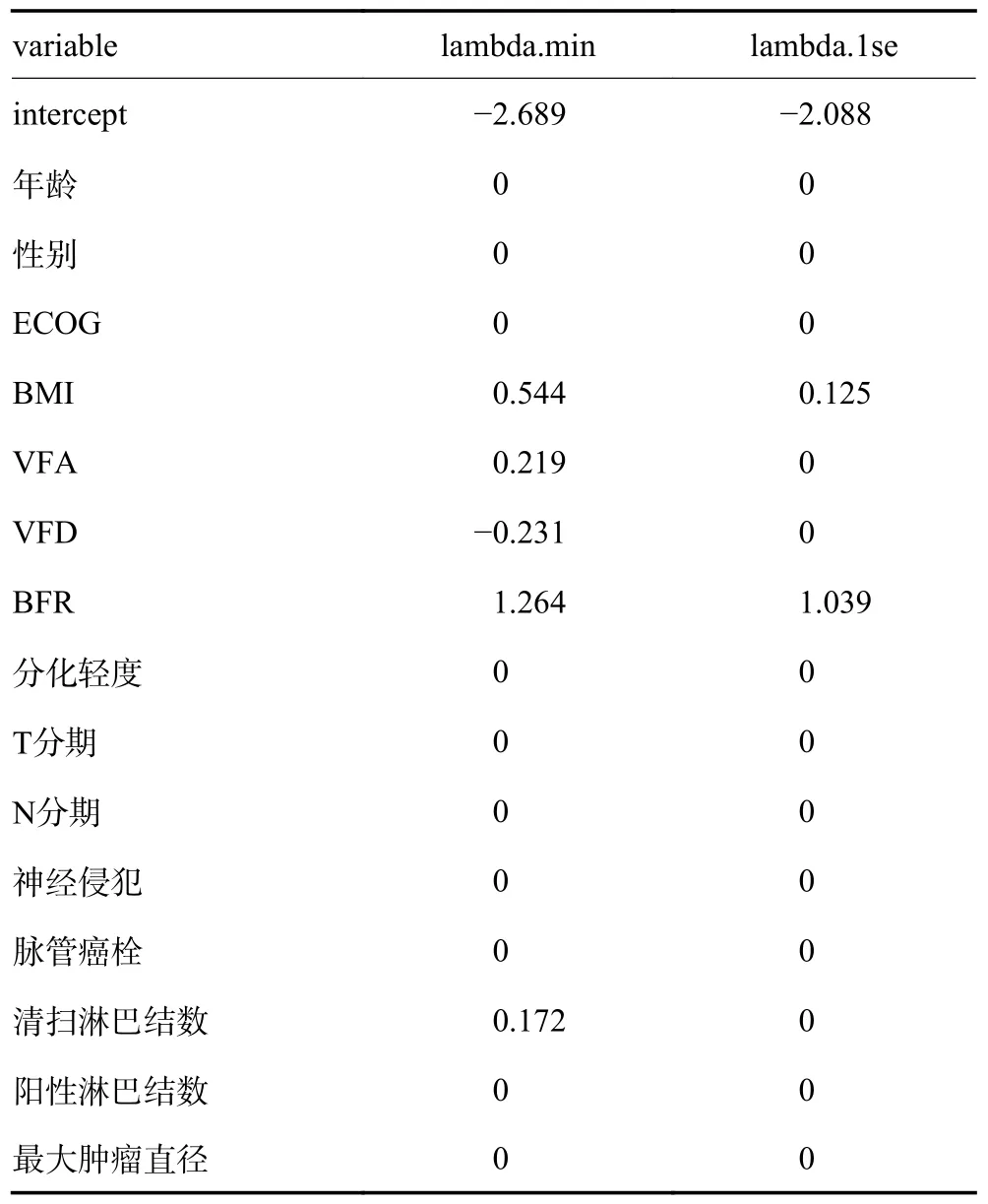
表4 诊断Lasso 系数筛选表
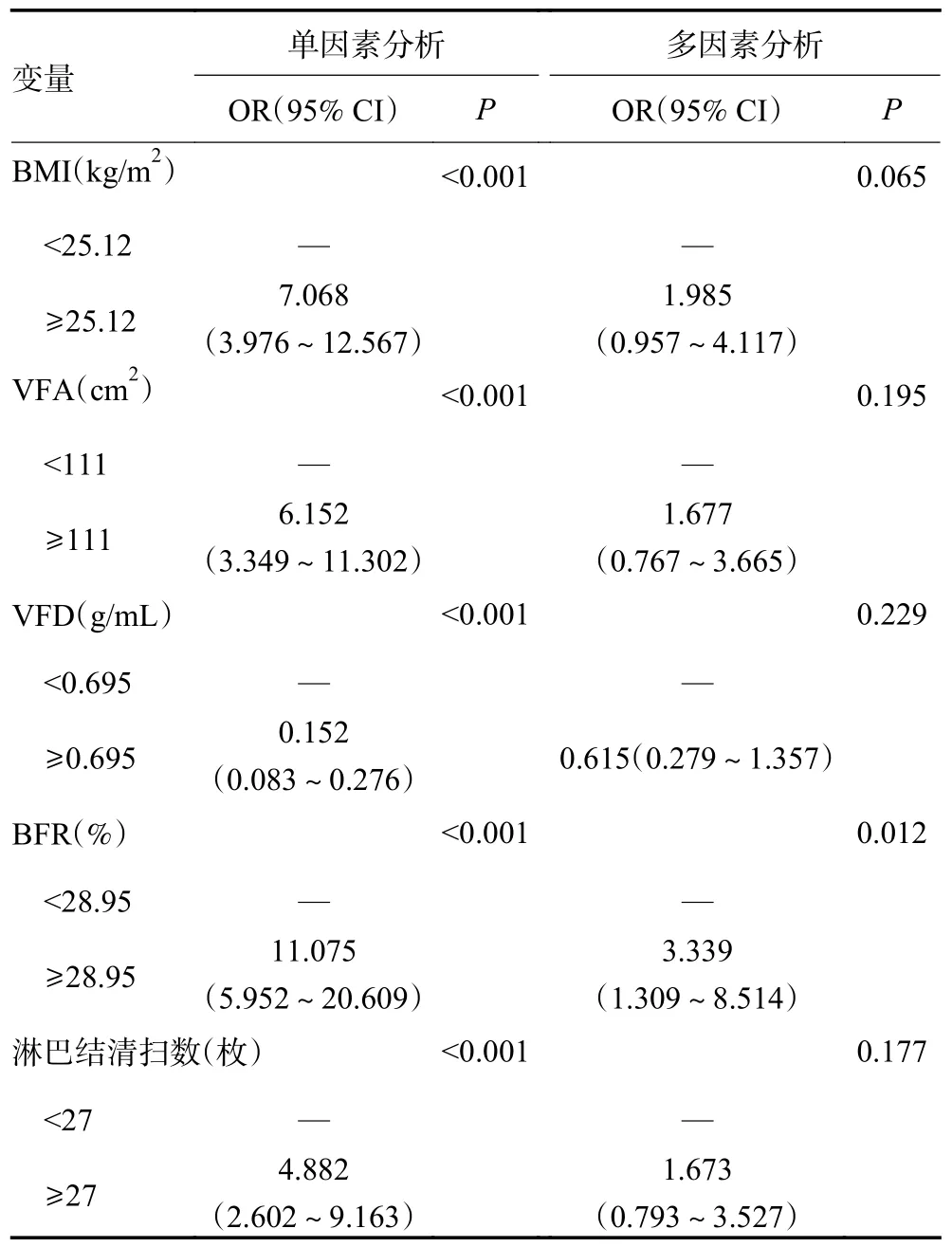
表5 胃癌术后并发症单因素多因素Logistic 分析
2.6 术后生存情况
BFR-High 组与BFR-Low 组患者3 年生存率分别为53.1%和41.6%,而其中位生存时间分别为43.3个月和26.7 个月。结果显示,BFR-High 组的总体生存率高于BFR-Low 组,两组比较差异具有统计学意义(P<0.05),见图4。
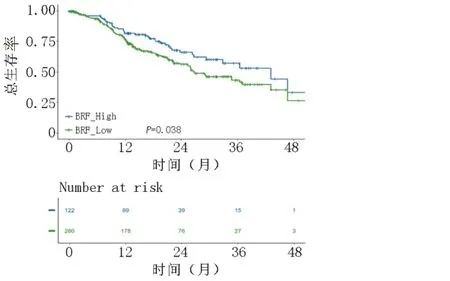
图4 BFR-High 组与BFR-Low 组生存曲线
3 讨论
胃癌发病率在全球居高不下,与肥胖和代谢疾病密切相关,高BMI 和VFA 与胃癌风险增加相关[7]。尽管治疗手段不断改进,但术后并发症、肿瘤复发和转移等问题仍然严重影响患者的生存和预后,尤其是术后并发症的发生,会导致后续治疗无法顺利进行,从而不可避免地影响患者的生存预后[8]。因此,研究如何改善胃癌患者的手术效果和预后成为当前研究的重要方向。
VFA 和BMI 是备受关注的两种脂肪分布指标,与胃癌的发病和预后密切相关[9-10]。但这两种指标各自存在问题:1)VFA 利用X 射线作为放射源,通过测量X 射线在身体不同组织中的衰减程度来区分脂肪、非脂肪和骨矿物质量[11]。由于放射性较大、设备昂贵以及需要配备相应的软件系统并且需要主观判断来获取结果,VFA 存在安全性、性价比和误差等多方面的问题。2)BMI 无法区分脂肪和肌肉质量,可能会将肌肉质量较大的人群误判为肥胖。因此,其不能准确反映患者体质和对胃癌治疗的具体影响。
有研究指出,与BMI 相比,BFR 更准确地反映个体的实际肥胖程度[12]。其可以更敏感地反映脂肪组织分布和异常比例,并与代谢性疾病相关和更敏感的反映腹腔内环境的变化[13]。然而,关于BFR 在术前评估体质量和对胃癌手术的影响方面的研究鲜见报道。本研究提出VFD 的概念,通过病理学验证BFR 的准确性。发现在肥胖患者中,一些脂肪颗粒较大且脆弱,这样的情况使得手术操作更容易出血和错误进入不适当的解剖层次,从而增加并发症的发生风险。因此,本研究重点针对BFR 与VFA、BMI 和VFD 指标之间的相关性进行深入研究和验证,并探究BFR 值与胃癌术后并发症及预后之间的关系。
本研究发现,BFR 与VFA 和BMI 呈密切正相关,但与VFD 呈显著负相关。这些指标能准确反映患者的肥胖程度并预测胃癌术后并发症。然而,这些指标的最佳诊断界点不同,因此需要在特定肥胖程度下进一步研究选择何种指标来预测并发症。同时,为减少统计学误差,应使用获得的最佳切点值来划分BFRHigh 组和BFR-Low 组,而不是仅依赖于BFR 的标准值或中位数。本研究结果显示,相较于BMI、VFA 和VFD,BFR 在预测胃癌术后并发症方面更准确。多因素Logistic 分析表明,BFR 是独立的并发症风险因子。
根据列线图的结果,Nomogram 图可将各预测因素对并发症风险事件的影响以可视化形式呈现,并转化为患者预后概率。通过观察列线图,可以看到BFR值在图表上具有相对较高的刻度,这表明在诊断并发症发生风险方面,BFR 起到一定的作用。此外,结果还显示该模型具有一定的准确性和可靠性,其相应的C-index 值为0.837(95%CI:0.790~0.884)。在Lasso回归模型的系数非零的变量中,确定了5 个变量,即BFR、BMI、VFR、VFD 和淋巴结清扫数,提示这些变量在预测胃癌术后并发症方面具有显著的影响,表明该模型在预测并发症风险方面具有一定的应用潜力和临床意义。
本研究发现,与BFR 较低组的患者相比,BFR 较高组的患者在胃癌根治术中需要更长的手术时间,术中失血量更多,并且术中并发症的发生率也更高。可能因为内脏脂肪过多导致腹腔狭窄,增加手术解剖的难度,延长胃癌根治术的时间,增加失血和并发症的风险。此外,淋巴结转移是影响胃癌患者预后的关键因素之一。在胃癌根治术中,淋巴结清扫情况对手术治疗和后续疗效至关重要,也是评估胃癌手术的关键指标。BFR 较高可能会减少淋巴结清扫数量。然而,相关研究表明BMI 并非影响术中淋巴结清扫的原因[9]。但是,BFR 较高的患者可能会增加术中淋巴结清扫的难度,从而降低清扫效果,进而影响胃癌手术的疗效。综上所述,BFR 对胃癌手术效果具有重要影响,BFR较高可能增加手术难度和术中并发症的风险。此外,BFR 较高的患者可能会影响胃周淋巴结清扫效果,进而影响胃癌手术疗效。因此,对于肥胖患者,尤其是BFR 较高的患者,需要在胃癌手术中加强操作技巧,以提高手术效果。
VFA 在降低胃癌患者手术并发症风险、改善生存质量和生存率方面至关重要[14]。本研究中发现,BFR-High 组同样增加了胃癌患者手术并发症的风险,对术后康复产生了不利影响。这一组的患者表现出住院时间延长、手术时间增加、术中出血量增多、肛门通气时间延长、饮食恢复时间延迟、住院费用增加,以及淋巴结清扫数量减少,差异具有统计学意义(P<0.05)。为降低这些并发症风险,特别是针对合并代谢综合征的胃癌患者,应在术前采取措施来减少BFR。Matsui 等[10]指出,内脏脂肪会增加体循环中促炎细胞因子的释放,影响胃肠道功能的恢复。此外,内脏脂肪与胰岛素抵抗和脂肪细胞因子相关炎症有关,高内脏脂肪水平会增加患者对手术应激的反应。未来的研究将进一步探讨BFR 与术后炎症指标之间的关联,以验证其在胃癌手术中的价值。
BFR-Low 组可能导致胃癌患者不良预后,因此在考虑降低VFA 的干预措施时需要谨慎。这可能与BFR 反映患者的营养状况有关,良好的营养状况有助于对抗不良风险,促进长期生存,因此营养不良患者的预后较差。内脏脂肪可能通过影响脂肪细胞因子来调控肿瘤细胞的生长、黏附和侵袭等行为,其中低脂联素水平与恶性肿瘤的发生和不良预后相关,脂联素在抑制肿瘤细胞增殖和促进凋亡方面发挥抗癌作用[15]。然而,关于BFR 高患者是否仅通过术后并发症对患者预后产生影响,目前尚有争议,这也是本研究的局限性。此外,局限性还表现在以下方面:1)本研究是单中心且样本量较小,需要进行多中心、大样本的研究。2)目前关于BFR 与肿瘤的关系主要停留在临床研究层面,尚未深入探讨其机制,特别是与体内反映肥胖的相关指标(如血脂、血清瘦素、脂联素及其受体)之间的联系,仍需在此方面深入探讨。
通过准确评估BFR、VFA、VFD 和BMI 等指标,可以明确胃癌患者的肥胖程度和脂肪分布情况。在此基础上,选择合适的手术方案和术后管理策略,为制定个性化的治疗策略和提高患者的生存质量提供新的思路和可靠的证据。
本文无影响其科学性与可信度的经济利益冲突。
