解耦联蛋白2对脓毒症腹腔感染大鼠心肌细胞凋亡、氧化应激及PKR/Caspase-11蛋白的影响
2023-10-07陈群李霖李秀娟何德剑王逸君
陈群 李霖 李秀娟 何德剑 王逸君
(郴州市第一人民医院,湖南 郴州 423000)
脓毒症是感染所致的全身炎症反应综合征〔1〕。脓毒症从本质上是对感染性因素的反应,其可由任何部位的感染引起,临床上常见于肺炎、脓肿、泌尿系统感染等〔2〕。脓毒症患者一般会出现心肌功能障碍,心肌功能障碍是相关的脓毒症患者死亡率增加的主要因素,其中心血管系统介导脓毒症的发生、发展〔3〕。目前研究认为,脓毒症心肌损伤的主要机制有内毒素炎症因子诱导、线粒体功能抑制、氧化应激、微循环障碍和细胞凋亡等〔4〕,其中线粒体功能抑制和氧化应激损伤的作用在临床上备受关注。解耦连蛋白(UCP)2是线粒体阴离子通道家族的一员,在心、肺和脑等组织中广泛分布,介导多种病理生理过程〔5〕。有学者研究发现动脉粥样硬化的发生发展和UCP2有密切联系,且其介导多种病理生理过程,例如免疫应答反应、食物的摄入和多种代谢性疾病〔6〕。体外研究显示,UCP2上调可以通过调控膜电位进而保护神经元,而UCP2基因敲除则会导致线粒体活性氧产生明显增多以致损害神经元〔7〕。对于心肌细胞,尤其在脓毒症状态下的心肌细胞中UCP2的作用近年来报道较少。链RNA依赖的蛋白激酶(PKR)是蛋白激酶的一种,在免疫应答、心肌细胞等方面具有明显作用〔8〕。含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)-11早期以单体形式存在,活化条件下形成二聚体和剪切体。一旦Caspase-11被剪切,其就成为对病原体刺激产生固有免疫的重要媒介〔9〕。有研究表明,Caspase-11的激活能够导致一种特殊的细胞死亡方式,被成为细胞焦亡,细胞焦亡在脓毒症的过度免疫中扮演十分重要的角色〔10〕。目前还没有研究证实PKR和Caspase-11在脓毒症的表达情况,因此本研究对脓毒症腹腔感染大鼠模型给予UCP2干预,观察期对模型大鼠心肌细胞凋亡、氧化应激及PKR/Caspase-11蛋白表达的影响。
1 材料与方法
1.1实验动物 80只SD大鼠均从辽宁长生生物技术有限公司购买〔许可证号:SCXK(辽)2010-0001〕。清洁级,雌、雄各半,体质量180~200 g。适宜温、湿度(24 ℃,自由饮水摄食)的环境中对大鼠适应性喂养7 d。
1.2试剂和仪器 UCP2膜拟物(mimics)慢病毒载体、UCP2腺相关病毒AAV-UCP2(汉恒公司);PKR抗体、Caspase-11抗体(美国Abcam公司);水合氯醛(上海国药集团);组织强效裂解液RIPA(美国Solarbio公司);小动物呼吸机(上海玉研科学仪器有限公司);离心机(凯特实验仪器有限公司);荧光显微镜(上海通灏光电科技有限公司)。
1.3实验分组 按照数字随机法将大鼠分为假手术(Sham)组、盲肠结扎穿孔术(CLP)致脓毒症模型(CLP)组、单纯腺相关病毒(AAV)组、UCP2过表达手术(UCP2)组各20只。Sham组行等量生理盐水替代病毒转染手术,3 w后模拟CLP,但开腹后不进行盲肠结扎及穿孔,手术结束后还纳盲肠至原位,关腹;CLP组行等量生理盐水替代病毒转染手术,3 w后建立CLP致脓毒性心肌损伤模型;AAV组行单纯AAV病毒心肌转染,无目的基因的表达,3 w后建立CLP致脓毒性心肌损伤模型;UCP2组行AAV-UCP2病毒心肌转染,3 w后建立CLP致脓毒性心肌损伤模型。
1.4心肌转染模型建立 各组大鼠进行心肌病毒转染。麻醉大鼠后固定,暴露胸部,气管插管,链接小动物呼吸机。以心尖部为中心,做一斜行切口,依次钝性分离肌肉,于第4、5肋间放置小动物开胸器暴露心脏后立即注射AAV-UCP2病毒(滴度为1×1012μg/ml)10 μl,注射6点,共60 μl。撤出开胸器后,加大通气量,充分膨胀肺,将胸腔积血积气排空后缝合。观察呼吸、心跳,稳定后拔管肌肉注射100 kU青霉素,连续3 d,预防感染。3 w后冰冻切片心肌组织,荧光显微镜下观察,并用Western印迹验证UCP2的表达水平,评价病毒转染情况。
1.5脓毒症模型制备 采用CLP制备脓毒症模型〔11〕。麻醉大鼠,仰卧位固定消毒手术部位,沿腹部正中线做一个长约1.5 cm的切口,剪开皮肤和肌层,探查腹腔并找到盲肠,避免损伤肠系膜血管。把盲肠末端1/3处进行结扎,用穿刺针穿刺两次形成2个盲肠漏,轻轻挤出少许粪便。将盲肠还纳腹腔,逐层缝合腹壁切口。Sham组不进行盲肠结扎,其他步骤同其他3组。术后大鼠均皮下注射2~3 ml/kg的生理盐水,分笼饲养。脓毒症成功标准:大鼠活动减少,蜷缩,嗜睡,立毛,口鼻、眼角分泌物增多。
1.6标本采集 术后24 h麻醉大鼠,开胸,取心脏血5 ml置于离心管中,室温静置3~4 h后见血凝块析出,离心,获得所需血清,放置于-20 ℃冰箱中待用。血标本获取完毕后立即取出心脏,4 ℃盐酸缓冲液漂洗,取左心室置于-80 ℃冰箱备用。
1.7Western印迹检测心肌组织中UCP2、PKR、Caspase-11蛋白表达 取心肌组织置于冰上,剪碎组织,加入含有蛋白酶抑制剂的组织裂解液RIPA进行匀浆。离心10 min后取上清,在蛋白样品中加入缓冲液混匀,煮沸后进行电泳、转膜和封闭,封闭后分别孵育兔抗UCP2、PKR和Caspase-11多克隆抗体和小鼠抗β-actin抗体,4 ℃摇床孵育过夜;洗涤缓冲液(TBST)室温洗涤3次后孵育辣根过氧化物酶(HRP)标记的山羊抗兔IgG抗体和山羊抗小鼠IgG抗体,室温1 h,经TBST洗涤、滴加化学发光试剂于曝光仪中拍摄蛋白显影条带,ImageJ软件分析各组蛋白相对表达量。
1.8心肌组织病理形态学观察 取大鼠心肌组织,甲醛固定后脱水,石蜡包埋组织后切片,厚度为5 μm,每组3张,切片行苏木素-伊红(HE)染色,显微镜下观察大鼠心肌组织病理学变化。
1.9TUNEL法检测大鼠心肌细胞凋亡率 心肌组织与蛋白酶K室温孵育,将切片组织在TUNEL反应液中浸泡,后磷酸盐缓冲液(PBS)冲洗3次。过氧化氢冲洗淬灭酶活性,后联合抗生物蛋白过氧化氢酶和二氨基联苯胺覆盖,光学高倍显微镜下进行观察凋亡细胞核呈现棕黄色,每张切片随机取5个清晰视野观察。
1.10心肌组织丙二醛(MDA)含量及超氧化物歧化酶(SOD)活性测定 取10%左心室匀浆上清液,依次加入试剂盒中的试剂,充分混匀后,煮沸,10 min后离心取上清液,蒸馏水调零,于532 nm处测光密度(OD)值,用考马斯亮蓝法测定组织的蛋白含量,计算各组大鼠MDA含量。取各组大鼠左心室,将组织制成匀浆后离心,收集上清液。于440 nm下测定各组吸光度值。用考马斯亮蓝法测定组织的蛋白含量,计算各组大鼠SOD活性。
1.11统计学方法 采用SPSS19.0软件进行单因素方差分析、t检验。
2 结 果
2.1CLP模型建立及评价 模型制备1 d后,与Sham组相比,CLP组、AAV组及UCP2组大鼠均出现嗜睡、精神萎靡、活动明显减少、蜷缩、立毛眼鼻口分泌增多,甚至出现脓尿、稀便及呼吸困难等症状。开腹后发现,盲肠呈紫黑色、肿胀、脆性增加,周围肠腔有脓性渗出、恶臭,肠管与腹腔发生粘连。
2.2病毒转染鉴定 注射病毒3 w后,冰冻切片,荧光显微镜下可见UCP2组心肌组织中UCP2病毒成功转染,见图1。

绿色荧光为UCP2病毒转染成功
2.3各组UCP2蛋白表达比较 和Sham组相比,CLP组、AAV组和UCP2组心肌组织中UCP2表达明显升高(P<0.05),且UCP2组中UCP2蛋白表达显著高于CLP组和AAV组(P<0.05);AAV组和CLP组心肌组织中UCP2蛋白表达无明显差异(P>0.05),见图2、表1。
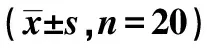
表1 各组心肌组织中UCP2、PKR、Caspase-11蛋白表达比较
图2 各组心肌组织中UCP2、PKR、Caspase-11蛋白表达比较
2.4各组心肌组织中PKR、Caspase-11蛋白表达比较 CLP组和AAV组心肌细胞中PKR和Caspase-11蛋白表达无明显差异(P>0.05);CLP组、AAV组、UCP2组心肌组织中PKR蛋白表达较Sham组明显减少,Caspase-11蛋白表达较Sham组明显增加(P<0.05);与CLP和AAV组相比,UCP2组心肌组织中PKR蛋白表达得到明显回升,Caspase-11蛋白表达显著降低(P<0.05),见图2、表1。
2.5各组心肌组织病理学变化比较 与Sham组相比,CLP组心肌细胞出现水肿、间质充血、心肌纤维变性,横纹模糊不清甚至消失,出现广泛的肌纤维波浪状排列;AAV组和CLP组心肌组织病理变化没有显著差异,基本一致;与CLP组相比,UCP2组心肌细胞有少量水肿,心肌纤维排列基本正常,病变程度得到看明显的改善,见图3。

图3 各组心肌组织病理学变化(HE染色,×200)
2.6各组心肌细胞凋亡指数比较 Sham组心肌仅有少数视野偶见个别凋亡细胞,CLP组和AAV组、UCP2组细胞的凋亡指数明显增加(P<0.05);CLP组和AAV组细胞凋亡指数比较没有统计学意义(P>0.05);与CLP组和AAV组相比,UCP2组心肌细胞凋亡指数明显降低(P<0.05),见图4,表2。
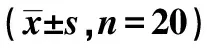
表2 各组心肌细胞凋亡指数及MDA含量和SOD活性比较
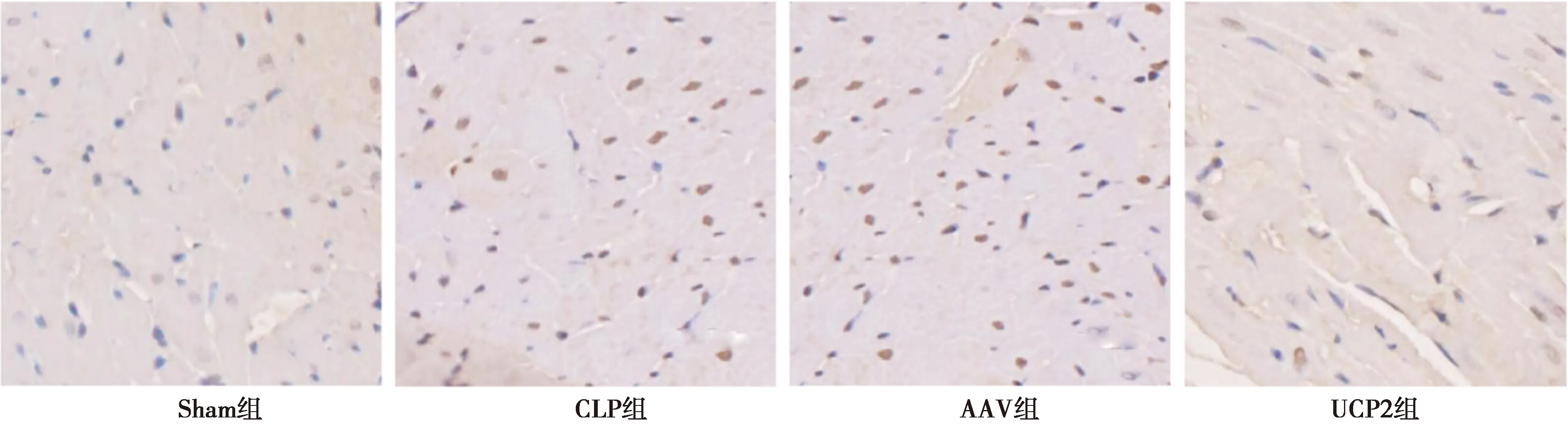
图4 各组心肌细胞凋亡(TUNEL染色,×200)
2.7各组MDA含量和SOD活性比较 CLP组和AAV组MDA含量和SOD活性没有显著差异(P>0.05);CLP组、AAV组、UCP2组MDA含量较Sham组显著升高,SOD活性较Sham组明显降低(P<0.05);UCP2组MDA含量较CLP组和AAV组得到明显抑制,SOD活性较CLP组得到显著升高(P<0.05),见表2。
3 讨 论
目前对于脓毒症动物的造模主要集中在啮齿动物,大致可分为外源性注射型:经静脉、呼吸道或者腹腔直接注射活的细菌或者内毒素脂多糖(LPS),导致大鼠脓毒血症转化为脓毒症模型及腹膜炎型脓毒症。破坏、先诱发肺炎后进一步发展动物自身屏障型:如制造烧伤型脓毒症模型、CLP模型。研究表明,CLP制备的大鼠脓毒症模型和临床更接近,且易于操作,易于复制,是目前应用最广泛的模型〔12〕。UCP是存在于线粒体内膜上的一种质子转运体,目前已发现5类UCP,其中UCP2是表达最广泛的一种,在多种组织中呈高表达,如心、肺等〔13〕。UCP2在多种物质之间有一定的同源性,与其他UCP一样,UCP2的功能主要通过质子漏功能驱散线粒体内膜与基质之间的质子电化学梯度,使质子回流基质与ATP合酶发生解耦联。在脓毒症或炎性实验的模型中,已经发现在心肌、肝、骨骼肌等组织中UCP2的表达明显上调〔14〕。同时研究表明,UCP2在调控炎性反应、限制氧化应激及维持线粒体生理功能方面具有重要作用,介导脓毒症的病理生理机制〔15〕。本研究结果和上述研究一致。
脓毒症一旦合并心肌损伤可加重疾病的演变过程,增加多脏器衰竭及死亡的风险。近年来一些临床研究表明,脓毒症患者有一半以上会发展成心肌损伤,且所导致的心功能不全与脓毒症致死率明显相关。细胞凋亡也称成为程序性的细胞死亡,心肌细胞凋亡在脓毒症心肌损伤中发挥重要作用,抑制心肌细胞凋亡有助于逆转脓毒症心肌损伤〔16〕。本研究结果显示,过表达UCP2可抑制脓毒症大鼠心肌细胞凋亡,改善心肌组织病理学变化。研究表明,氧化应激是导致凋亡的机制之一。MDA是细胞膜上多不饱和脂肪酸受到自由基攻击后产生的脂质过氧化产物,当MDA含量增高时表示体内氧化应激随之增加。SOD属于机体抗氧化酶,能保护细胞免受损伤。MDA和SOD结合多用于评价机体的氧化应激情况。本研究结果显示,过表达UCP2能抑制脓毒症大鼠体内MDA含量,增加SOD活性,通过调整心肌细胞抗氧化防御及活性氧之间的平衡状态,从而抑制脓毒症大鼠的心肌细胞凋亡。孟繁甦等〔17〕研究证实,预先给予血必净注射液对脓毒症大鼠心肌细胞凋亡具有保护作用,这可能与血必净注射液能够降低心肌细胞中MDA含量,增加SOD活性,对氧化应激损伤进行一定的改善,同时减少心肌细胞的凋亡。
PKR是一种双链RNA蛋白酶,在脓毒症肺损伤患者中PKR出现低表达。黄杨等〔18〕研究证实,姜黄素能够提高脓毒症感染急性肺损伤(ALI)大鼠免疫功能,降低炎症表达,其机制可能是用过增加PKR蛋白表达来实现的。细胞焦亡是程序性细胞死亡方式之一,一般依赖致炎性Caspase,介导多种疾病,例如感染性疾病、自发性炎性疾病、自身免疫性疾病和相关癌症等,同时伴随炎性小体和 Caspase-11激活。研究发现,革兰阴性菌的LPS是激活Caspase-11的重要模式分子,在正常机体内,Caspase-11在细胞中呈低表达,这说明细菌感染后,LPS 在引起Caspase-11的细胞焦亡中起到了关键作用〔19〕。本研究结果显示,Caspase-11在脓毒症大鼠中呈高表达,过表达UCP2对Caspase-11的表达可进行有效的抑制。刘雨浓等〔20〕研究证实,黄连解毒汤有效组分可降低细胞内LPS,进而抑制Caspase-11,降低Caspase-11介导的Caspase-1 依赖的细胞焦亡作用。
综上所述,过表达UCP2可抑制脓毒症腹腔感染大鼠心肌细胞凋亡,调控体内氧化应激平衡,同时对PKR/Caspase-11蛋白有一定的调控作用,增加PKR表达,抑制Caspase-11的表达。
