miR-196a通过PI3K/AKT信号通路促进口腔鳞状细胞癌增殖、侵袭
2023-10-07宋洪宁崔硕雷印涛刘敏
宋洪宁 崔硕 雷印涛 刘敏
(山东第一医科大学第二附属医院口腔颌面外科,山东 泰安 271000)
口腔鳞状细胞癌(OSCC)在机体恶性肿瘤中排名第6,男女中发病率均较高,据统计,每年新发病例超过50万〔1〕,且病例数量有逐年增加的态势,发病年龄也更倾向青壮年,OSCC特点显著,具备较强的周围区域的侵犯性,相关引流区淋巴结转移率也较高,短期愈合率较低,目前对其发病机制及深层次干扰因素仍缺乏了解,因此进一步研究其分子调控机制,寻找新的肿瘤标志物,有利于肿瘤发生前期的确认,便于尽早医学干涉,对于OSCC患者,大大提高其治愈率,对预后改进意义重大。微小RNA(miRNA)被归纳为一类不可或缺的转录后调控因子,几乎介入了细胞体所有生存活动,不论是细胞族群的壮大、细胞向不同方向的演化、细胞的湮灭,还是构筑血管、肿瘤的变化演进及远处播散等,近年均受到广泛关注并成为研究热点,对其和OSCC间的研究也越来越多,从表达研究到对肿瘤细胞生物学功能的影响,从医疗遴选探索到早期检测〔2〕,进一步揭示其内涵机制,能为OSCC的鉴别甄选、极富针对性的靶向手段、疾病演化进展等在学术上予以支持。miR-196a是miRNA中的重要成员,由同源异形盒基因家族(HOX)基因座转录而来,其在多种恶性肿瘤中异常高表达〔3〕,且这种高表达与淋巴结受侵犯范围和相关疾病的分期存在密切关系,此外,瘤体细胞产生的对化疗药物的某些不敏感现象也与其有关系。本文通过分析HOK和SCC9细胞中miR-196a的表达情况、抑制miR-196a表达对SCC9细胞增殖、侵袭功能的影响,研究其与OSCC的关系,同时分析其是否通过磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)信号通路发挥作用,为了解miR-196a机制,开发安全有效的OSCC新型靶向针对性方法开拓新思路。
1 资料与方法
1.1标本、试剂和仪器 正常人口腔角质形成细胞(HOK)和OSCC细胞系(SCC)9由泰山医学院实验室赠予;胎牛血清、DMEM培养基、Opti-MEM培养基、蛋白裂解液放射免疫沉淀法缓冲液(RIPA)、二喹啉甲酸(BCA)蛋白浓度测定试剂盒、噻唑蓝染色法(MTT)-8试剂盒均购自江苏碧云天公司,胰蛋白酶、LipofectaminTM2000、DNA聚合酶和Trizol Reagent 来源于Invitrogen(美国),SYBR Premix Ex Taq、Prime Script RT相关产品Takara(日本),miR-196a、U6和miR-196a inhibitor、miR-196a inhibitor NC源自锐博(中国广州),Transwell小室购自Corning(美国),PI3K抗体(cat.no.4257)、p-PI3K抗体(cat.no.17366)、AKT抗体(cat.no.9272)、p-AKT抗体(cat.no.9611)、FOXO1抗体(cat.no.2880)和GAPDH抗体购自Cell Signaling Technology(美国),Roche 480 Real-time PCR仪购自Thermo Fisher(美国),WB电泳装置、转膜仪和成像仪源自Bio-Rad(美国)。
1.2HOK、SCC9细胞培养和转染 HOK和SCC9细胞采用DMEM培养基(成分是10%胎牛血清)进行繁育,相关进行细胞培养的环境设定为温度37 ℃、CO2浓度5%,期间采用倒置显微镜进行检查,分析细胞状态,规定是1~2 d换液一次,以保证细胞的良好生存条件,当细胞生长密度达80%时,滴入胰酶〔内有乙二胺四乙酸(EDTA)〕进行消化分解,并进一步传代繁育,在后续研究步骤需遴选情况良好的细胞进行。将miR-196a inhibitor引入至SCC9,实验分为Control、Inhibitor NC、miR-196a inhibitor 3组,依据“LipofectamineTM2000”相关产品介绍执行实验程序。
1.3qRT-聚合酶链反应(PCR)分析计算miR-196a的表达水平 严格遵循Triozol RNA分离试剂盒的产品使用介绍分离HOK、SCC9细胞的RNA,使用微量分光光度计度量RNA的浓度和纯度,A260/A280数值大小作为RNA溶液是否符合相应纯度标准的参考,该数值限定于1.8~2.1之间较为理想。引物序列:miR-196a正义:5′-CTGGAGTAGGTAGTTTC-ATGTTG-3′,miR-196a反义:5′-GTGCAGGGTCCG-AGGT-3′,U6正义:5′-GCTTCGGCAGCACATATACTAAAAT-3′,U6反义:5′-CGCTTCACGAATTTGCGTGTCAT-3′。采取“SYBR® Green策略”反转录,获取cDNA,接着采用“SYBR ® Premix Ex Taq TMⅡ”完成后续PCR实验步骤,冰上配制PCR相关作用溶液,采用两个阶段的步骤进行PCR扩增,基本顺序为:预变性:95 ℃,30 s(1个循环),PCR:95 ℃,5 s 60 ℃,30 s(40个循环),循环结束后,设置温度从60 ℃升高到95 ℃获取熔解曲线。实验重复3次,根据实验数据分析出两种基因的相对表达量(miR-196a和内参U6),最终统计结果是通过2-△△Ct公式建立。
1.4MTT检测转染后细胞增殖情况 用胰蛋白酶(浓度为0.25%)处理分解,每个孔中添入等体积量完全培养基(即不添加血清及抗生素),对胞体进行再次悬浮,取0.1 ml到96孔板中,控制细胞密度约2 000个/孔,每组设3个复孔;测定时间点为转染后0 h,12 h,24 h,48 h。将MTT试剂(10 μl)加入各孔中,并在 37 ℃下再孵育4 h。洗去上清液,用二甲基亚砜(DMSO)溶解晶体。接着将吸光度值标定在490 nm条件下进行检测。
1.5Transwell侵袭实验检测转染后细胞侵袭能力 将24孔板置入Transwell室内,牛血清白蛋白(BSA)进行重悬操作,控制其密度大约为1×104个/ml,将300 μl细胞悬液加入迁移小室后接着在37 ℃环境下培养48 h,膜底以冷磷酸盐缓冲液(PBS)洗涤3次,再选4%甲醛进行稳态,室温0.5 h,而后滴入0.1%紫罗兰作用10 min;对标记出的图像进行采集,接着通过软件统计分析其中穿过室膜细胞数量。
1.6Western印迹分析计算转染后4种蛋白数值情况 细胞遴选处于对数繁殖状态,转染操作经历24 h,混合RIPA、部分蛋白酶抑制剂、蛋白酶抑制剂(DMSF)并进行消融,取50 μg蛋白提取物进行10%的十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)实验,后续把蛋白迁移至硝酸纤维素膜,用三乙醇胺缓冲盐溶液稀释(TBS)配制5%脱脂奶粉,封闭处理60 min,然后将依固定百分比稀释一抗(1∶500)和磷酸甘油醛脱氨酶(GAPDH)一抗(1∶1 000)混合其中,4 ℃孵育一晚,三羟甲基氨基甲烷缓冲盐液(TBST)处理3次再混合二抗(1∶10 000),室温放置1 h,后续ECL显影曝光拍照,用ImageJ测量灰度值,重复3次实验,数值用蛋白/GAPDH计算,该比值即代表蛋白水平。
1.7采用生物信息学、Western印迹方法预测分析靶标蛋白FOXO1 采用最常用的生物信息学在线软件TargetScan,版本7.1,通过联网(www.targetscan.org/vert_71)查询miR-196a与FOXO1之间可能存在的靶标关系结合位点;Western印迹方法分析转染后FOXO1、p-FOXO1蛋白表达情况,步骤同前。
1.8统计学分析 采用SPSS13.0软件进行配对样本t、χ2检验。
2 结 果
2.1miR-196a在HOK和SCC9细胞中的表达 应用qRT-PCR分析计算miR-196a于两种细胞内情况,熔解曲线呈单峰,扩增产物纯度佳,无二聚体形成,与HOK(1.015±0.041)相比,SCC9 miR-196a 相对表达量(1.729±0.085)显著升高,说明在SCC9内其数值水平显著大于HOK(P<0.05)。见图1。

图1 miR-196a及U6基因qRT-PCR扩增、熔解曲线
2.2qRT-PCR分析计算转染后miR-196a的表达量 与control组、inhibitor-NC组相比,miR-196a inhibitor组miR-196a表达量明显下降(P<0.05)。见表1。
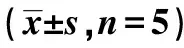
表1 3组转染后miR-196a表达及MTT实验检测转染后不同时间点细胞增殖能力
2.3MTT检测转染后细胞增殖情况 与control组和inhibitor-NC组相比,miR-196a inhibitor组在转染0 h、12 h、24 h细胞增殖能力无明显改变(P>0.05);转染后48 h,miR-196a inhibitor组细胞增殖能力显著下降,提示抑制miR-196a的表达能显著降低SCC9细胞的增殖能力,且在转染48 h后较为显著(P<0.05)。见表1。
2.4Transwell侵袭实验检测转染后细胞侵袭能力 24 h后,与control组、inhibitor-NC组比较,miR-196a inhibitor组SCC9细胞侵袭能力显著下降(P<0.05)。见图2、表2。
表2 3组细胞中4种蛋白、24 h后SCC9细胞侵入下室数目
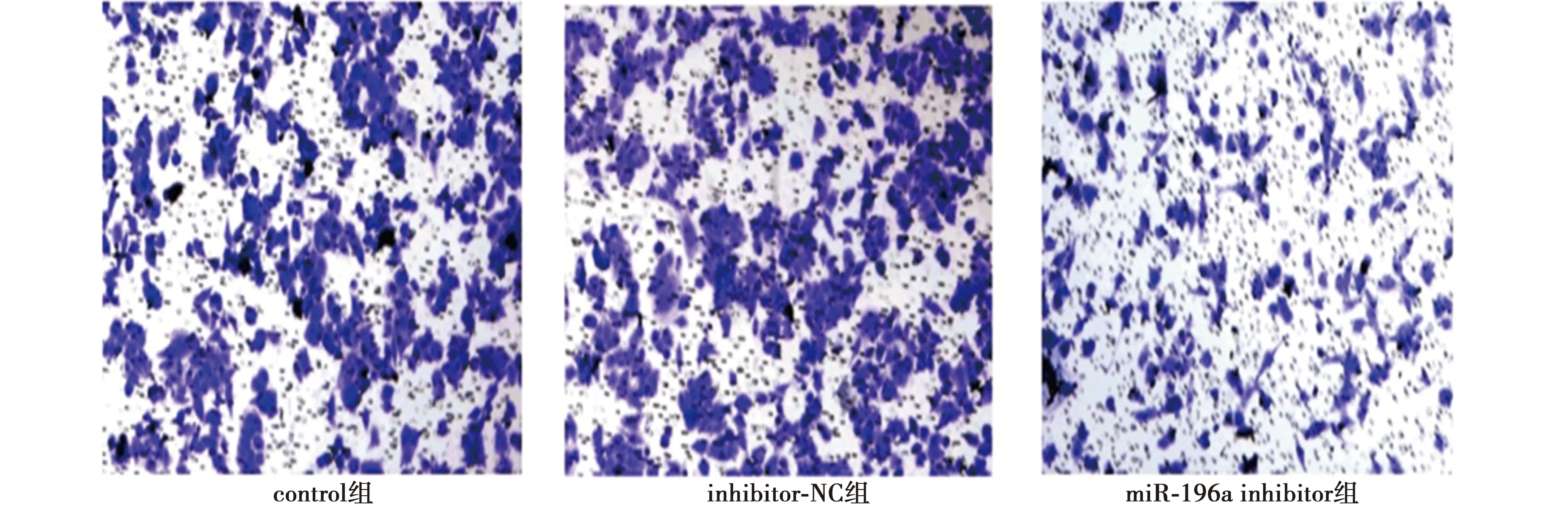
图2 3组Transwell 24 h细胞侵袭(结晶紫染色,×100)
2.5Western印迹分析计算转染后蛋白数值 与control组、inhibitor-NC组相比,miR-196a inhibitor组p-AKT、p-PI3K明显下降(P<0.05)。见表2、图3。

图3 Western印迹检测3组细胞AKT、p-AKT、PI3K、p-PI3K蛋白表达
2.6采用生物信息学、Western印迹预测分析靶标蛋白FOXO1 根据TargetScan7.1给出的数据结果,经过分析,可知在FOXO1的3′UTR处存在与miR-196a相结合的位点,miR-196a inhibitor组FOXO1、p-FOXO1相对表达量(2.560±0.009、0.407±0.046)与inhibitor-NC组(0.622±0.013、2.137±0.366)相比,差异有统计学意义(P<0.05)。见图4。
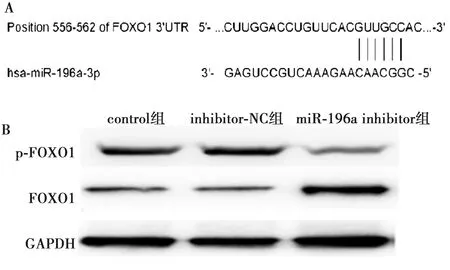
(A)生物信息学预测FOXO1为miR-196a的靶基因;(B)3组细胞中FOXO1、p-FOXO1蛋白电泳
3 讨 论
OSCC在我国的口腔恶性肿瘤中的发生可能性高,该疾病初期就表现较强的转移能力,容易导致术后瘤体的再生长,意味着疾病治疗的失败,且对OSCC晚期患者,外科的介入和放化疗都很难有效改良生存曲线,对其以后生活影响颇大。因此,早发现、早治疗是提高病人预后最好的手段,临床中迫切需要寻找一种合适的肿瘤标志物,这对于该种疾病的甄别、医治、预后及能否最大程度恢复生活水平均有影响。
miRNA作为一种具有18~22个长度值核苷酸的RNA,现被划为小内源性非编码,主要是借助于调控对应靶向基因的转录和翻译。采集原发于胃的恶性肿瘤病例中发现,miR-196a和转移存在正相关,提示其在该疾病的原位进展及远处播散中或许是角色关键原因〔4~6〕,通过对血液中miR-196a分析检测得出结论,其可能影响胃部恶性肿瘤患者的后期辅助性药物治疗效果,并且与预后联系紧密,miR-196a极有希望被定义为一种分子层面的标志物,发挥胃癌的早期甄别及预后提示作用〔7〕;另据在食管癌的调查取样分析,miR-196a表达异常升高出现于多个该类肿瘤分型中,不但限于腺癌,甚至体现在Barrett食管病灶中,非正常发育的病例中亦有体现,且这种升高水平和非正常程度存在某种正相关性,更深层次揭示miR-196a成为关键原因的可能,指示相关疾病衍化成食管类恶性肿瘤的时间节点,为监测肿瘤进程提供可靠依据〔8〕,且miR-196a基于此介入食管癌进程,从早期指示到后期愈合,其检测指标联结疾病预后,在食管癌生存曲线中成为新的评价信号〔9〕;在结直肠癌病种分析发现,miR-196a同样出现表达数值的异常性,较周围正常组织,其数值量明显提升,且这种提升和肿瘤的多种临床特征呈现相关性,如引流区域的淋巴结是否侵及,外围器官是否受累,对于正确划分其分期意义重大,miR-196a亦定义为结肠癌重要的筛选早期病例及判定远期治疗效果的标志物,为该种疾病基因层面的分析治疗提供可靠靶点〔10〕;Liu等〔3〕通过研究宫颈恶性肿瘤,对选取的病例进行相关血液分析,发现miR-196a数值异常上调,这种上调并非无序性,而是紧紧围绕该型肿瘤的相关医学分期,恶性程度层次、周围淋巴结浸润与否展开,最终得出其能诱导相关肿瘤进展,并刺激癌转移〔11〕,整体起到促癌效应。
miR-196a与口腔恶性肿瘤的关系同样密切,其在头颈部鳞癌中可能发挥促癌作用,影响肿瘤细胞的迁移、侵袭和黏附力,头颈部鳞癌初期的病例中,其miR-196a整体数值明显升高,这种升高程度在存在淋巴结转移(LNM)的病例中尤为显著,miR-196a这种数值的异常情况,跟病例的临床生命周期紧密联系,并且miR-196a表达量与患者生存率相关〔12〕,通过分析血液并提取miR-196a进行检测,使其可以作为有效肿瘤标志物,用于早期诊断〔13〕。这些研究揭示,miR-196a在口腔肿瘤发挥的促癌作用,并与细胞行为存在联系,参与影响肿瘤转移,并能侧面反映预后情况,与口腔肿瘤分期密切相关,但对于其如何发挥作用仍需要不断探究。总体而言,miR-196a数值的升高表现在不同类别的恶性瘤体中,主要发挥诱导癌发生发展的效能,借助血清检测手段,提取分析miR-196a数值,以捕获相关疾病初期的窗口,并能协助分析疾病的转归并判定预后,目前关于miR-196a的关系脉络挖掘还处于初期阶段,不论是基本生命活动特性还是相关网络关系内容仍需深入探索。
PI3K/AKT信号通路介入参与大量复杂的生理活动,影响包括细胞族群的壮大生存、不同方向的演变、相关血管网络的构建、更新换代等,在肿瘤中PI3K/AKT可能起到控制器的作用,进而影响肿瘤的发展,其异常激活在肿瘤的演变及化学药物抵抗方面十分重要,PI3K/AKT信号途径的异常失调性在肿瘤中可以说是普遍存在,与肿瘤的图谱均有关联〔14,15〕。通过研究小肠腺癌〔16〕,发现其中PI3K/AKT信号途径有明显被激活的迹象,该信号或许能被定义成另一种医学解决手段。通过对胆管上皮癌患者进行分析〔17〕,发现其中PI3K/AKT信号同样存在异常表现,加入该相关通路的减活成分可以有效阻碍此类疾病上皮癌细胞繁殖和迁演。研究分析子宫内膜癌患者〔18〕,得出AKT磷酸水平、磷酸酶及张力蛋白同源的基因(PTEN)的沉默,都与该疾病的出现相关,该疾病患者在伴有PTEN非阳性变化、AKT磷酸程度加深情况下,其恢复愈合更加困难,生命周期明显缩短,PTEN/AKT两者比值大小可以成为标定子宫内膜癌愈合恢复程度的关键指标,相应磷酸化程度高低和该类肿瘤临床发展级别、组织层面类别、邻近肌肉受侵犯程度、远位引流区淋巴结浸润联系广泛。除上述肿瘤,其在白血病〔19〕、胃癌〔20〕、肝癌〔21〕等各种肿瘤内都出现异常活化,PI3K/AKT主要通过诱使激活AKT的活化进而作用于下游分子发挥作用,活化后AKT具备同时节制大量参加细胞凋亡进程的分子。
FOXO是Forkhead转录因子大家族最重要的一个亚群,Forkhead广泛存在于真核细胞生物中,在哺乳动物中FOXO有4种亚型:FOXO1、FOXO3a、FOXO4和FOXO6〔22〕,其中FOXO1是最早发现的成员,分布广泛,几乎遍布各组织器官,许多关键细胞功能均受其调控,影响细胞基本生命过程,是一种明确的抑癌基因,表达缺失或下降将激活启动肿瘤恶性进程,其在多种恶性肿瘤中低表达,并与肿瘤分化程度、肿瘤大小、淋巴结转移相关〔23〕,FOXO1与口腔肿瘤的关系亦十分密切,Chan等〔24〕分析30例口腔癌组织标本,发现FOXO1表达相比于正常组织明显下降,并发现HMG盒转录因子(HBP)1是FOXO1的直接下游转录靶点。Huang等〔25〕发现,槲皮素是一种有效的抗肿瘤因子,而在表皮生长因子受体(EGFR)过表达的口腔癌中,槲皮素通过FOXO1发挥抑制肿瘤生长的作用。FOXO1又是PI3K/AKT的下游信号,PI3K/AKT通路的激活具有促癌作用,FOXO1是这条通路中的关键一环,FOXO1受其负性调控〔26〕,若PI3K/AKT通路上调,相关蛋白量和磷酸化水平均上调,其磷酸化FOXO1能力增强,磷酸化FOXO1的量越高,与血管生成存在联系的分子含量亦越高,pFOXO1可利于癌血管网构建,AKT通路的激活及FOXO1的磷酸化可以作为癌变倾向的早期生物学标志物〔27〕。
