调补肺肾三法对慢性阻塞性肺疾病稳定期大鼠肺与肠道炎症指标的影响
2023-10-07轩银霜李亚卞晴晴毛静李晓俊李素云
轩银霜,李亚,卞晴晴,毛静,李晓俊,李素云,4∗
(1.河南中医药大学,郑州 450046;2.河南中医药大学第一附属医院中心实验室中药药理(呼吸)实验室河南省呼吸病防治中医药重点实验室,郑州 450000;3.河南中医药大学第一附属医院呼吸科,郑州 450000;4.河南中医药大学呼吸疾病中医药防治省部共建协同创新中心,郑州 450046)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)作为一种全身性的疾病,其肺外常见并发症有心血管疾病、糖尿病、骨骼肌功能障碍和肠道功能障碍等[1-3],其中肠道功能障碍的症状包括腹胀、食欲减退、便秘、腹泻等[4-6],并进一步导致肺功能损害,影响疾病的预后。
COPD 与肠道功能障碍在病理上相关,主要表现在炎症、免疫、缺氧、微生物失衡等方面[7-9],尤其在炎症方面。前期临床研究表明,调补肺肾三法可以提高COPD 患者肺通气功能,改善临床症状,并可降低血清白细胞介素(interleukin,IL)-8、肿瘤坏死因子-α(TNF-α)、C-反应蛋白(CRP)水平,减轻炎症反应[10]。动物实验中也发现,调补肺肾三法可以改善COPD 大鼠肺功能,减轻肺病理组织损伤,降低大鼠IL-1β、IL-6、TNF-α 等炎症指标,改善局部及系统性炎症反应,且具有较明显的远后效应。研究还发现其对疾病所引起的食量与饮水量减少、形体消瘦、大便溏薄等胃肠道症状也具有改善作用[11-12],但是具体机制尚不清楚。因此,本研究采用病理学、免疫组化技术方法,观察并检测肺部与肠道炎症介质IL-6、IL-33 和干扰素(interferon,IFN)-γ 的表达,旨在探讨调补肺肾三法对COPD 稳定期大鼠肺与肠道炎症指标的调控,从炎症方面阐释“肺与大肠相表里”的科学内涵。
1 材料与方法
1.1 材料
1.1.1 实验动物
60 只8 周龄的SPF 级SD 大鼠,雌雄各30 只,体重为(200 ± 20) g,购买于济南朋悦实验动物繁育有限公司【SCXK(鲁)20190003】,并在河南中医药大学第一附属医院中心实验室饲养【SYXK(豫)2017-0001】,期间自由饮水、摄食,昼夜各半循环照明,相对湿度40%~ 70%,温度21~ 25℃。实验通过河南中医药大学的实验动物伦理委员会批准(DWLL2019020002)。
1.1.2 药物
脂 多 糖(LPS),美 国 Sigma 公 司,批 号:028M4094V;补肺健脾方(黄芪、白术、党参、茯苓等),补肺益肾方(人参、山茱萸、黄芪、枸杞子等),益气滋肾方(人参、麦冬、五味子、黄精等),来源于河南中医药大学药学院的药物分析实验室;氨茶碱,海南制药厂有限公司制药一厂,批号:国药准字H41020704。
1.1.3 主要试剂与仪器
红旗渠香烟,河南中烟工业有限责任公司;IFNG Polyclonal Antibody,武汉Elabscience 公司,批号:E-AB-40075;HE 染色试剂盒(批号:G1120)、羊抗兔IgG-HRP(批号:SE134)、5% BSA 封闭液(批号:SW3015)、PBS 磷酸盐缓冲液(批号:P1010),北京Solarbio 公司;0.01 mol/L 枸橼酸盐缓冲液(批号:AR0024)、Anti-IL-6 Antibody(批号:BA4339)、Anti-IL-33 Antibody(批号:M00113-2)、SABC 试剂盒(批号:SA1021)、3%过氧化氢(批号:AR1108)、中性树胶(批号:AR0038),武汉BOSTER 公司。
独立送风隔离笼具(苏州冯氏实验动物设备有限公司,中国),OLYMPUS-DP70 型显微镜及显微照相系统(Olympus 公司,日本),DNP-9082 型电热恒温培养箱(上海精宏实验设备有限公司,中国),全自动生物组织脱水机、超低温冰箱、生物组织石蜡包埋机(Thermo 公司,美国),RM2245 型切片机(LEICA 公司,德国)。
1.2 方法
1.2.1 造模、分组及给药
大鼠适应性饲养1 周,采用香烟烟雾暴露联合LPS 滴注法建立COPD 稳定期大鼠模型[13]:每天烟雾暴露2 次(烟熏箱烟雾浓度达到3000 ± 500 ppm),每次30 min;每周2 次将1 mg/kg 的LPS 滴入大鼠鼻腔,造模持续8 周。大鼠被随机分为空白(Control) 组、COPD 模型(Model) 组、补肺健脾(Bufei Jianpi,BJ)组、补肺益肾(Bufei Yishen,BY)组、益 气 滋 肾(Yiqi Zishen,ZS) 组、氨 茶 碱(aminophylline,Am)组,每组10 只,雌雄各半。第9~ 12 周,治疗组分别给予补肺健脾方、补肺益肾方、益气滋肾方、氨茶碱灌胃,剂量分别: 12.42 g/(kg·d)、11.61 g/(kg·d)、12.42 g/(kg·d)、27 mg/(kg·d),其余大鼠通过灌胃给予生理盐水,每日2 次,每周给大鼠称重以调整滴鼻及灌胃的剂量。药物剂量的计算使用等效剂量换算公式[14]。
1.2.2 指标检测
(1)大鼠一般情况
观察所有大鼠每天精神状态、皮毛光泽度及活动灵敏度、进食饲料量及大小便的情况,记录每周的体重。
(2)大鼠肺组织与结肠组织形态学
将大鼠麻醉,先后取出结肠组织与肺组织,用中性甲醛进行固定,经过石蜡包埋后切片,脱蜡后HE 染色,使用光镜观察组织的形态学变化。
(3)大鼠肺组织与结肠组织IL-6、IL-33 和IFNγ 蛋白水平
肺与结肠组织石蜡包埋后进行4 μm 切片,采用免疫组化试剂盒测定肺与结肠组织IL-6、IL-33 和IFN-γ 蛋白表达。
1.3 统计学分析
用SPSS 21.0 软件统计分析。结果用平均值±标准差()表示。采用单因素方差分析进行计量资料的组间比较。方差齐使用最小显著差法,方差不齐使用Dunnett’ sT3 法。采用Pearson 或Spearman 相关性分析,探讨大鼠肺中炎症介质水平与肠道炎症介质水平的相关性。P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况
Control 组大鼠状态良好。Model 组大鼠皮毛枯黄杂乱、无光泽,行动迟缓,精神逐渐萎靡,偶有喘鸣音,食量减少,大便稀溏或干结,消瘦。各治疗组大鼠精神状态好转、反应较灵敏,进食与体重增加,大便正常。
2.2 肺组织病理变化
Control 组大鼠支气管管壁与肺泡结构完整,黏膜上皮细胞整齐,偶有炎症细胞。Model 组大鼠支气管黏膜皱襞增多、变厚,管腔狭窄;肺泡壁断裂形成大气腔,支气管与肺泡腔出现大量炎症细胞及炎性渗出。各治疗组支气管及肺泡结构明显恢复,炎症细胞减少。见图1。
2.3 结肠组织病理变化
Control 组大鼠结肠黏膜完整而连续,未见炎症细胞。Model 组大鼠结肠黏膜损伤,上皮细胞破损、脱落,杯状细胞明显减少,炎症细胞浸润增多。各治疗组经药物干预后黏膜上皮恢复完整,偶有少量炎症细胞浸润。见图1。
2.4 肺与结肠中IL-6 的变化
肺组织IL-6 主要表达于气管与支气管上皮细胞、炎症细胞、小血管内皮细胞的细胞质中,结肠组织IL-6 主要表达于结肠吸收上皮细胞、固有层炎症细胞、小血管内皮细胞的细胞质中。与Control 组比较,Model 组肺组织与结肠组织IL-6 阳性染色增强,各药物干预组肺与结肠组织的IL-6 阳性表达均较Model 组有减少趋势。见图2A、2B。

图2 各组大鼠肺组织与结肠组织IL-6 的表达变化(,n=6)Note.A,C.Immunohistochemical photos and semiquantitative analysis of IL-6 in lung tissue (light microscope).B,D.Immunohistochemical photos and semiquantitative analysis of IL-6 in colon tissue (light microscope).Brown yellow is positive expression.Compared with control group,∗P <0.05,∗∗P <0.01.Compared with Model group,#P <0.05,##P <0.01.Compared with BJ group,ΔP <0.05,ΔΔP <0.01.Compared with BY group,▲P <0.05.Compared with ZS group,□□P <0.01.(The same in the following figures)Figure 2 Changes in levels of IL-6 in the lung and colon tissues of rats(,n=6)
Model 组肺组织IL-6(图2C)和结肠组织IL-6(图2D)与Control 组比较均明显升高(P<0.05,P<0.01)。与Model 组比较,各治疗组上述指标均有不同程度降低,其中BY、ZS 和Am 组肺组织IL-6显著降低(P<0.01),各治疗组结肠组织IL-6 均明显降低(P<0.05),且肺组织IL-6 在Am 组降低水平最为显著,结肠组织IL-6 在BY 组降低水平最为显著。Am 组肺组织IL-6 较各中药组明显降低(P<0.05,P<0.01)。BY 组肺组织IL-6 较BJ 组明显降低(P<0.05)。各治疗组间结肠组织IL-6 的变化无显著性统计学差异(P>0.05)。
2.5 肺与结肠中IL-33 的变化
肺组织IL-33 在气管、支气管上皮细胞、血管内皮、炎症细胞(以吞噬细胞为主)、环形平滑肌中均有表达,并主要以气道上皮及其周围浸润的炎症细胞为主,结肠组织IL-33 主要表达于结肠吸收上皮细胞的细胞质、固有层炎症细胞和部分黏膜肌层中,其中以吸收上皮细胞为主要表达部位。与Control 组比较,Model 组肺组织与结肠组织IL-33 阳性染色增强,各药物干预组肺与结肠组织的IL-33阳性表达均较Model 组有减少趋势。见图3A,3B。

图3 各组大鼠肺组织与结肠组织IL-33 的表达变化(, n=6)Note.A,C.Immunohistochemical photos and semiquantitative analysis of IL-33 in lung tissue (light microscope).B,D.Immunohistochemical photos and semiquantitative analysis of IL-33 in colon tissue (light microscope).Figure 3 Changes of IL-33 expression in lung and colon tissues of rats in each group (, n=6)
Model 组肺组织IL-33(图3C)和结肠组织IL-33(图3D)均较Control 组显著升高(P<0.01)。与Model 组比,各治疗组肺和结肠组织IL-33 均明显降低(P<0.05,P<0.01)。各治疗组间肺组织IL-33和结肠组织IL-33 的变化无显著性差异(P>0.05)。
2.6 肺与结肠中IFN-γ 的变化
肺组织IFN-γ 主要表达于气管、支气管上皮细胞、气管周围炎症细胞的细胞质中,结肠组织IFN-γ主要表达于结肠吸收上皮细胞的细胞质中。与Control 组比,Model 组肺组织与结肠组织IFN-γ 阳性染色明显增强,各治疗组肺组织与结肠组织IFN-γ阳性表达均较Model 组有减少趋势。见图4A,4B。

图4 各组大鼠肺组织与结肠组织IFN-γ 的表达变化(, n=6)Note.A,C.Immunohistochemical photos and semiquantitative analysis of IFN-γ in lung tissue (light microscope).B,D.Immunohistochemical photos and semiquantitative analysis of IFN-γ in colon tissue (light microscope).Figure 4 Changes of IFN-γ expression in lung and colon tissues of rats in each group(, n=6)
Model 组肺组织IFN-γ(图4C)和结肠组织IFN-γ(图4D)与Control 组比较均明显升高(P<0.05,P<0.01)。与Model 组比较,各治疗组上述指标均明显降低(P<0.05,P<0.01),且肺组织IFN-γ 在Am 组降低水平最显著,且结肠组织IFN-γ 在BJ 组降低水平最显著。各治疗组间肺组织IFN-γ 与结肠组织IFN-γ 的变化无显著性统计学差异(P>0.05)。
2.7 肺和结肠IL-6、IL-33 和IFN-γ 的相关性分析
大鼠肺IL-6 与结肠IL-6 水平呈正相关(P<0.01),肺IL-33 与结肠IL-33 水平呈正相关(P<0.05),肺IFN-γ 与结肠IFN-γ 水平呈正相关(P<0.01)。见表1。
表1 大鼠肺和结肠IL-6、IL-33 和IFN-γ 的相关性()Table 1 Correlation between IL-6,IL-33 and IFN-γ in rat lung and colon ()
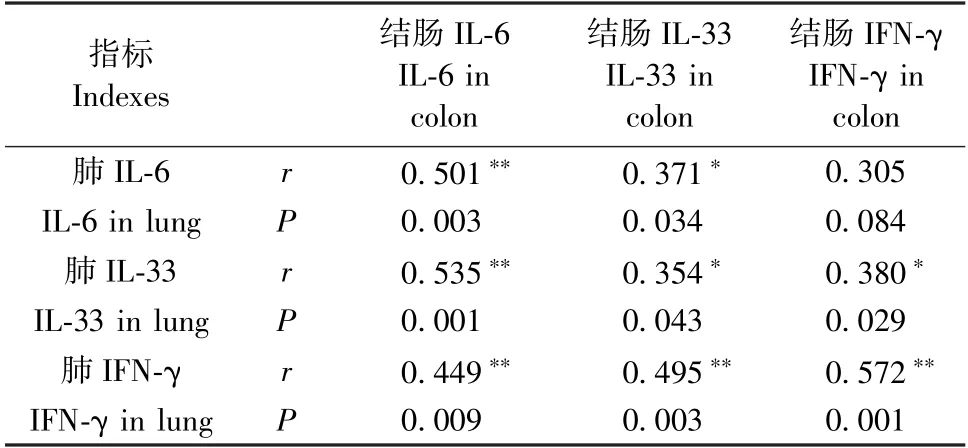
表1 大鼠肺和结肠IL-6、IL-33 和IFN-γ 的相关性()Table 1 Correlation between IL-6,IL-33 and IFN-γ in rat lung and colon ()
注:∗说明相关性在P <0.05 水平;∗∗说明相关性在P <0.01水平。Note.∗Correlation is significant at the 0.05 level.∗∗Correlation is significant at the 0.01 level.
3 讨论
中医学认为“肺与大肠相表里”,两者在经络上相互络属,构成表里关系。肺主一身之气,肺气肃降则气机调畅,布散津液,有利于大肠的传导;大肠为传导之官,传化物而不藏,传导正常,有利于肺气的肃降。反之,若肺病及肠,大肠传导功能失常,浊气壅阻,则出现腹胀、纳差、便溏和便秘等症状,引起肠道的功能障碍。
课题组前期临床证候研究表明,COPD 稳定期有肺肾气虚、肺脾气虚及肺肾气阴两虚等常见证候[15-16],调补肺肾三方不仅能减轻COPD 肺与全身炎症反应,还能明显改善疾病引起的胃肠道症状。现代研究表明,COPD 与肠道功能障碍在炎症、免疫、缺氧、微生物失衡等方面相关,尤其在炎症方面。因此,本研究通过探讨调补肺肾三法对COPD大鼠肺与肠道炎症介质的调控,从炎症方面阐释“肺与大肠相表里”的科学内涵。
COPD 是慢性炎症性疾病,患者肺部炎症细胞释放大量炎症介质,溢出肺外引发全身炎症[17]。肠道作为全身炎症反应的靶器官,在各种感染、炎症或者应激反应中,其结构和功能极易受到影响。有研究表明,香烟烟雾暴露所致COPD 小鼠模型中,肠道的完整性受损,结肠促炎细胞因子表达增加,并可能诱发肠道炎症性疾病[18]。本研究结果表明,COPD 大鼠支气管黏膜皱襞增多明显,管腔变窄,腔内可见粘液栓及炎性渗出,管壁周围可见大量炎性细胞浸润。肺泡结构紊乱,肺泡腔及肺泡间隔有较多炎性细胞浸润。研究还发现大鼠同时出现了结肠黏膜结构破坏,上皮细胞坏死脱落,黏膜大量炎症细胞浸润。调补肺肾三方治疗后上述情况均明显改善,支气管、肺泡和结肠黏膜结构恢复,肺与肠道炎症细胞浸润减少。提示COPD 不仅存在肺部病变,其肠道也出现结构破坏和炎症反应。调补肺肾三法不仅可以改善COPD 大鼠肺部炎症,也能恢复其肠道结构,减轻其肠道炎症反应。
炎症介质作为COPD 与肠道功能障碍在炎症反应中联系的关键点,在病情的发展及患者的预后中发挥重要作用。IFN、IL 作为较常见的细胞因子,具有介导炎症反应的作用,尤其IL-6、IFN-γ、IL-33[19]。IL-6 是一种多效性细胞因子,主要由T 细胞和巨噬细胞在人体内分泌,是COPD 炎症小鼠模型中升高程度最高的细胞因子[20-21]。IFN-γ 主要由活化的淋巴细胞产生,作为Th1 型促炎症细胞因子,IFN-γ 是先天性和适应性免疫的关键细胞因子,可调节上皮和内皮屏障功能,在病毒和细菌病原体清除中起到中心作用[22-23]。IL-33 是IL-1 细胞因子家族新发现的成员,属于Th2 型细胞因子,三者在肺部与肠道组织损伤和慢性炎症中起关键作用[24-26]。
本实验结果显示,COPD 大鼠不仅肺组织IL-6、IL-33 和IFN-γ 显著升高,结肠组织IL-6、IL-33 和IFN-γ 也明显升高,提示COPD 对肠道功能的影响可能与炎症因子有关。药物干预后三者均有不同程度降低,其中BY、ZS 和Am 组肺组织IL-6 显著降低,各治疗组肺组织IL-33 和IFN-γ 均显著降低,不仅如此,各干预组治疗后结肠组织IL-6、IL-33 和IFN-γ 也明显降低。提示调补肺肾三法不仅对肺部IL-6、IL-33 和IFN-γ 的表达有调节作用,还可以降低肠道中三者的释放,进而改善肠道功能障碍。通过相关性分析,发现肺IL-6 与结肠IL-6 水平呈正相关,肺IL-33 与结肠IL-33 水平呈正相关,肺IFN-γ和结肠IFN-γ 水平呈正相关,说明肺部炎症介质水平越高,肠道炎症介质表达越多,肺部炎症水平可影响肠道炎症。炎症介质IL-6、IL-33 和IFN-γ 在COPD 与肠道功能障碍的病理与治疗中的变化具有相关性,验证了炎症因子也可能是“肺与大肠相表里”的科学内涵之一。
综上所述,调补肺肾三法均可以改善慢性阻塞性肺疾病稳定期大鼠肠道功能障碍,其机制可能与抑制肺与结肠中IL-6、IL-33 和IFN-γ 的释放,降低肺与肠道炎症反应有关,这也进一步丰富了“肺与大肠相表里”理论的内涵。但调补肺肾三法在炎症反应中的作用差异并不明显,有待进一步研究。
