长期增温和围栏封育对高寒草原土壤微生物残体碳积累的影响不显著
2023-10-05种碧莹金显玲徐海燕吴晓东周文婷梁冰妍甘子鹏康国慧殊秋丽刘桂民
种碧莹, 金显玲, 徐海燕, 吴晓东, 周文婷, 梁冰妍, 甘子鹏,张 婷, 康国慧, 殊秋丽, 陈 卓, 刘桂民
(1. 兰州交通大学 环境与市政工程学院,甘肃 兰州 730070; 2. 中国科学院 西北生态环境资源研究院 冰冻圈科学国家重点实验室 藏北高原冰冻圈特殊环境与灾害国家野外科学观测研究站,甘肃 兰州 730000; 3. 青海省海北牧业气象试验站,青海 西海镇 810299)
0 引言
高寒草地是在高海拔地区长期受寒冷、干旱气候的影响形成的生态系统[1],其覆盖着青藏高原地表60%以上的面积。青藏高原高寒生态系统0~75 cm的土壤储存了大约33 Pg 的有机碳(OC)[2]。高寒草地易受气候变暖影响,气候变暖改变了草地的生物量、种群结构以及土壤碳氮含量等[3],其土壤中储存着的有机碳如果被分解,形成温室气体释放进入大气,可能会导致气候变暖的正反馈[4-6]。同时,过去几十年来,人类活动也显著影响草地生态系统的结构和功能。由于盲目开荒、过度放牧、滥挖草皮及药材等活动的破坏,我国草地面积急剧减少,草地土壤退化严重[7]。为了保护草地生态系统,围栏封育得到了广泛的应用。围栏主要通过阻止家畜进入草场,减轻对草地的采食和践踏,从而改善退化草地植物群落结构,增加物种多样性,提高草地生产能力,使土壤结构得到改善,养分含量增加,土壤微生物量和酶活性增加,逐渐实现草地的恢复[8]。
土壤有机碳来源于动植物残体、根际分泌物和微生物残体[9-10]。在土壤有机碳的形成与转化过程中,微生物通过其体内周转与体外修饰来完成[11]。当易分解的有机物输入时,微生物开始摄取养分来完成物质合成和生命活动,随着微生物的快速周转,微生物合成的有机组分不断以微生物残体的形式在土壤中累积[12]。微生物细胞壁的主要成分是氨基糖,其在微生物死亡后仍可在环境中长时间保存,因此土壤中的氨基糖主要来自于长期积累的微生物残体[13]。植物本身不能合成氨基糖,因此氨基糖可以指示微生物残体在土壤中的累积,而氨基糖通常占土壤有机碳总量的2%~5%[13]。土壤中MurA(胞壁酸)只来源于细菌,而GluN(氨基葡萄糖)主要来自于真菌,因此常用GluN/MurA 评价真菌细菌残体在土壤有机质转化过程中的相对贡献[14]。四种氨基糖在土壤中的周转时间有所差异,MurA 由于分子结构含有羧基,其的周转时间远小于其他几类氨基糖,加之GalN(氨基半乳糖)与外生菌根的结合,在土壤中更稳定。因而可以利用GluN/MurA 指示土壤中微生物碳的短期周转,利用GluN/GalN 指示土壤中微生物碳的长期周转[15]。
在全球变暖的背景下,土壤有机碳的转化和固存受到了广泛关注。有学者调查了蒙古草原表层土壤中木质素和氨基糖的分布情况,并与世界其他草原土壤的公开数据进行比较,结合模型模拟,发现微生物输入在土壤碳固存方面发挥比较大的作用,也更稳定[16-17]。Liang 等[18]的工作表明微生物残体对有机碳的贡献可占有机碳的50%以上。在不同的生态系统类型中,微生物残体对有机碳的贡献不同,这是因为不同生态系统凋落物和根际分泌物的化学结构和分解速率不同。在亚热带地区,微生物残体的浓度及其对有机碳的贡献受海拔和季节的影响,随着气候变暖,有机碳中积累的微生物残体,尤其是真菌残体将会减少[19]。在人工林生态系统中,单独施肥对微生物残体没有产生影响,但是氮磷配施显著刺激了真菌残体对有机质的贡献[20]。与全球草原相比,青藏高原草地生态系统中微生物残体碳含量较低,且取决于土层深度,表层主要与植物碳输入和矿物保护有关,在底层主要与黏土颗粒、铁铝氧化物和可交换钙的物理保护有关[21]。源数据分析结果表明,在全球草原和森林生态系统中,气候(干旱指数)和土壤环境(土壤碳氮)可能控制微生物残体的积累[22]。在青藏高原高寒草地10年的氮磷添加试验中,磷添加抑制了土壤微生物的死亡,但促进了植物木质素酚类物质的积累[23]。在短期和长期营养物质添加对西藏高寒草地微生物碳利用效率和碳积累效率的影响研究中,短期氮添加抑制了表土中氧化酶的活性,而长期营养添加显著改变了水解酶的活性。短期和长期的氮磷添加对微生物碳指标没有显著影响,微生物碳积累效率仅随着连续10 年的氮添加而增加[24]。在通过围栏封育对草地的恢复过程中,大量的地上和地下植物生物量刺激了微生物生长和残体积累[25-27],从而导致微生物残体在有机碳积累中占很大比例[28]。在温带草原通过围栏封育进行草地恢复试验中,随着恢复年限的增加,草地生态系统微生物残体来源碳贡献率较大,细菌对土壤有机碳的贡献率增加,而真菌对土壤有机碳的贡献率降低[29]。增温通过提高土壤温度及降低土壤含水量,从而直接或间接影响微生物群落组成、活性以及土壤酶活性,进而改变土壤微生物残体碳数量及组成[30-31]。例如,有研究认为增温可导致土壤微生物生物量降低,真菌和细菌优势种丰度下降[32],同时降低土壤酶活性。但是,不同的研究区或者不同的取样时间,微生物对增温的响应都不相同[33-34]。虽然针对微生物残体的研究取得了较多结果,但是针对长期围封和增温交互作用对高寒草原微生物残体碳积累的影响还不清楚。
为研究长期增温和围栏封育对高寒草原微生物残体碳积累的影响,本研究在2006年设置开顶箱式被动增温和围栏封育的高寒草原区试验场地进行取样。本研究的具体目标是:①量化增温和围栏封育对微生物残体积累的影响,②分析真菌和细菌对微生物残体碳的相对贡献,③明确高寒草原区增温和围栏封育下环境因子与微生物残体碳的关系。研究结果可揭示变暖和围封条件下微生物残体碳的变化特征,从而有助于认识气候变化和围封对高寒草地生态系统细菌和真菌来源的碳组分,确定细菌和真菌残体来源碳的固存比例。
1 材料与方法
1.1 研究区概况
研究样地位于青海省海北州海晏县,此样地为中国气象局海北牧业气象实验站的实验地(100°51′33″ E,36°57′33″ N)(图1)。实验地海拔3 140 m,在整个青藏高原上属于海拔相对较低的区域。从1980—2014年,年平均气温和年降水量分别为1.2 ℃和489 mm。80%的降水发生在生长季(5月至9月)[35]。依据中国土壤划分的标准,本研究样地的土壤类型为砂质土。本研究样地草地植被为典型的草甸化草原植物,主要由矮嵩草(Kobresia humilis)、针茅(Stipa capillata)、垂穗披碱草(Elymus nutans)、麻花艽(Gentiana straminea)和羊茅(Festuca ovina)组成[36]。本研究场地形平坦,草类分布均匀。

图1 实验地位置及样地设计:对照样地(围封外)(a),围封样地(b)和增温装置(c)(青藏高原数字高程模型来自文献[37])Fig. 1 Location of test site and the plot design: control plot (outside the enclosure) (a), enclosure plot (b) and warming device (c) (Digital elevation model of the Qinghai-Tibet Plateau is from Reference [37])
1.2 样地选择与样品采集
高寒草地模拟增温和围栏封育试验在2006年4月开始进行。本研究模拟增温采用开顶箱式被动增温(OTC),采用的是圆台型开顶箱,底部直径1.6 m,顶部直径1.2 m,高为0.4 m,圆台和地面夹角大约为60°。实验样地由两部分组成,一部分是围栏外(自由放牧),一部分是由20 m×40 m 围栏围成的一个矩形样地(图1)。在围栏外随机选取2 个10 m×10 m 的样方(一个靠近围栏,一个远离围栏),作为对照样地。在围栏内自东向西随机分布增温罩,由于海拔、增温罩放置时间相同,为排除围栏对增温样地重复间干扰,在围栏样地内选取6个增温样点,作为增温+围封样地。同时在围栏内未增温地选取3 个10 m×10 m 的样方,作为围封样地。两部分样地设计是为了验证增温和围栏封育对微生物残体累积的影响。
样品于2021 年8 月采集,在每个样方内用五点取样法采样,先去除表面可见的植物凋落物及腐殖质层,用土钻钻取0~10 cm、10~20 cm、20~30 cm 土壤,分别混匀,分装两份。一份立即风干用于测定土壤理化性质,一份冷冻干燥用于氨基糖的测定。以上所有土样均除去肉眼可见石子及根系,并过孔径为2 mm的土壤筛。
1.3 理化性质测定方法
土壤性质测定方法参照文献[38],土壤含水率采用105 ℃烘干恒重法测定;土壤电导率采用电导率仪测定;土壤pH 采用电位法(水土比为5∶1)测定;土壤粒径采用激光衍射粒度分析仪(Mastersizer 3000,英国)测定,并采用美国制分类标准进行分级,即黏粒(<0.002 mm)、粉粒(≥0.002~0.05 mm)及砂粒(≥0.05~2 mm);总氮(TN)采用Kjeltec 8400全自动凯氏定氮仪测定;土壤有机碳(SOC)采用Elementar vario TOC 分析仪高温燃烧法测定;碳氮比(C/N)由土壤有机碳(SOC)和总氮(TN)的比值得到。
1.4 氨基糖测定方法
土壤中的氨基糖利用酸水解的方法提取得到[39]。称取冷冻干燥后的土壤样品0.5 g 于10 mL水解瓶中,加入10 mL 6 M 的HCl 溶液,加盖密封,将水解瓶放置于培养箱中,在105 ℃条件下水解8 h。冷却至室温后,加入100 μL 1 mg·mL-1的内标肌醇溶液,振荡摇匀后过滤。置于旋转蒸发仪将烧瓶内溶液蒸干,残余物用20 mL 去离子水中溶解转移至准备好的聚四氟乙烯小瓶中,并用0.4 M KOH 溶液将pH 调至中性(pH 为6.6~6.8),然后以5 000 rpm·min-1离心10 min 去除沉淀。上清液转移至新的旋蒸烧瓶中旋转至干燥,用无水甲醇3 mL 溶解,并通过离心与盐分分离。将上清液转移到5 mL 衍生瓶中,在45 ℃条件下用N2吹干,再次加入1 mL去离子水,加入100 μg 的N-甲基氨基葡萄糖(定量内标),混合均匀并冷冻干燥(8 h 以上)。向干燥后的样品中加入300 μL 衍生试剂,加盖密封,震荡摇匀,在75~80 ℃温度下电磁炉加热30~40 min,其间振荡3~4 次使反应均匀。冷却至室温后,加入1 mL 乙酸酐,密封,再次加热25 min。冷却后,加入1.5 mL的二氯甲烷(目的萃取氨基糖衍生物),盖紧震荡使溶液混合均匀。去除过量衍生剂,剩余的有机相在45 ℃下用N2吹干后,加入400 μL 的乙酸乙酯-正己烷混合溶剂(V∶V=1∶1)溶解后转移至进样瓶中,通过气相色谱质谱联用仪进行测定。
样品中氨基糖的定量以肌醇为内标化合物进行计算,计算公式[40]为
式中:mi为添加的肌醇质量;Ax和Ai分别为样品测定中氨基糖和肌醇的峰面积;Rf为每种氨基糖的相对矫正因子,利用标准样品中氨基糖和肌醇的校正因子计算。
式中:std为该批样品的标准品。
土壤样品中氨基糖总量为
式中:GluN 为氨基葡萄糖;GalN 为氨基半乳糖;ManN为甘露糖胺;MurA为胞壁酸。
真菌和细菌来源的氨基糖碳的含量利用以下公式[41-42]计算。
式中:真菌残体碳和细菌残体碳单位均为μgC·g-1土;常数179.17 和253.23 分别为GluN 和MurA 的相对分子质量;9 为GluN 转化为真菌来源的氨基糖碳的转化系数;45为MurA转化为细菌来源的氨基糖碳的转化系数[13];GluN和MurA的单位均为μg·g-1土。
1.5 数据分析
采用Microsoft Excel 2019 进行数据统计,并用SPSS 26 进行数据处理,相关性分析采用皮尔森(Pearson)双尾检验法,利用Origin Pro 2022作图,采样图用ArcGIS 10.6绘制。
2 结果与分析
2.1 土壤理化性质
增温和围栏封育对土壤理化性质的影响如表1所示。围封、增温+围封处理土壤pH 和电导率随土层深度显著变化(P<0.05),对照处理土壤pH 和电导率随土层深度变化不显著(P≥0.05)。土壤含水率随土层深度增加显著下降(P<0.05)。同一土层不同处理间土壤含水率变化是增温+围封处理最高,围封处理次之,对照最低。

表1 增温和围栏封育下土壤理化性质和碳氮含量Table 1 Soil physicochemical properties and carbon and nitrogen content under warming and fencing treatments
增温和围栏封育下草原区土壤碳氮含量变化趋势一致,土壤有机碳和全氮均随土层深度增加显著降低(P<0.05),增温+围封处理土壤碳氮比随土层深度增加无显著变化(P≥0.05)。
与对照相比,增温+围封和围封处理土壤颗粒分布无显著差异。三种处理下土壤以粉粒和砂粒为主,其中粉粒占比最高49.40%~55.74%,砂粒占到37.84%~45.27%,黏粒仅占到5.33%~7.65%。
2.2 增温和围栏封育下土壤氨基糖含量及其对土壤有机碳的贡献
增温和围栏封育下土壤氨基糖含量和氨基糖对土壤有机碳的贡献如图2 所示,增温+围封和围封处理与对照区土壤氨基糖均随土层深度增加显著降低(P<0.05),同一土层增温+围封、围封处理与对照相比,氨基糖含量差异不显著(P≥0.05)。TAS/SOC 对照处理氨基糖含量随土层深度变化显著变化(P<0.05),围封、增温+围封处理TAS/SOC随土层深度无显著变化(P≥0.05)。同一土层增温+围封、围封处理与对照相比TAS/SOC 差异不显著(P≥0.05)。
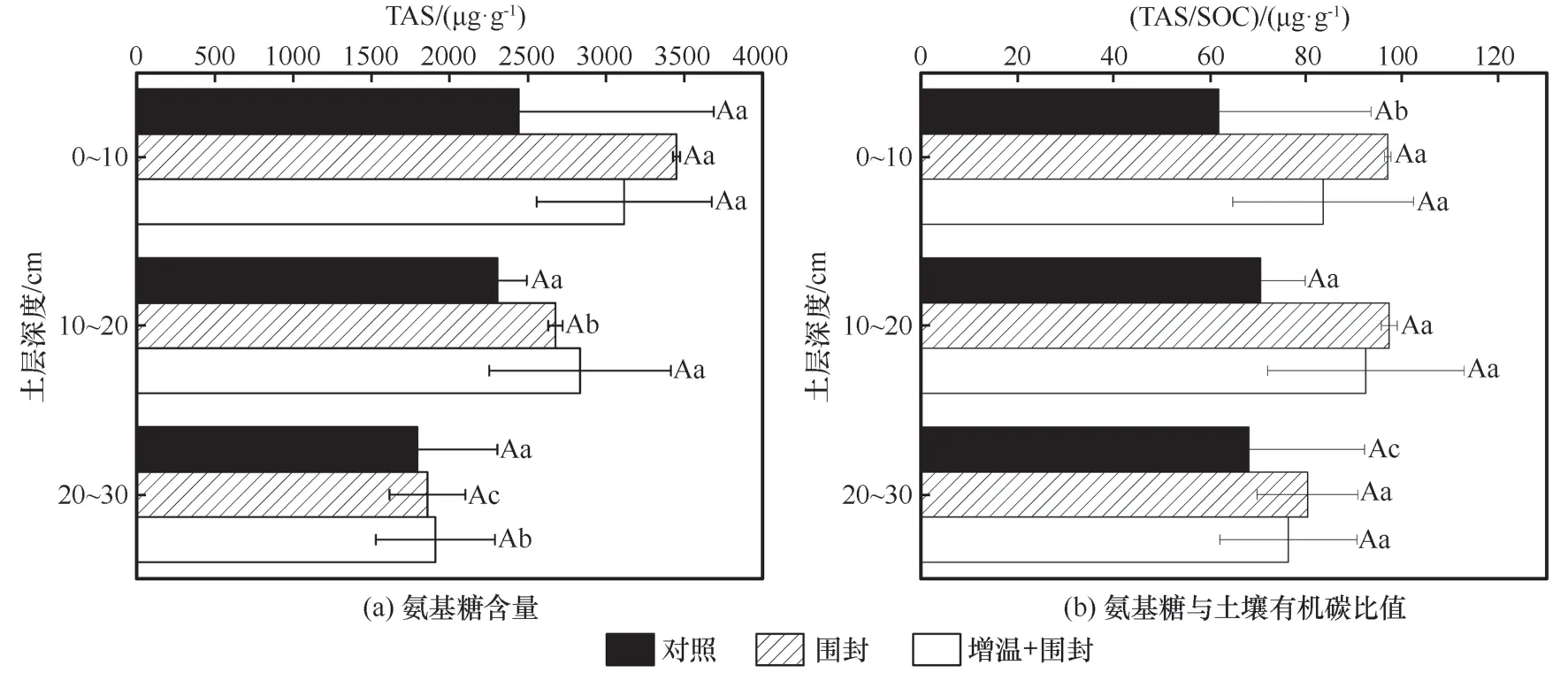
图2 增温和围栏封育下的氨基糖含量及氨基糖与土壤有机碳比值Fig. 2 Total amino sugar (TAS) content (a) and ratio of TAS to soil organic carbon (SOC) (b) under warming and fencing treatments
2.3 增温和围栏封育下不同来源微生物碳特征
增温和围栏封育下不同来源的微生物碳如图3所示,围封、增温+围封处理相比对照细菌、真菌残体碳无显著差异(P≥0.05)。同一处理不同土层深度间,细菌残体碳只有增温+围封处理下沿土层深度下降显著降低(P<0.05),围封处理细菌残体碳沿土层深度无显著变化(P≥0.05)。真菌残体碳在围封、增温+围封处理均沿土层深度下降而显著降低(P<0.05),对照土壤真菌残体碳沿土层深度无显著变化(P≥0.05)。
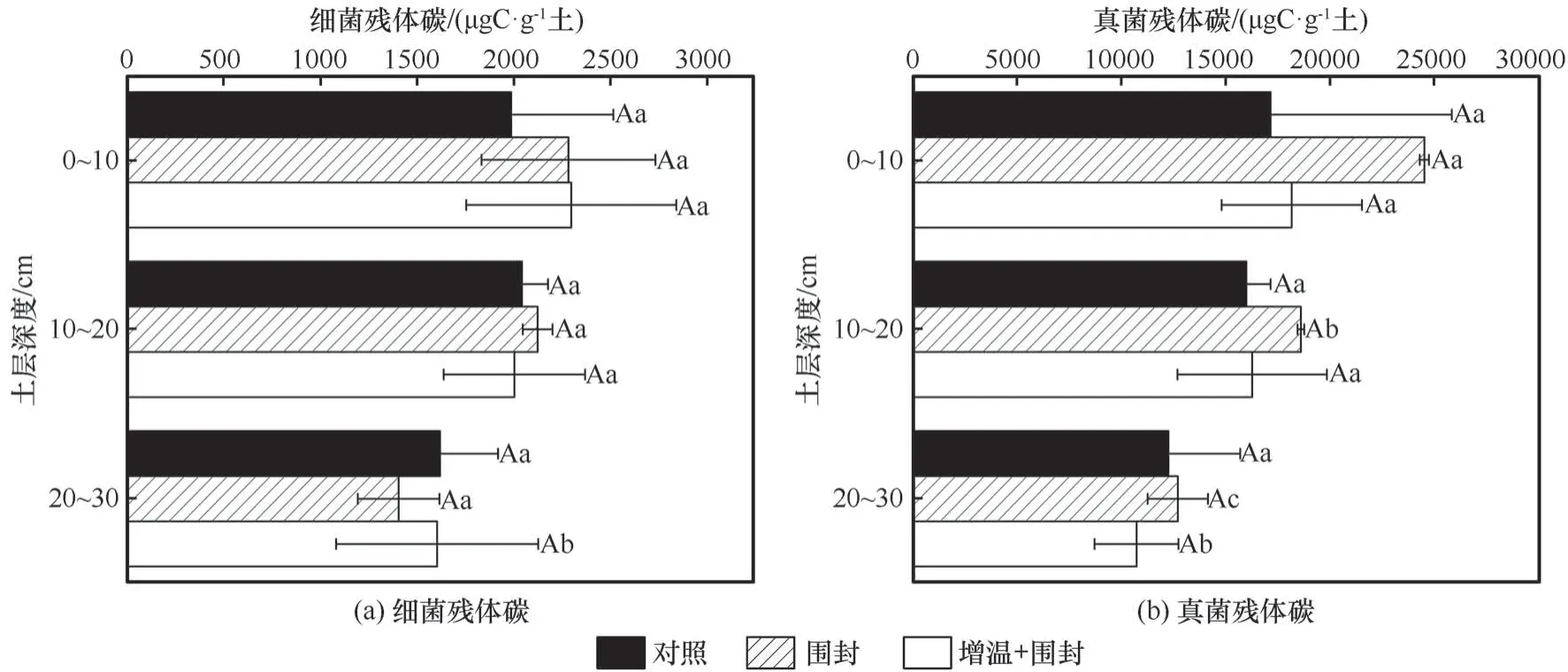
图3 增温和围栏封育下不同来源的微生物残体碳Fig. 3 Bacterial necromass carbon (a) and fungal necromass carbon (b) under warming and fencing treatments
2.4 增温和围栏封育下氨基糖参数特征
增温和围栏封育下氨基糖参数特征如图4 所示,GluN/GalN 指示土壤中微生物碳的长期周转,长期增温和围封条件下土壤中微生物碳随着土层深度增加土壤中微生物碳长期周转不断降低,与对照相比,增温+围封处理微生物碳显著降低(P<0.05),围封微生物碳无显著差异(P≥0.05)。GluN/MurA指示土壤中微生物碳的短期周转,长期增温和围封条件下三个处理随着土层深度增加土壤中微生物碳短期周转不断降低,同一土层增温+围封、围封处理与对照相比短期周转不显著(P≥0.05)。
2.5 增温和围栏封育下氨基糖及其参数与环境因子的相关性分析
增温和围栏封育下氨基糖及其参数与环境因子的相关性分析如表2 所示,TAS、真菌残体碳、细菌残体碳与电导率、土壤含水率、SOC、TN显著正相关(P<0.05)。TAS、GluN/MurA、GluN/GalN、真菌残体碳、细菌残体碳与颗粒组成无显著相关性(数据未进行展示)(P≥0.05)。
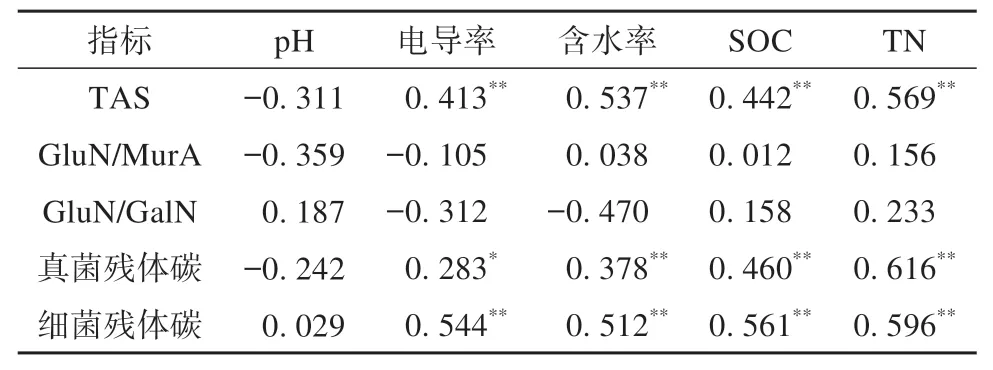
表2 氨基糖及其参数与环境因子的相关系数Table 2 Correlation coefficients of amino sugar and its parameters with environmental factors
3 讨论
3.1 增温和围栏封育对土壤基本性质的影响
由于会受到降水、蒸发以及盐分横向和纵向迁移的影响,土壤含水率、pH 和电导率是土壤的动态特征[43-45]。本研究中,同一土层深度增温+围封和围封处理土壤含水率无显著差异,且均显著高于对照处理土壤含水率,表明围封可以增加土壤含水率,这可能是由于围封后退化草场得到恢复,土壤持水能力增加,这与赵帅等[46]的研究一致。而增温+围封处理土壤含水率虽与围封处理土壤含水率无显著差异,但0~10 cm 土层增温+围封下土壤含水率低于围封处理,10~20 cm和20~30 cm土层土壤含水率均高于围封处理,可能是长期的增温和围封,增加了植被生物量和土壤有机碳,有利于土壤持水能力[47]。本研究中围封处理与对照相比pH 降低,增温+围封比围封pH 高,这反映了水分低、电导率高的土壤通常具有较高的pH值[48]。
本研究表明,SOC、TN 均沿土层深度的加深而降低,这是由于表层土壤积累的凋落物比较多,促进了有机质的积累,同时底层土壤有机质含量较少,导致出现表层大于底层[49]。在同一土层增温+围封处理SOC、TN 含量高于围封处理,由以下两个方面导致:一方面,围封增加了植被,凋落物增加有利于有机碳形成[50];另一方面,增温促进植物生长,根系分泌物增多,从而形成有机碳[51]。
3.2 增温和围栏封育对土壤氨基糖及其参数的影响
围封和增温均会导致氨基糖及其参数的改变,GluN、GalN、TAS、微生物源碳会随着草地恢复增加[29],而增温则会导致微生物量发生改变,从而使微生物残体增加或减少[52]。本研究在对照、围封、增温+围封处理下,同一土层氨基糖含量及TAS/SOC不显著,但是同一土层深度氨基糖含量和TAS/SOC 呈现对照<增温+围封<围封,说明围封可以增加氨基糖含量及氨基糖对有机碳的贡献程度,而增温却降低氨基糖的含量及其对有机碳的贡献。这是因为围封使得草地恢复,较大的根系生物量会刺激植物生长、残体物质的积累[53-54],地下生物量和凋落物生物量提供更多碳源,刺激根系沉积,增加了微生物残体[55]。
在青藏高原高寒草甸生态系统,0~50 cm 土层内,增温增加微生物残体碳,真菌对土壤有机碳库的比例是增加的[56]。而与Ding 等[57]在高寒草原的研究结果一致。增温对氨基糖研究结果的不一致性说明微生物残体对气候变化的响应具有生态系统特异性,可能是不同生态系统中土壤类型和水分、养分含量等因素导致。GluN/GalN 表示土壤中微生物碳的长期周转,也表示真菌和细菌在有机质转化过程中的相对贡献。在同一土层对照处理、围封处理显著高于增温+围封。这说明围封、增温处理均会降低微生物碳的周转,即在增温和围封处理下真菌相对细菌对有机碳的贡献降低。这与真菌残体碳和细菌残体碳的结果相一致,细菌残体碳含量均大于真菌残体碳。这可能是团聚体和黏土矿物对细菌残体的物理保护,使其免于分解[58],也可能是细菌残留物的优先积累[59]。
土壤氨基糖含量均随深度增加显著降低,TAS/SOC 对照处理土壤氨基糖含量随土层深度变化显著变化,围封和增温+围封下TAS/SOC 随土层深度无显著变化。这与GluN/GalN三个处理随着土层深度增加土壤中微生物碳长期周转不断降低,GluN/MurA 三个处理随着土层深度增加土壤中微生物碳短期周转不断降低,细菌残体碳只有增温+围封处理下沿土层深度下降显著降低,围封处理细菌残体碳沿土层深度无显著变化。而真菌残体碳在围封和增温+围封处理沿土层深度下降而显著降低,对照真菌残体碳沿土层深度无显著变化。这与Jia等[60]的研究结果一致,氨基糖含量底层低于表层,这是由于随着土层深度变化,温度降低了底层土壤微生物碳利用效率和残体积累效率,限制了土壤微生物的碳截获潜力,而对表层土壤微生物过程无显著影响。
3.3 土壤氨基糖及其参数与环境因子的关系
温度、土壤pH 值和质地的变化与微生物残体的积累和分解密切相关[61]。因此有必要研究增温和围封下氨基糖及其参数与环境因子的关系,TAS、真菌残体碳和细菌残体碳与电导率、土壤含水率、SOC、TN显著正相关。这与Hu等[61]的研究中,氨基糖及其参数的响应大多与SOC 和TN 的响应呈正相关的结果一致,说明微生物群落特性(生物量和组成)通过微生物细胞的产生和周转来驱动土壤微生物残留动态。TAS、GluN/MurA、GluN/GalN、真菌残体碳和细菌残体碳与砂粒、粉粒、黏粒均无显著相关性。这与Singh 等[62]研究中底层土壤的黏粒含量与氨基糖浓度显著正相关结果不一致,这可能是此地黏粒含量极低,黏土矿物对碳保护作用极低。
4 结论
本研究对增温和围栏封育高寒草原土壤的微生物残体碳进行了研究,量化了增温和围栏封育对微生物残体积累的影响,计算了真菌和细菌对微生物残体碳的贡献,明确了高寒草原区增温和围栏封育下环境因子与微生物残体碳的关系。研究结果表明,围封可以增加氨基糖含量及氨基糖对有机碳的贡献程度,而增温却降低氨基糖的含量及其对有机碳的贡献。增温和围栏封育条件对微生物残体碳的累积影响中,细菌比真菌对微生物残体碳的相对贡献大。围封、增温处理均会降低微生物碳的周转。
本结果揭示了变暖和围封条件下高寒草原表层30 cm 土壤微生物残体碳的变化特征,有助于认识气候变化和围封对高寒草地生态系统细菌和真菌来源的碳组分的影响,并确定细菌和真菌残体来源碳的固存比例。
