丛枝菌根真菌对酸胁迫下杉木幼苗生长生理的影响
2023-09-28李少青
李少青
(福建省三明市三元区林业局,福建 三明 365000)
杉木(Cunninghamialanceolata)材质优良、生长快,是我国南方片区重要的造林用材树种[1]。研究发现,杉木种植会带来土壤酸化,尤其是多代连作后导致土壤酸化明显,林木生长量大幅下降,地力衰退严重,成为限制杉木人工林高效培育的关键因子[2]。土壤pH能影响土壤中养分的存在状态及转化利用效率,较低pH是造成土壤酸化的根本原因。调查表明,在酸胁迫下杉木抗逆性低,林分质量较差[3]。
杉木林地中微生物种群丰富[4],地域不同,林龄不同,微生物群落特性及多样性也不同[5,6]。丛枝菌根真菌作为土壤微生物中普遍存在的群体之一,与80%以上陆地植物建立了良好的共生关系,能促进植物吸收营养,提升对逆境的适应性[7]。陈艳芳、陈郑洪等发现,杉木连作后,土壤中丛枝菌根真菌多样性指数、侵染率下降,土壤性质发生改变[8,9]。雷梅等通过接种丛根菌根真菌的方法,有效提升了杉木幼苗对养分的吸收[10]。然而,酸胁迫下丛枝菌根真菌对杉木生长的影响及其生理响应机制方面研究仍鲜见报道。为此,本研究以杉木幼苗为试验材料,通过菌根接种技术,探讨菌根真菌对酸胁迫下杉木生长和相关生理特性的影响,以揭示丛枝菌根真菌在提升杉木耐酸性方面的应用潜力。
1 材料与方法
1.1 试验材料
在福建三明市杉木优良种源试验林中,选择形质优良、无病虫害成年优树为采种母树,于2021年10—11月果实成熟时进行种子采集,待自然晒干、去杂后存放于4 ℃冰箱备用。次年3月将种子取出,经45 ℃温水浸种12 h后进行沙床播种。出苗后移至装有等体积比的黄心土、珍珠岩育苗杯中。当苗高15 cm左右时,选择长势较好、生长健壮幼苗为试验材料。
1.2 菌根接种
以北京市农林科学研究院植物营养与资源研究所提供的丛枝菌根化真菌摩西球囊霉(BGC NM01A)和地表球囊霉(BGC GD01C)为混合菌剂,在装有经高温高压灭菌的80%红壤与15%珍珠岩,以及含5%过磷酸钙的营养杯(8 cm×12 cm)中进行接种。每个营养杯中放入混合菌剂20 g,约含150孢子的BGC NM01A和500个孢子BGC GD01C。接种菌剂1个月后,采用醋酸墨水染色,取样侧根观察菌根侵染情况[11]。
1.3 酸胁迫处理
以高、径生长量无统计学上显著差异的未接种菌根(N)和菌根侵染明显(M)的两种苗木为研究对象,采用水培法,以1/2 Hoagland营养液为培养液,利用2 mol·L-1H2SO4溶液进行pH调整,参照梁海燕等[3]研究结果,设置pH 6.8(P1)、pH 5.5(P2)、pH 4.5(P3)3个酸胁迫处理,共6个处理:NP1、NP2、NP3、MP1、MP2、MP3。每处理设置4重复,每重复50株苗。试验在控制环境条件下处理30 d(温度25±1 ℃,相对湿度85%,光照强度180 μmol·m-2·s-1,光照时间16 h,每周更换1次培养液,每日充气1次,每次30 min)。
1.4 指标测定
幼苗高径生长增量:以试验处理期间高径生长增量表示,用卷尺、游标卡尺分别进行幼苗高度、地径的测量。
光合参数:各处理每重复选取植株中上部5片功能叶进行活体测定。其中,叶绿素含量采用便携式叶绿素速测仪测定,光合作用参数采用LI-6400光合作用仪测定。
光合产物含量:可溶性糖和淀粉含量测定均采用蒽酮比色法。
抗氧化指标:超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性及丙二醛(MDA)含量采用王尚堃[12]方法进行测定。
1.5 数据处理
数据采用SPSS19.0统计软件进行不同处理间差异显著性分析(P<0.05),图表采用Excel制作。
2 结果与分析
2.1 对幼苗生长的影响
由图1可以看出,供试酸胁迫处理下,随着pH降低,杉木幼苗的苗高、地径增量呈明显的下降趋势。从丛枝菌根真菌的影响看,除P1处理下,接种(M)与未接种(N)菌根幼苗高径生长无显著差异外,在P2和P3处理下,均以接种菌根幼苗的高径增量较大。这说明,在pH4.5~5.5范围内,杉木幼苗生长受到了明显的抑制作用,而通过菌根接种能有效改善苗木的生长情况。
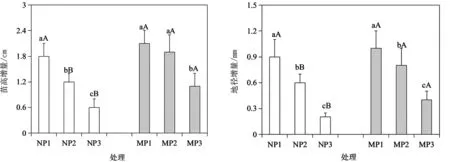
图1 丛枝菌根真菌对酸胁迫下杉木幼苗生长的影响
2.2 对幼苗光合能力的影响
光合作用是实现植物生长的关键生理代谢活动,直接影响着植物生长表现。从表1杉木幼苗光合参数变化来看,在P1处理下,除净光合速率(Pn)在接种菌根后显著增加外,叶绿素含量、蒸腾速率(Tr)、水分利用效率(WUE)、气孔导度(Gs)和胞间二氧化碳浓度(Ci)并未受到丛枝菌根真菌的影响。但在P2和P3处理下,接种菌根后幼苗叶片中叶绿素含量、Pn、WUE、Ci显著增大,而Tr、Gs显著减小。试验结果表明,在酸胁迫下丛枝菌根真菌有效提升了杉木幼苗光合能力。

表1 丛枝菌根真菌对酸胁迫下杉木幼苗光合参数的影响
可溶性糖和淀粉是植物通过光合作用形成的两大主要光合产物,直接反映植物光合能力。为进一步探究丛枝菌根真菌对酸胁迫下杉木幼苗光合能力的影响,分析了供试处理幼苗叶片中可溶性糖和淀粉含量的变化。由图2可知,在供试pH4.5~6.8范围内,随着pH减小,杉木幼苗叶片中可溶性糖与淀粉含量逐渐降低,但在接种菌根后,各酸处理幼苗叶片中可溶性糖与淀粉含量均显著增加。这说明,丛根菌根能显著提升杉木幼苗的光合代谢能力。
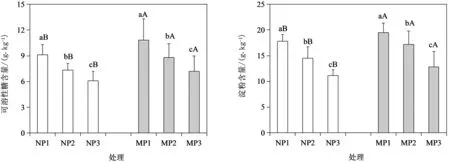
图2 丛枝菌根真菌对酸胁迫下杉木幼苗光合产物的影响
2.3 对幼苗抗氧化能力的影响
膜系统保护酶活性变化反映着植株遭受逆境胁迫伤害的情况,通常抗逆能力越强抗氧化酶活性越高。表2试验结果表明,pH越小,叶片中膜脂过氧化物丙二醛(MDA)含量越高,代表供试杉木幼苗受到的酸胁迫伤害程度越重。从酶活性变化看,随着pH减小,除SOD活性在接种菌根后表现为逐渐增大的趋势外,POD、CAT活性及未接种菌根的SOD活性均表现为先上升后下降的趋势。从接种与未接种菌根幼苗间MDA含量及酶活性差异看,除P1处理为无明显变化外,在P2、P3处理下,接种菌根后幼苗MDA含量下降,SOD、POD、CAT活性上升,这说明丛枝菌根真菌明显提升了杉木幼苗抗氧化能力,耐酸性增强。
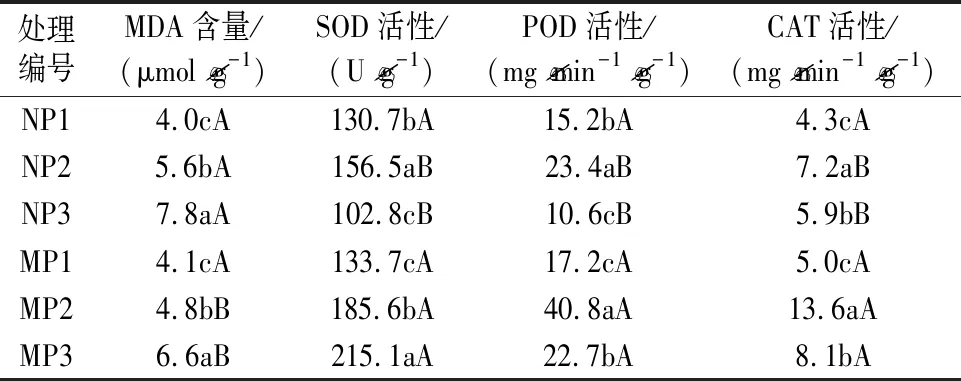
表2 丛枝菌根真菌对酸胁迫下杉木幼苗抗氧化能力的影响
3 结论与讨论
植物群落与土壤微生物群落之间存在着紧密联系,通过共同互生关系调节着生态系统的平衡[13]。研究证明,杉木林中丛枝菌根真菌群落丰富,林龄不同,群落组成也不同。但整体上看,在8~35年生杉木林中,以球囊霉属的丰度最高(28.77%~54.85%),而其他真菌的丰度相对较低(0.01%~2.72%)[6]。目前,有关丛枝菌根真菌对杉木幼苗的影响鲜见报道,雷梅等[10]通过接种摩西球囊霉方法实现了杉木幼苗对养分吸收效率的提升。本试验通过模拟自然状态下丛枝菌根真菌中群落组成,以优势种群球囊霉属中地表球囊霉和摩西球囊霉混合菌株为材料进行接种,有效改善了酸胁迫下杉木幼苗的生长效果,这为今后改善杉木耐酸性,实现杉木人工林高效培育提供了可靠的参考。但鉴于自然界中杉木林地丛枝菌根真菌的多样性,是否仍需进一步优化真菌种类的组成有待试验验证。
在pH4.5~6.8范围内,pH越小,杉木幼苗高径生长增量越低,这反映了当pH为4.5~5.5时,杉木受到了明显的酸胁迫伤害,这与以往有关pH在6.0以下时,杉木会遭受胁迫伤害的研究结论是一致的[3,14]。在pH为6.8时,丛枝菌根真菌对杉木幼苗生长无明显影响,这与雷梅等[10]的研究不同,这可能与苗期杉木生长缓慢,而试验处理时间较短(仅1个月)有关。但在pH为4.5~5.5时,丛枝菌根真菌表现出了明显的促生长效果,这暗示了相较正常生长条件,在逆境胁迫下丛枝菌根真菌更能有效提升杉木的抗逆性。从菌根的作用机制看,其本质在于提升共生植株对养分的吸收能力,从而缓解环境胁迫导致的营养失衡问题,保障植株生长所需养分。下一步研究丛枝菌根真菌对杉木营养元素的吸收、运输、转化方面的影响,对今后实现杉木精准施肥,解决土壤酸化导致杉木生长量下降的技术瓶颈有望提供科学、可靠的理论指导。
丛枝菌根真菌显著提高了杉木幼苗的光合能力,光合产物增加。从各光合参数对菌根的响应看,以净光合速率反应最为灵敏,即在pH为4.5~6.8时,接种菌根后幼苗叶片的净光合速率均显著增大。这表明,丛枝菌根真菌对杉木幼苗光合能力的改变主要是通过提升净光合速率,而非通过减少蒸腾失水等方式实现的。影响植物光合速率的影响因子有很多,除温度、湿度、光照等外在环境因子外,还与植株中营养元素、酶活性等内在因子有关[15,16]。这暗示了,基于光合速率增强的科学施肥方法或能增强杉木耐酸能力。
以往大量研究表明,膜系统保护酶具有双重生理指示意义[17,18]。在逆境胁迫下,植物组织中早期酶活性升高,代表其自身对逆境的自我调节能力,活性越强,表明遭受胁迫伤害越严重,而随着胁迫处理时间延长,酶活性降低,表明其膜系统遭到破坏,酶活性越低,胁迫伤害越大。本试验研究发现,随着pH增加,未接种菌根幼苗叶片中SOD、POD、CAT活性表现为先上升后下降,这与以往研究是相似的。但在接种菌根后,SOD却表现为随pH增加而增大的趋势。这暗示了,丛枝菌根真菌对酸胁迫下杉木幼苗的抗性提升可能与SOD活性增加有关。SOD活性与微量元素Cu、Zn密切相关,但丛枝菌根真菌是否主要通过增强植株对土壤中Cu、Zn吸收利用率,从而实现对植株抗氧化性、光合能力的增加,以及对幼苗生长的促进,有待进一步证实。
