砂仁渗漉汁脱色工艺优化及对肠道损伤的保护作用
2023-09-28向诗银李韦琴刘胜华廖子蔚
陈 阳,向诗银,李韦琴,王 喆,刘胜华,徐 剑*,廖子蔚
(1.劲牌有限公司 中药保健食品质量与安全湖北省重点实验室,湖北 黄石 435100;2.劲牌持正堂药业有限公司,湖北 黄石 435000;3.湖北省中药配方颗粒工程技术研究中心,湖北 黄石 435000)
砂仁(Amomum villosumLour.)属姜科豆蔻属多年生草本植物,广泛分布于我国的广东、福建、云南以及广西等省份[1]。砂仁滋味丰富,具有药食两用的功能,常被添加入高汤或米粥中以提高食品的滋味,也有将砂仁应用于酒体中作为保健酒中有效活性成分的报道出现[2-3]。砂仁全身均可入药,具有抗氧化、抑菌、保护胃黏膜、降血糖、抗癌等作用[4-6]。有研究表明,砂仁中的砂仁挥发油具有良好的胃肠保护作用,其主要功效成分为乙酸龙脑酯[7]。高湲等[8]以海南砂为研究对象,观察海南砂对胃溃疡大鼠胃粘膜的影响,结果发现,海南砂对大鼠胃粘膜损伤具有保护作用,其作用机制可能与提高胃粘膜中相关蛋白的表达能力有关。此外,槲皮素与乙酸龙脑酯联合使用对细菌脂多糖诱导的小鼠流产具有显著的保护作用[9]。实验室前期研究发现可使用清香型白酒为基酒将砂仁进行渗漉制备得到砂仁渗漉汁,再将适量的砂仁渗漉汁添加入酒体中可使得到的砂仁酒具有一定的保健作用。
砂仁渗漉汁是砂仁经过渗漉工艺制得的酒用添加剂,但由于其颜色较深,含有大量的植物色素,添加入酒体后对酒体的感官色泽影响较大,需要对砂仁渗漉汁进行脱色处理,并在脱色后保持其中的有效成分乙酸龙脑脂含量相对稳定,从而维持砂仁酒的保健作用。目前,常用的脱色方法主要有活性炭吸附法、双氧水氧化法以及树脂吸附法等,活性炭吸附法消耗时间较长,粒径较小,极易残留于料液中难以去除干净,影响产品品质;过氧化氢氧化法氧化强度较高,会对料液中的多糖、黄酮等有效成分造成破坏;树脂吸附法与前两种方法相比,具有成本较低、吸附效率高、稳定性强、可重复使用等优势在工业脱色过程中被广泛使用[10]。邱晓月等[11]比较了活性炭吸附法、双氧水氧化法和大孔树脂脱色法对祁白芷多糖的脱色效果,发现大孔树脂脱色效果优于其他两种,且脱色后祁白芷多糖的抗氧化性无明显变化。
目前,对砂仁渗漉汁进行脱色的报道较少,且无研究表明脱色前后的砂仁渗漉汁是否对胃肠道损伤有影响[12-13]。因此,本研究以脱色率和乙酸龙脑脂保留率为评价指标,利用单因素试验和响应面试验优化砂仁渗漉汁的脱色工艺,并建立大鼠脾虚泄泻模型,研究砂仁渗漉汁对大鼠肠道的保护作用,为砂仁渗漉汁在酒体中的应用提供数据支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
38%vol清香型白酒基酒:劲牌有限公司;砂仁渗漉汁:实验室自制;大黄(批号20210904)、砂仁:安徽亳药千草国药股份有限公司。砂仁经湖北师范大学张新潮副教授鉴定为姜科植物阳春砂(Amomum villosumLour.)的干燥成熟果实。
1.1.2 试剂
大鼠胃动素(motilin,MTL)酶联免疫吸附试剂盒:上海抚生实业有限公司;大鼠胃泌素(gastrin,GAS)酶联免疫吸附测定试剂盒:上海佰利莱生物科技有限公司;参苓白术散:北京同仁堂股份有限公司;D941大孔弱碱阴离子交换树脂:西安蓝晓科技有限公司;乙酸龙脑酯标准品(纯度>98%):中国药品生物制品检定所;无水乙醇(色谱级):中国医药集团有限公司。
1.1.3 动物
6周龄雄性大鼠60只,无特定病原体(specific pathogen free,SPF)级,个体质量150~170 g,由湖北省实验动物研究中心提供,许可证号:SYXK(鄂)2019-0108。饲养条件为清洁级实验环境,温度为22~25 ℃,相对湿度为65%~75%,饲料为常规消毒大鼠标准饲料,饮用水为超纯水。
1.2 仪器与设备
TU-1901紫外可见分光光度计:北京普析通用有限公司;AB135-S分析天平:梅特勒-托利多公司;7890B气相色谱仪、DB-1毛细管柱(30 m×0.25 mm,0.25 μm):安捷伦科技(中国)有限公司;BioTek酶标仪:美国伯腾仪器有限公司;渗漉筒:劲牌有限公司定制。
1.3 方法
1.3.1 砂仁渗漉汁制备和脱色工艺流程及操作要点
砂仁原料预处理→称取原料→渗漉→砂仁渗漉汁→树脂预处理→脱色→脱色砂仁渗漉汁
操作要点:
砂仁原料预处理:精选表面干净的干燥砂仁粉碎,过60目筛后收集筛下物,备用。
称取原料:精密称取1 kg过筛后的砂仁粉加入到渗漉筒中。
渗漉:加入砂仁粉10倍质量的38%vol清香型白酒基酒室温(20±3)℃密闭浸泡8 h。
定量:收集砂仁渗漉汁,加入38%vol清香型白酒基酒定容至20 L,得到砂仁渗漉汁,密闭,备用。
树脂预处理:称取D941阴离子交换树脂(以湿质量计算)200 g于5 L锥形瓶中,加入2 L纯净水,以120 r/min的转速摇动锥形瓶5 min,静置后移除上清液和上清液中的悬浮杂质,重复清洗树脂2~3次,至上清液pH为中性。然后移除上清液,并加入5倍体积的体积分数95%乙醇浸泡树脂2 h,最后使用纯净水冲洗树脂至酒精度小于2%vol,待用。
脱色:分别快速取600 g砂仁渗漉汁于2 000 mL锥形瓶中,共3份,按照砂仁渗漉汁与树脂质量比3∶1加入预处理后的D941阴离子交换树脂,pH为7.0,密闭锥形瓶,在50 ℃的水浴条件下恒温脱色6 h,快速冷却至-4 ℃趁冷过滤,得到脱色后的砂仁渗漉汁,密闭,备用。
1.3.2 砂仁渗漉汁树脂脱色工艺优化单因素试验
根据课题组预试验的结果,选取初始试验条件为砂仁渗漉汁与树脂质量比3∶1、脱色pH 7、脱色时间6 h、脱色温度50 ℃。分别考察砂仁渗漉汁与树脂质量比(1∶1、2∶1、3∶1、4∶1、5∶1)、脱色pH(5.0、6.0、7.0、8.0、9.0)、脱色时间(2 h、4 h、6 h、8 h、10 h)及脱色温度(30 ℃、40 ℃、50 ℃、60 ℃、70 ℃)对砂仁渗漉汁脱色效果的影响;以砂仁渗漉汁脱色率和乙酸龙脑酯保留率为评价指标,明确各个单因素的最佳脱色参数。
1.3.3 响应面法优化砂仁渗漉汁树脂脱色工艺
根据1.3.2项中单因素试验的结果,选取砂仁渗漉汁与树脂质量比(A)、脱色pH(B)、脱色时间(C)和脱色温度(D)为自变量,设定砂仁渗漉汁脱色率为响应值(Y),进行4因素3水平响应面优化试验,并对试验数据进行分析,从而确定最佳的脱色工艺参数,响应面试验设计因素与水平见表1。
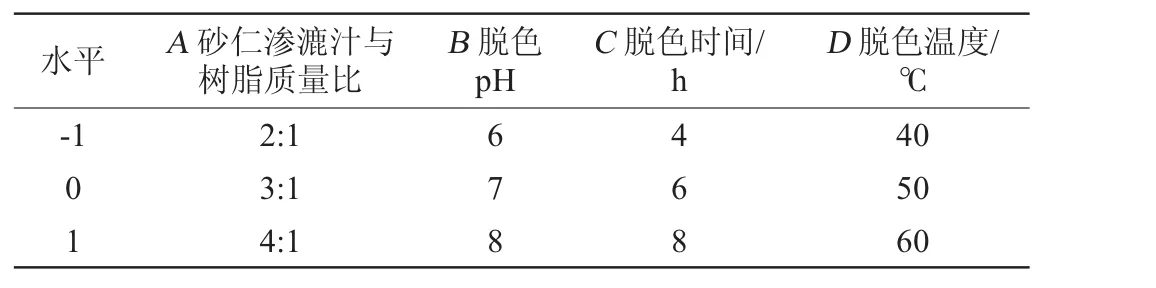
表1 砂仁渗漉汁脱色工艺响应面试验因素与水平Table 1 Factors and levels of response surface experiments for decolorization process optimization of Amomum villosum percolating juice
1.3.4 脱色率的计算
参考杨申明等[14]的方法,测定样品的脱色率。
1.3.5 乙酸龙脑酯保留率的测定
称取适量的乙酸龙脑酯标准品于10 mL容量瓶中,使用无水乙醇配制成质量浓度为0.3 mg/mL的乙酸龙脑酯标准品溶液。取样品约1 mL于25 mL容量瓶中,加无水乙醇定容至刻度线,称质量,超声处理0.5 h后自然冷却,再使用无水乙醇补足损失的质量,混匀,过0.22 μm微孔滤膜,取滤液,备用。参考黄绿等[15]的方法,采用气相色谱法测定乙酸龙脑酯的含量。
1.3.6 动物试验
(1)大黄药液的制备
取适量的生大黄粗粉碎,加入纯净水浸泡过夜,过滤收集滤液并在65 ℃下浓缩药液至质量浓度为1.5 g/mL用于大鼠脾虚泄泻模型建模。
(2)阳性药组的制备
参考石坤等[16]的方法,以参苓白术散作为阳性对照药。称取参苓白术散适量,按照说明书内容加入无菌水配置成终质量浓度为231.5 mg/mL的药液,即为阳性药组。
(3)砂仁渗漉汁样品的制备
取脱色前砂仁渗漉汁作为脱色前砂仁渗漉汁组备用,脱色后砂仁渗漉汁作为脱色后砂仁渗漉汁组备用。
(4)分组与建模
将60只SPF级大鼠随机分成6组,每组10只,分别命名为:空白组,模型组,阳性药组,基酒组(用于砂仁渗漉),脱色前砂仁渗漉汁组,脱色后砂仁渗漉汁组。除空白组以外,其余各组均需要进行建模,使用大黄药液(25 mL/kg)对大鼠进行灌胃,每天2次,连续建模7 d。当大鼠出现饮水减少、食欲降低、便溏、精神萎靡、嗜睡且毛发散乱等现象时,说明脾虚泄泻模型建模成功。然后分别使用同等剂量(15 mL/kg)的生理盐水(空白组)、生理盐水(模型组)、参苓白术散混悬液(阳性药组)、基酒(基酒组)、脱色前砂仁渗漉汁(脱色前砂仁渗漉汁组)、脱色后砂仁渗漉汁(脱色后砂仁渗漉汁组)对大鼠进行灌胃,每天1次,连续7 d。
(5)胃动素水平及胃泌素水平的测定
对最后一次各给药组的大鼠进行12 h禁食不禁水处理,用3%的戊巴比妥钠麻醉大鼠取血,4 ℃、3 500 r/min离心25 min,取上层血清,使用大鼠胃动素酶联免疫吸附试剂盒、大鼠胃泌素酶联免疫吸附试剂盒按照说明书上的操作方法测定各组大鼠血清的胃动素和胃泌素水平。
(6)大鼠肠道苏木精-伊红染色切片
分别取各组大鼠的结肠组织,使用生理盐水洗去肠道内容物,然后用滤纸吸去表面多余水分,经过4%多聚甲醛溶液固定36 h后,进行石蜡包埋、切片、苏木精-伊红(hematoxylin-eosin,HE)染色,最后观察结肠组织的病变情况。
1.3.7 数据处理
所有试验均重复进行3次操作,利用软件SPSS20.0对各组数据进行T检验分析;采用Origin8.6软件绘制图形;使用Design-Expert V8.0.6软件进行响应面试验设计与数据分析。
2 结果与分析
2.1 砂仁渗漉汁中色素特征吸收波长的确定
砂仁渗漉汁在200~800nm波长之间的吸收光谱见图1。由图1可知,砂仁渗漉汁中色素在波长276 nm处具有明显的特征吸收峰。因此,砂仁渗漉汁中色素的特征吸收波长为276 nm。
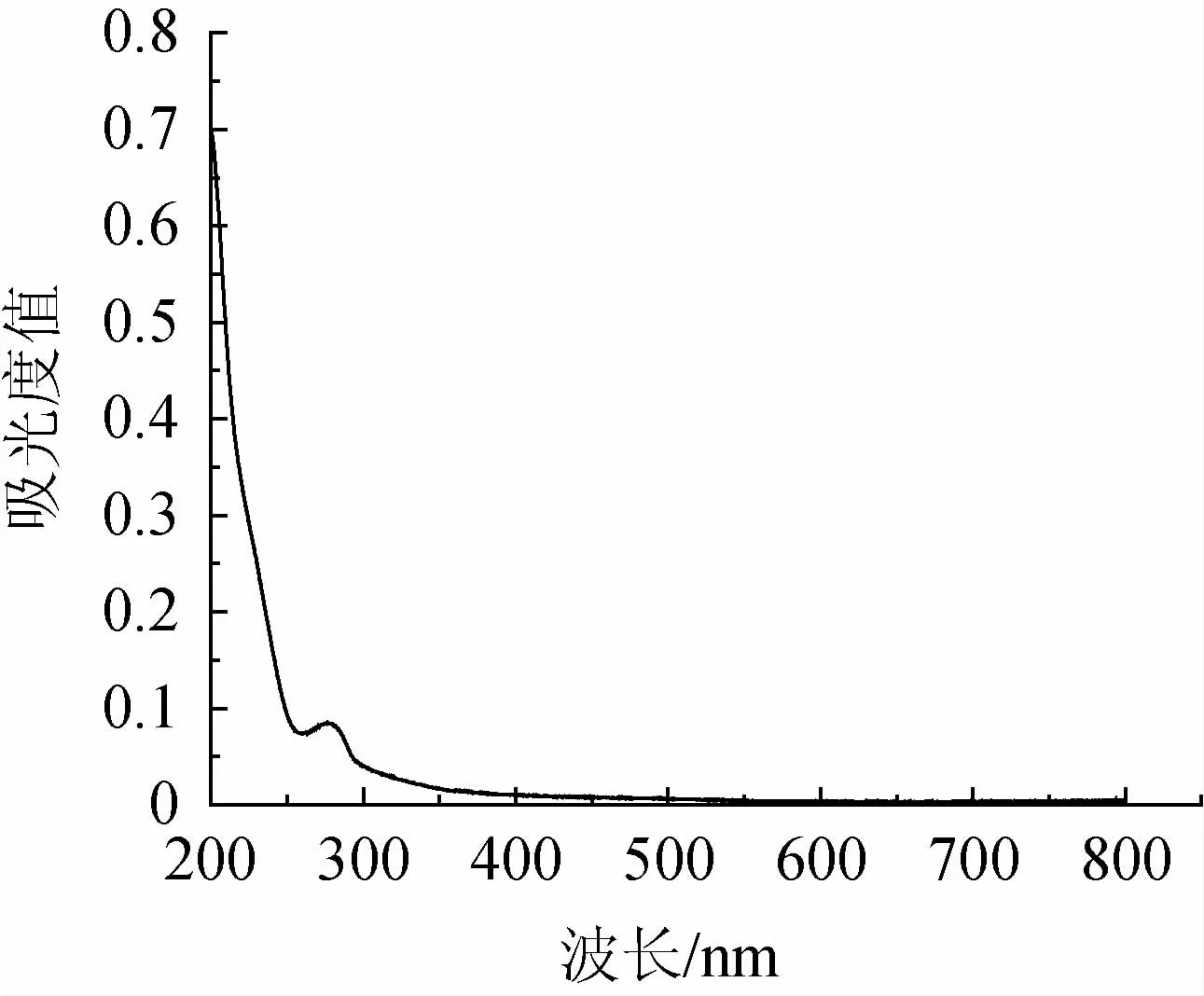
图1 砂仁渗漉汁的吸收光谱图Fig.1 Absorption spectrum of the percolating juice of Amomum villosum
2.2 砂仁渗漉汁脱色工艺优化单因素试验结果
课题组前期预试验发现砂仁渗漉汁在脱色过程中会导致其中的主要活性成分乙酸龙脑酯损失,从而影响砂仁渗漉汁的药理活性。在优化砂仁渗漉汁脱色工艺时不仅需要考虑提高砂仁渗漉汁的脱色率还需尽可能保留其中的活性成分乙酸龙脑酯。因此,单因素试验选择砂仁渗漉汁脱色率作为主要考察指标,乙酸龙脑酯保留率作为辅助考察指标。
2.2.1 砂仁渗漉汁与树脂质量比对砂仁渗漉汁脱色效果的影响
砂仁渗漉汁与树脂质量比对砂仁渗漉汁脱色效果的影响见图2。
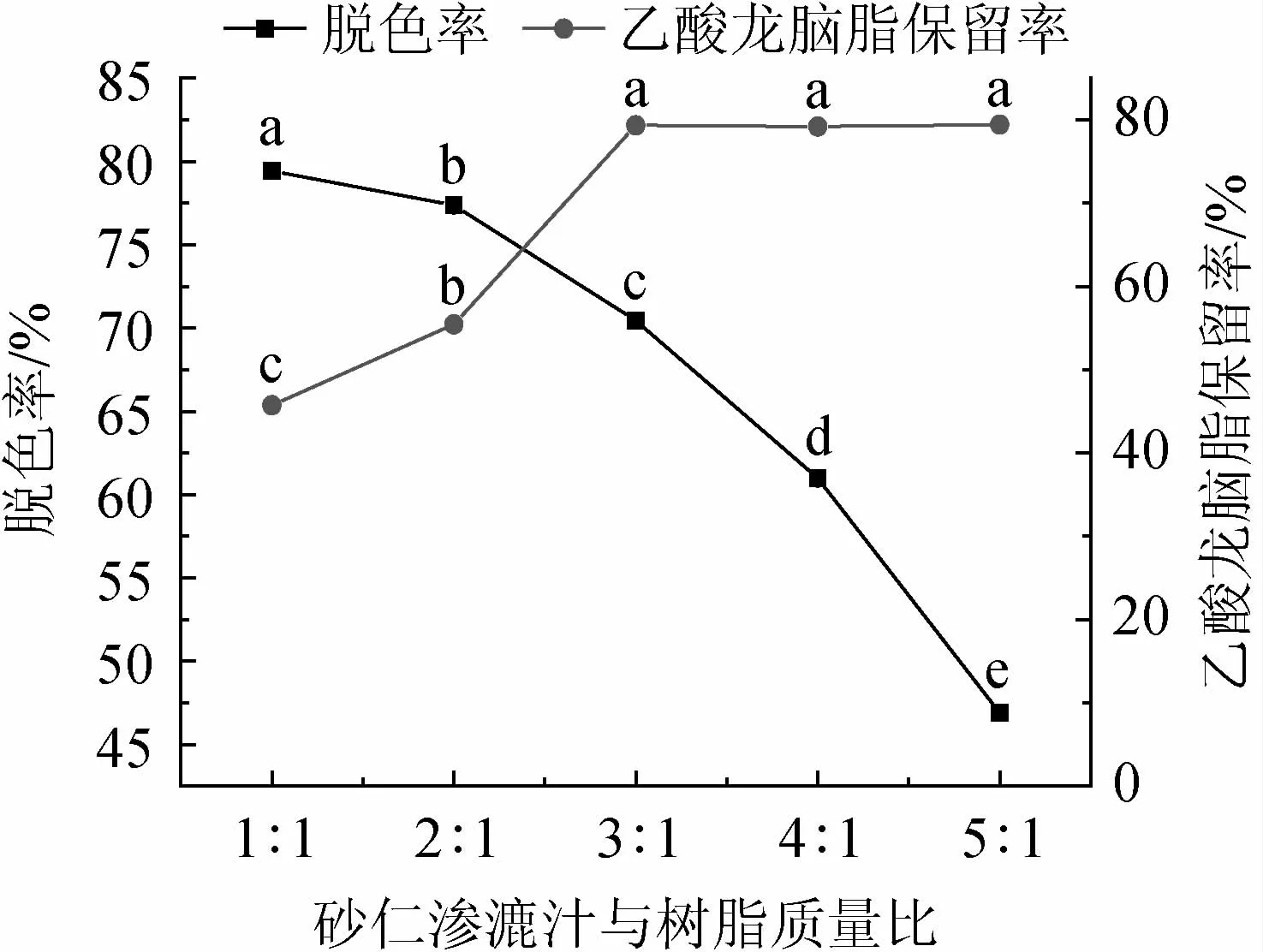
图2 砂仁渗漉汁与树脂质量比对砂仁渗漉汁脱色效果的影响Fig.2 Effect of mass ratio of Amomum villosum percolating juice to resin on the decolorization effect of A.villosum percolation juice
由图2可知,随着砂仁渗漉汁与树脂质量比的提高,砂仁渗漉汁脱色率逐渐降低,乙酸龙脑酯保留率先升高后基本不变。因为大孔树脂不仅能吸附色素还能吸附乙酸龙脑酯,当树脂吸附能力逐渐饱和时,树脂表面吸附活性位点数量被色素占据,乙酸龙脑酯几乎不再吸附,出现脱色率显著降低(P<0.05),而乙酸龙脑酯保留率无显著增加的现象(P>0.05)[17]。当砂仁渗漉汁与树脂质量比为3∶1时,脱色率下降幅度较小且乙酸龙脑酯保留率最高。因此,最佳砂仁渗漉汁与树脂质量比为3∶1。
2.2.2 脱色pH对砂仁渗漉汁脱色效果的影响
脱色pH对砂仁渗漉汁脱色效果的影响见图3。由图3可知,砂仁渗漉汁pH值在5~7之间时,脱色率逐渐提高,当pH值为7时,脱色率达到最高值(70.22±0.10)%,当pH值高于7时,脱色率开始明显下降(P<0.05),这可能是因为砂仁渗漉汁中存在酚类物质,碱性环境会使料液颜色更深,降低脱色效果[11]。在pH 5~9之间进行脱色操作,各组的乙酸龙脑酯保留率均在80%以上,无显著统计学差异(P>0.05)。因此,确定最佳砂仁渗漉汁脱色pH值为7。
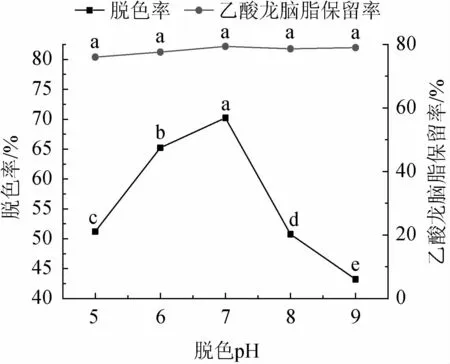
图3 脱色pH对砂仁渗漉汁脱色效果的影响Fig.3 Effect of pH on the decolorization effect of Amomum villosum percolation juice
2.2.3 脱色时间对砂仁渗漉汁脱色效果的影响
脱色时间对砂仁渗漉汁脱色效果的影响见图4。由图4可知,随着脱色时间的延长,砂仁渗漉汁脱色率先升高再保持稳定,脱色时间6 h时脱色率达到最高,且此时随着脱色时间的延长,乙酸龙脑酯保留率开始下降,这可能是因为脱色6h时,树脂对砂仁渗漉汁中的色素吸附量已达到饱和状态,脱色过程基本达到平衡状态,而当脱色时间大于6 h时,树脂对乙酸龙脑酯仍具有吸附能力,从而导致乙酸龙脑酯保留率逐渐下降。因此,确定最佳脱色时间为6 h。
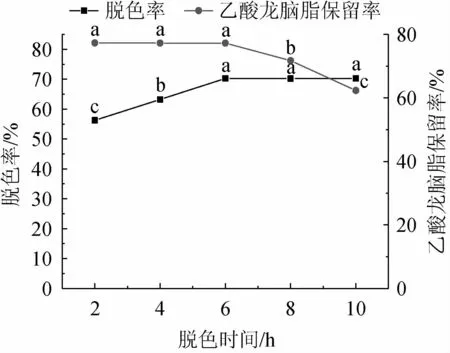
图4 脱色时间对砂仁渗漉汁脱色效果的影响Fig.4 Effect of time on the decolorization effect of Amomum villosum percolation juice
2.2.4 脱色温度对砂仁渗漉汁脱色效果的影响
脱色时间对砂仁渗漉汁脱色效果的影响见图5。由图5可知,随着脱色温度的提高,砂仁渗漉汁脱色率逐渐升高,脱色温度为50 ℃时,脱色率最高为(70.13±0.11)%,当温度继续升高时脱色率逐渐下降。温度升高加速反应体系中色素与树脂柱活性位点的碰撞结合机率,促使脱色率提高,但当脱色温度超过最适脱色温度时,色素与树脂活性位点的解析机率增大,出现脱色效果下降的现象[18-19]。当脱色温度为50 ℃时脱色率最高且此时乙酸龙脑酯保留率未出现显著下降(P>0.05)。因此,最佳脱色温度为50 ℃。

图5 脱色温度对砂仁渗漉汁脱色效果的影响Fig.5 Effect of temperature on the decolorization effect of Amomum villosum percolation juice
2.3 砂仁渗漉汁脱色工艺优化响应面试验
2.3.1 响应面多元回归方程的建立
根据表2中的响应面试验数据结果,使用Design-Expert V8.0.6软件进行多元回归方程拟合分析,得到以砂仁渗漉汁脱色率为响应值的多元回归方程式:Y=68.29-0.60A-1.10B+0.18C+2.16D-8.20AB-0.53AC+0.42AD+1.39BC-2.37BD-0.013CD-5.42A2-8.52B2-3.86C2-7.78D2。

表2 砂仁渗漉汁脱色工艺条件优化响应面试验设计及结果Table 2 Design and results of response surface experiments for decolorization process optimization of Amomum villosum percolation juice
2.3.2 响应面模型方差分析
利用Design-Expert 8.0.6软件对砂仁渗漉汁脱色工艺优化响应面模型进行方差分析以及显著性检验,结果见表3。
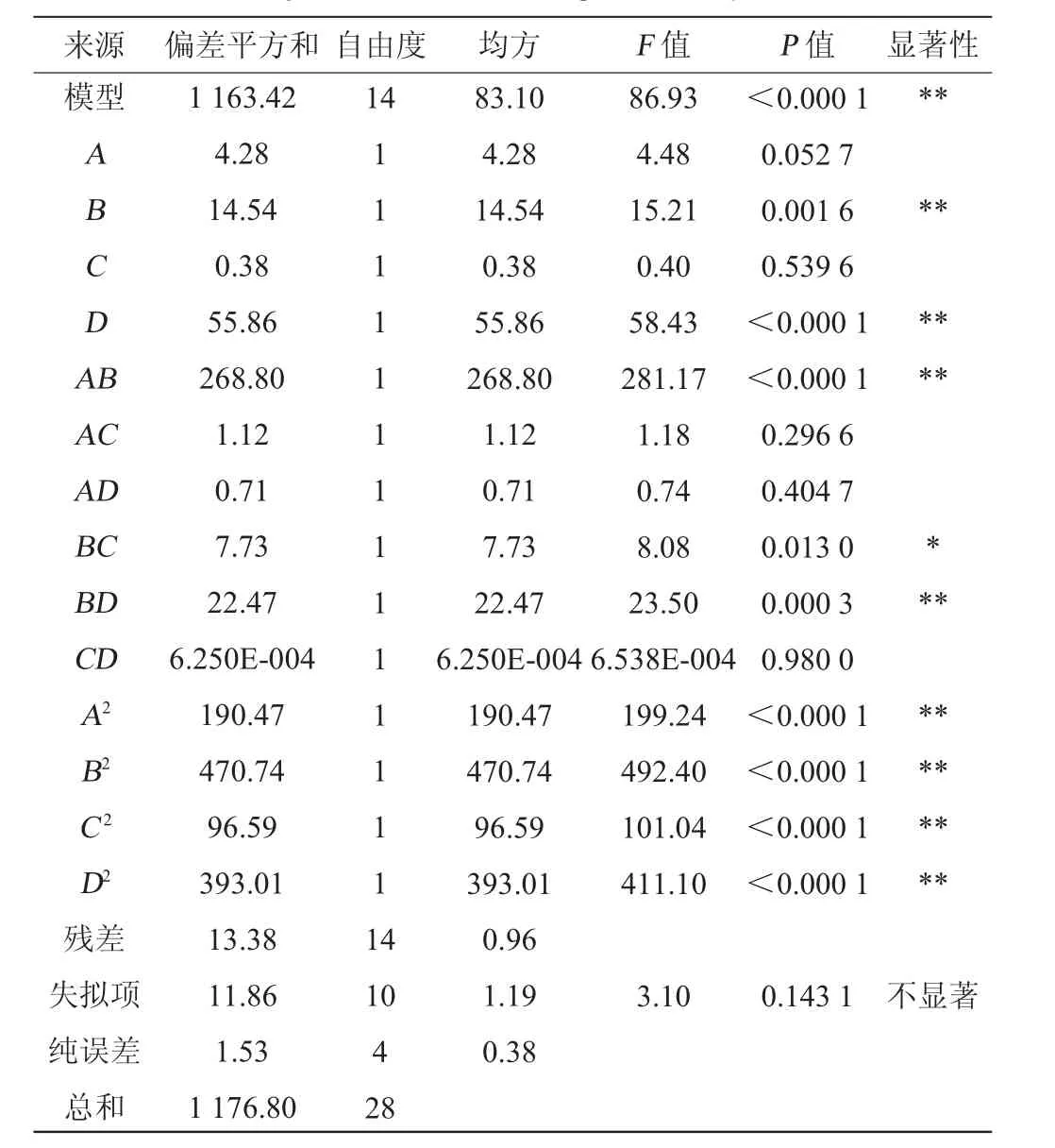
表3 回归方程模型方差分析Table 3 Analysis of variance of regression equation model
由表3可知,模型项P<0.000 1且失拟项P=0.1431>0.05,表明多元回归方程模型极显著,且失拟项不显著,模型与数据之间具有较高的拟合度,可以用来优化砂仁渗漉汁的脱色工艺[20]。由P值可知,一次项B、D、交互项AB、BD、二次项A2、B2、C2和D2对砂仁渗滤汁脱色率的影响极显著(P<0.01),交互项BC影响显著(P<0.05),一次项A、C、交互项AC、AD以及CD对砂仁渗滤汁脱色率的影响不显著(P>0.05)。比较F值的大小可知,各因素对砂仁渗漉汁脱色率的影响大小顺序为:D>B>A>C,即脱色温度>脱色pH>砂仁渗漉汁与树脂质量比>脱色时间。另外,本试验中多元回归方程模型的决定系数为R2=0.988 6,且调整决定系数R2Adj=0.977 3,说明通过该多元回归方程模型得到的优化试验结果相关性和可信度均较高,可以利用该模型分析和预测砂仁渗漉汁的脱色率[21]。
砂仁渗漉汁与树脂质量比、脱色pH、脱色时间和脱色温度4个因素之间的交互作用对砂仁渗漉汁脱色率的影响见图6。
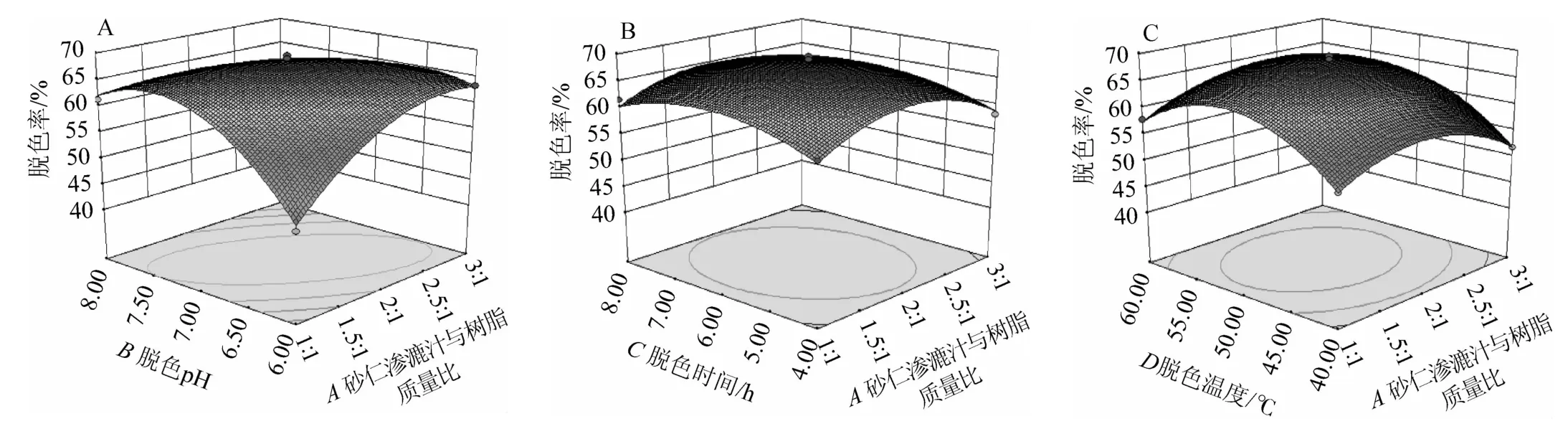
图6 各因素之间交互作用对砂仁渗漉汁脱色率影响的响应面和等高线Fig.6 Response surface plots and contour lines of effects of interaction between various factors on the decolorization rate of Amomum villosum percolation juice
由图6可知,砂仁渗漉汁与树脂质量比与脱色时间、砂仁渗漉汁与树脂质量比与脱色温度、脱色时间与脱色温度之间的交互作用等高曲线近似于圆形,说明两两之间的交互作用对砂仁渗漉汁脱色率的影响均不显著(P>0.05),这与表3中显著性分析结果一致[22]。通过响应面软件对砂仁渗漉汁最佳脱色工艺条件进行预测,获得砂仁渗漉汁脱色的最佳工艺参数为砂仁渗漉汁与树脂质量比2.02∶1,脱色pH 6.90,脱色时间6.01 h,脱色温度51.54 ℃,预测获得的砂仁渗漉汁脱色率最高为68.50%。结合生产实际操作的便捷性,将最佳脱色工艺条件修正为砂仁渗漉汁与树脂质量比2∶1,脱色pH 6.9,脱色时间6 h,脱色温度51 ℃。在此最佳脱色工艺条件下分别进行三次验证试验,砂仁渗漉汁脱色率实际值为(68.96±1.05)%,与多元回归方程得到的预测值相近,另外,乙酸龙脑酯保留率为(79.76±0.95)%,有效成分保留率较高,表明优化后的脱色工艺实用性较好。
2.4 大鼠胃动素和胃泌素的变化
中医理论认为脾虚会导致胃肠动力功能失调,消化能力降低,胃肠内的激素水平也相应下降。胃动素和胃泌素是表征胃肠运动能力的两种典型代表激素,其中胃动素主要对胃肠道上的平滑肌起作用,能促进胃收缩和肠道分节运动,而胃泌素可以刺激胃酸以及胃蛋白酶原加速分泌,两者的水平上升能较好的指示样品在健脾方面的效果[23-25]。各试验组对大鼠MTL及GAS的影响见图7。
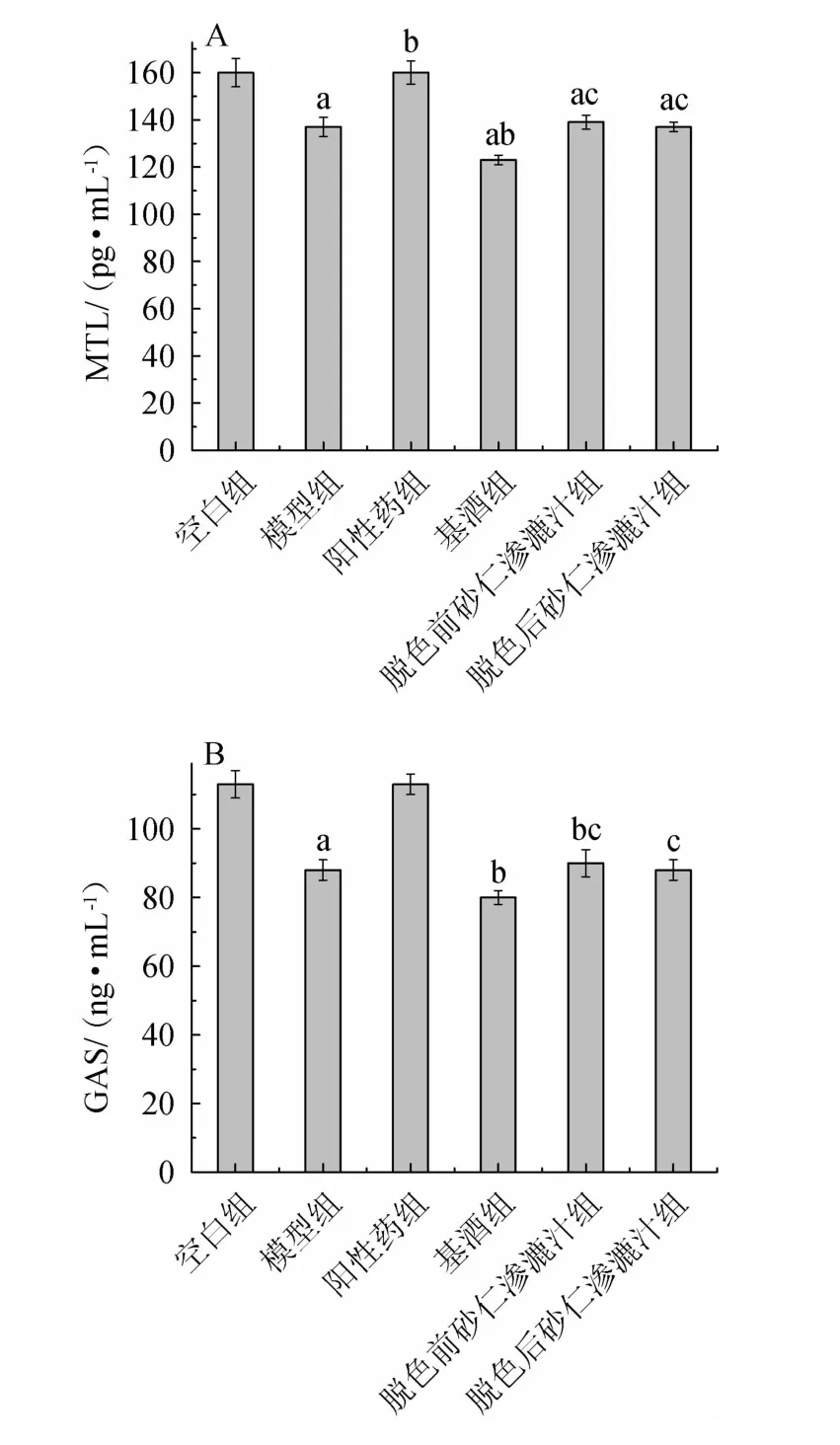
图7 各试验组对大鼠胃动素(A)和胃泌素(B)的影响Fig.7 Effect of each drug administration group on motilin (A) and gastrin (B) in rats
由图7A可知,与空白组相比,除阳性药物组外,其余各组大鼠的胃动素水平显著降低(P<0.05)。与模型组比,阳性药物组胃动素水平显著升高(P<0.05),而基酒组显著降低(P<0.05),这说明阳性药能有效提高大鼠的胃动素水平,而基酒能降低大鼠胃动素水平,这项研究结果与张云东等[26]的研究结果相似。与基酒组相比,脱色前后砂仁渗漉汁组的胃动素水平均有显著提高(P<0.05),这说明砂仁渗漉汁中的砂仁对大鼠胃动素水平的提高有一定的作用。由图7B可知,与空白组相比,模型组大鼠的胃泌素水平显著降低(P<0.05)。与模型组相比,基酒组大鼠的胃泌素水平显著降低(P<0.05),脱色前后砂仁渗漉汁组的胃泌素水平均显著提高(P<0.05)。与基酒组相比,脱色前后砂仁渗漉汁组的胃泌素水平均显著提高(P<0.05)。结果表明,以基酒作为溶剂制备的砂仁渗漉汁能有效降低基酒对脾虚大鼠的胃肠道损伤。
2.5 大鼠肠道HE染色切片
由图8可知,模型组大鼠结肠组织结构被明显破坏,上皮杯状细胞数量减少且出现炎性细胞浸润现象。与模型组大鼠相比,空白组和阳性药组大鼠的结肠组织染色切片形态正常,上皮杯状细胞以及黏膜较为完整,未出现炎性细胞浸润的现象,而基酒组大鼠上皮和黏膜破坏程度较高,出现大量炎性细胞浸润现象。与基酒组相比,脱色前后砂仁渗漉汁组大鼠的结肠组织完整性均稍有缺失,杯状细胞排列未出现散乱现象,其基层仍然存在少量的炎性细胞,这说明砂仁可能具有降低肠道组织损伤的功效,这项结果与2.4项中的试验结果基本一致。
3 结论
本试验以砂仁为主要原料制备砂仁渗漉汁,并对砂仁渗漉汁进行脱色工艺研究,以脱色率作为评价指标,通过单因素试验和响应面试验确定砂仁渗漉汁的最佳脱色工艺参数为砂仁渗漉汁与树脂质量比2∶1(g∶g),脱色pH 6.9,脱色时间6 h,脱色温度51 ℃。在此优化参数下,砂仁渗漉汁脱色率为(68.96±1.05)%,乙酸龙脑酯保留率为(79.76±0.95)%。另外,本研究建立大鼠脾虚泄泻模型,并研究各样品组对大鼠胃肠道损伤的影响,发现以清香型白酒基酒作为渗漉溶剂制备的砂仁渗漉汁在脱色前后均能有效降低清香型白酒基酒对脾虚大鼠的胃肠道损伤。因此,砂仁渗漉汁可作为一种潜在的保护胃肠的酒用资源,从而扩大砂仁的应用空间。本研究为砂仁渗漉汁在酒体中的应用提供了试验依据,但本研究应用的砂仁渗漉汁中成分复杂,有待进一步分离、纯化,进而明确是何种成分对胃肠道损伤具有保护作用。
