IGF-1过表达的骨髓间充质干细胞保护软骨细胞免受IL-1β诱导的损伤
2023-09-28向文远邓迎杰
向文远, 易 林, 邓迎杰, 方 锐
(1新疆医科大学第四临床医学院, 乌鲁木齐 830054; 2新疆医科大学附属中医医院骨二科, 乌鲁木齐 830099)
骨关节炎(Osteoarthritis,OA)是临床最常见的骨关节退行性疾病,以关节软骨破坏、变性以及骨质增生为主要表现,其中关节软骨缺乏血液供应且易受损,一旦损伤就难以自身修复[1]。因此,关节软骨修复是国内外研究的热点[2]。
骨髓间充质干细胞(Bone marrow mesenchymal stem cells,BMSCs)作为目前组织工程学中最具潜力的种子细胞[3],具有良好组织分化及免疫调节能力,可以调节软骨受损部位局部微环境,抑制软骨细胞凋亡、变性,进而促进组织修复[4-5]。胰岛素样生长因子-1(IGF-1)是软骨自稳态调节以及其发育中重要的生长因子之一,它能促进软骨细胞增殖分裂[6]。同时,IGF-1是BMSC的重要旁分泌生长因子[7],有研究表明,骨髓间充质干细胞中IGF-1的过度表达导致脊髓损伤中细胞存活、免疫调节和功能改善的增加[8]。研究显示,外源基因经慢病毒介导后易于导入间充质干细胞,并获得高效、长期表达[9]。因此,本研究采用IGF-1慢病毒载体转染BMSCs抑制体外白细胞介素-1β(IL-1β)诱导条件下软骨细胞的凋亡,提高软骨细胞增殖活性,探讨其中可能的机制。
1 材料与方法
1.1 细胞和试剂大鼠骨髓间充质干细胞(货号:CP-R131)、软骨细胞(货号:CP-R087)购于武汉普诺赛生命科技有限公司;10%胎牛血清完全培养基(Procell公司);0.25%胰蛋白酶溶液(武汉普诺赛生命科技有限公司);PE(美国Invitrogen公司);5 ng/mL IL-1β(美国RD公司);实时荧光定量PCR仪(美国Invitrogen公司);CCK-8试剂盒(美国MCE公司);Lenti-IGF-1-EGFP慢病毒(上海吉凯基因化学技术有限公司),IGF-1、B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)、细胞色素C(Cytc)抗体(Affinity公司);AnnexinV-APC/7-AAD细胞凋亡检测试剂盒(武汉伊莱瑞特生物科技有限公司);倒置显微镜(日本OLYMPUS公司)。
1.2 BMSCs培养鉴定和转染将原代大鼠BMSCs复苏后接种于25 cm2细胞培养皿中,加入3 mL含90% α-MEM+10%胎牛血清,置于5%CO2,37℃培养箱中培养。观察并记录细胞形态和生长情况,生长至85%融合时进行传代培养。使用流式抗体染色收集的BMSCs,并经流式细胞仪检测其表面抗原CD90、CD34的表达,以鉴定BMSCs。
取P3代BMSCs接种6孔板,细胞密度生长至60%,加入不同转染复数(Multiplicity of infection,MOI)的慢病毒,包括包装好的Lenti-IGF-1-EGFP慢病毒、空白Lenti-EGFP慢病毒,混匀培养并更换新鲜的10%胎牛血清的培养基,继续培养,72 h后在荧光显微镜下观察结果。当MOI=40时,细胞转染效率达到97%,设为最佳感染复数值。取最佳转染复数值的慢病毒转染BMSCs,接种于6孔板,孵育24 h后,分为UC-BMSCs组、UC-BMSCs-vector组和UC-BMSCs-IGF-1组,细胞计数后按照3×105个/mL接种于12孔培养板中,实时定量PCR检测细胞中IGF-1基因的表达。在95℃2 min,95℃5 s,62℃15 s,39个循环,使用Real-timePCR仪进行检测。引物序列详见表1。
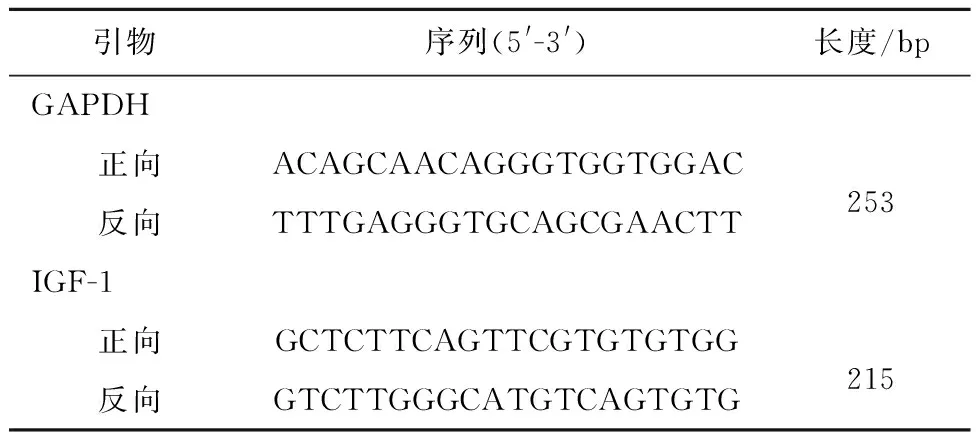
表1 荧光定量PCR检测引物序列
1.3 软骨细胞的培养使用含10%胎牛血清的完全培养基悬浮细胞,接种到25 cm2细胞培养皿中,轻轻吹打混匀,37℃、5%CO2饱和湿度条件下培养。
1.4 软骨细胞共培养分组处理取大鼠软骨细胞调整细胞浓度为1×104/孔,接种于transwell24孔板的外室中,分为正常对照组、IL-1β组、IL-1β+BMSCs组、IL-1β+BMSCs-vector组、IL-1β+IGF-1-BMSCs组。正常对照组常规培养,其余组使用5 ng/mL IL-1β干预软骨细胞,分别加入IGF-1慢病毒转染的BMSCs、空载慢病毒转染BMSCs、未转染的BMSCs,于体积分数10%胎牛血清的DMEM培养基,37℃、5%CO2培养箱培养24 h。
1.5 CCK-8检测细胞增殖在干预24 h后,去除外室原有培养基,每孔加入500 μL新鲜培养基与50 μLCCK-8,37℃培养2 h后,酶标仪测定每孔450 nm处的吸光度值(OD),计算细胞增殖水平。
1.6 Tunel法检测软骨细胞凋亡软骨细胞接种至载玻片,4%多聚甲醛室温固定。爬片上滴加20 μg/mL的Proteinase K溶液。去离子水溶液润洗爬片,去掉多余液体。爬片滴加Equilibration Buffer,室温孵育15 min。冰上解冻BrightRed Labeling Mix。将载玻片置于湿盒内,在37℃孵育1 h。将湿盒用铝箔纸包裹以避光。滴加DAPI避光孵育5 min,对标本进行染核。用含抗荧光淬灭剂封片,在荧光显微镜下观察采集图像,每组选取3个视野进行拍照。荧光显微镜下组织切片上凋亡的细胞呈红色荧光,细胞核呈蓝色荧光。
1.7 Western blot法检测软骨细胞凋亡相关蛋白蛋白裂解液裂解获得各组蛋白样品,蛋白定量后将蛋白转到PVDF膜上,5%脱脂奶粉封闭1 h。PVDF膜分别浸于Caspase-3、Cytc、Bax、Bcl-2抗体稀释液,4℃,孵育12~14 h。TBST清洗PVDF膜4次,加入二抗,PVDF膜浸于HRP标记二抗稀释液,室温,孵育1.5 h。ECL工作液孵育PVDF膜,室温,5 min。X光片显影,Bandscan软件分析条带灰度值。
1.8 ELISA法检测细胞提取液中炎症因子收集软骨细胞,PBS重悬并反复冻融后,将提取液于1 500 r/min离心10 min,取上清使用ELISA试剂盒检测其中IL-1β、白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)表达水平。

2 结果
2.1 大鼠BMSCs的培养与表型鉴定大鼠BMSCs接种48 h换液可见少数细胞贴壁,成团块状散在分布。P3代成熟BMSCs均匀规律分布,细胞成群,间隙变小,体积较大成梭状,可见细胞核,基本铺满瓶底,见图1。流式细胞仪检测结果显示,大鼠骨髓间充质干细胞高表达CD90(阳性率为97.5%)、CD34(阳性率为0.04%),符合BMSCs表型要求,见图2。
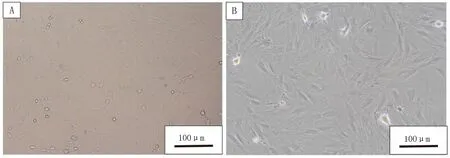
注: A, P0代BMSCs; B, P3代BMSCs。
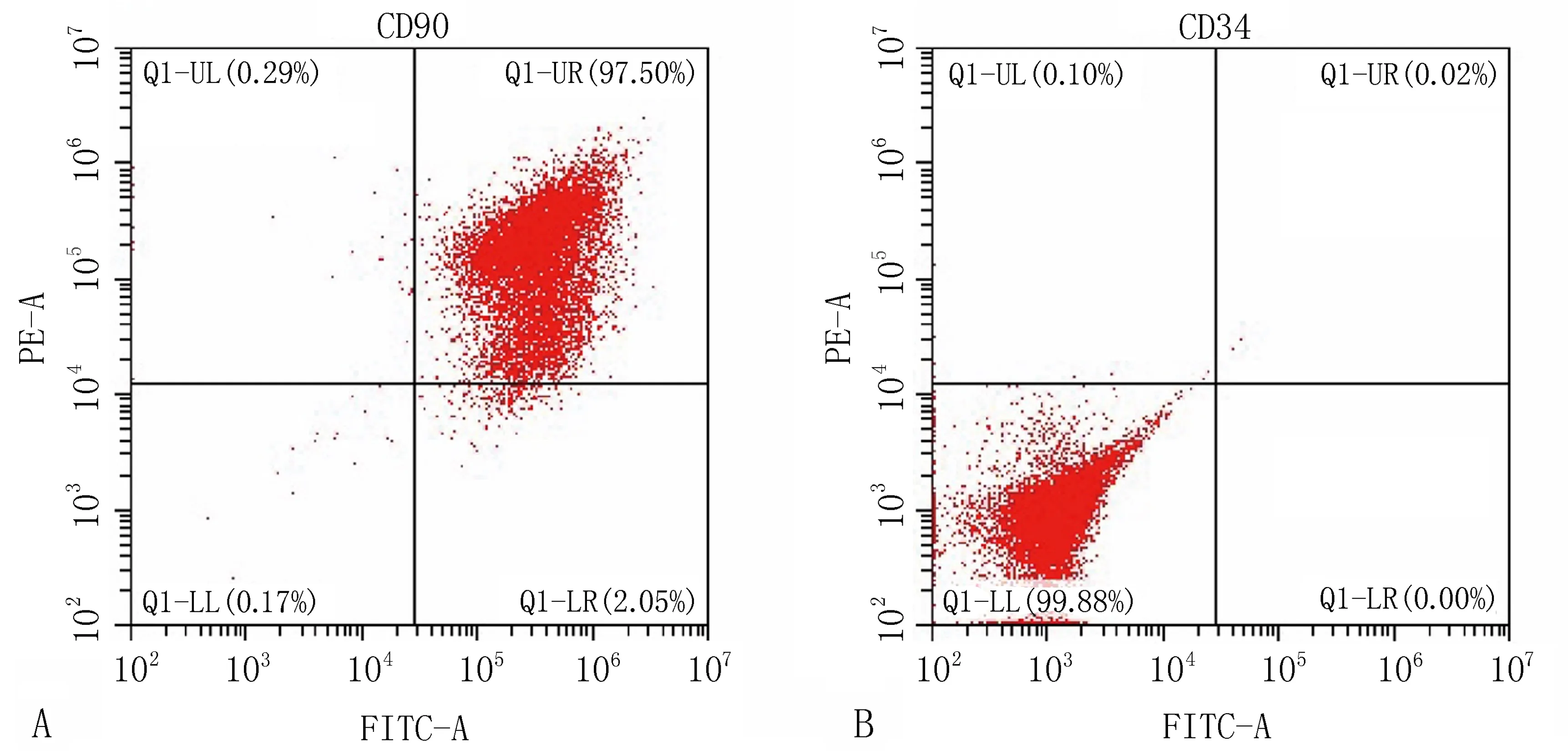
注: A, BMSCs表面抗原CD90表达; B, BMSCs表面抗原CD34表达。
2.2 大鼠BMSCs中IGF-1的蛋白和mRNA表达水平通过Western blot和qRT-PCR分别检测各组大鼠BMSCs的IGF-1基因和蛋白表达水平,结果显示:UC-BMSCs-IGF-1组、UC-BMSCs组和UC-BMSCs-vector组IGF-1基因表达差异有统计学意义(P<0.05);UC-BMSCs组与UC-BMSCs-vector组的IGF-1基因表达水平差异无统计学意义,见图3。
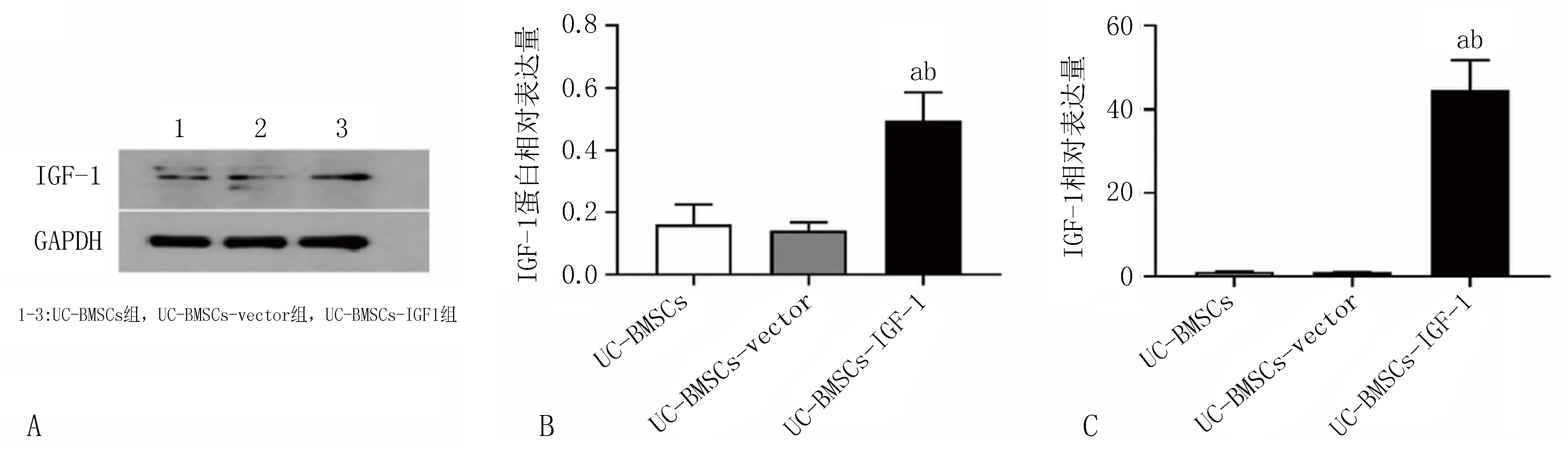
注: A-B, 各组BMSCs中IGF-1蛋白表达情况; C, 各组BMSCs中IGF-1的mRNA表达情况。 与UC-BMSCs组相比, aP<0.05; 与UC-BMSCs-vector组相比, bP<0.05。
2.3 BMSCs对IL-1β诱导的软骨细胞增殖与凋亡的影响与正常对照组相比,IL-1β组增殖活性显著降低。与IL-1β组相比,IL-1β+BMSCs组、IL-1β+BMSCs-vector组、IL-1β+IGF-1-BMSCs组细胞增殖活性显著增加(P<0.05),其中IL-1β+IGF-1-BMSCs组软骨细胞的增殖速度最快,见图4。
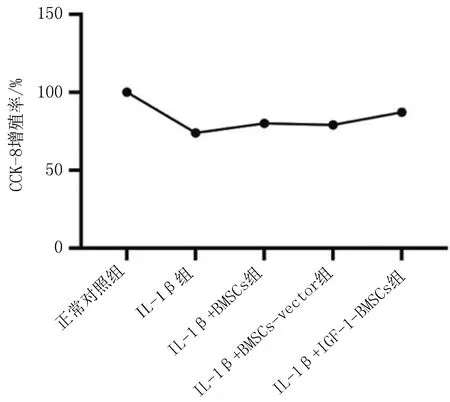
图4 CCK-8检测各组软骨细胞增殖率
根据Tunel检测结果可知:与正常对照组相比,IL-1β组凋亡率显著升高(P<0.05);相比IL-1β组,IL-1β+BMSCs组、IL-1β+BMSCs-vector组、IL-1β+IGF-1-BMSCs组软骨细胞凋亡率显著下降(P<0.05),见图5。
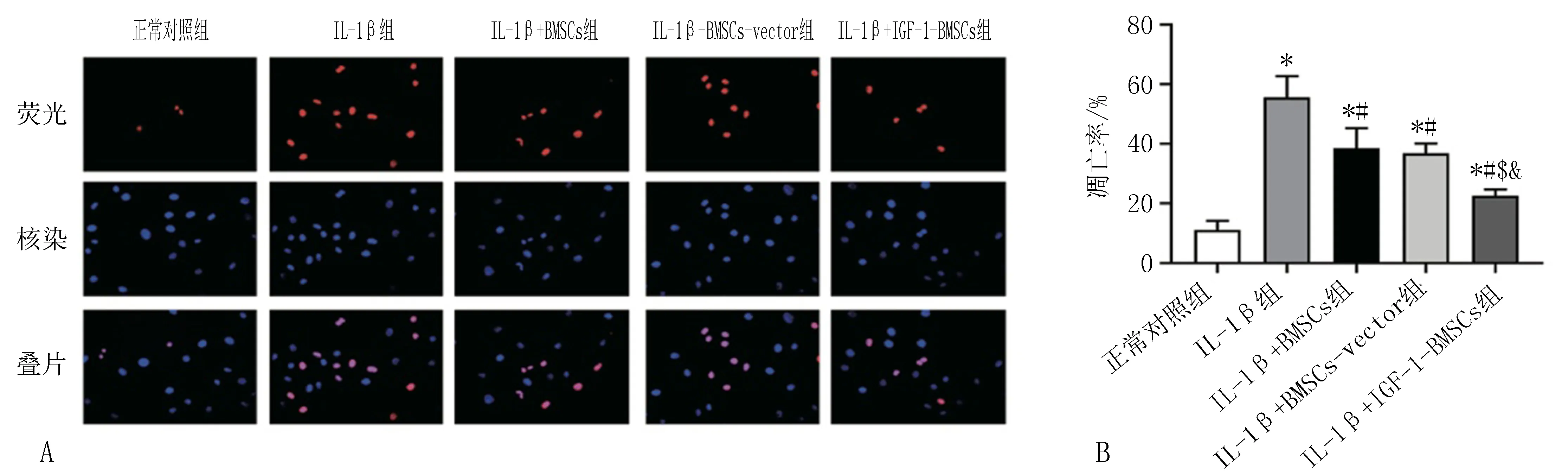
注: A, 各组Tunel法检测的荧光显微镜图像; B, 各组Tunel法检测的凋亡率。与正常对照组相比, *P<0.05; 与IL-1β组相比, #P<0.05; 与IL-1β+BMSCs组相比, $P<0.05; 与IL-1β+BMSCs-vector组相比, &P<0.05。
2.4 各组软骨细胞凋亡相关蛋白的表达与正常对照组相比,IL-1β组抗凋亡蛋白Bcl-2表达降低,凋亡蛋白Bax和Caspase-3的表达升高(P<0.05)。与IL-1β组相比,IL-1β+BMSCs组、IL-1β+BMSCs-vector组和IL-1β+IGF-1-BMSCs组Bax、Caspase-3、Cytc蛋白表达降低,Bcl-2蛋白表达升高(P<0.05),其中IL-1β+IGF-1-BMSCs组对软骨细胞存活具有更强的保护作用(P<0.05),见图6。
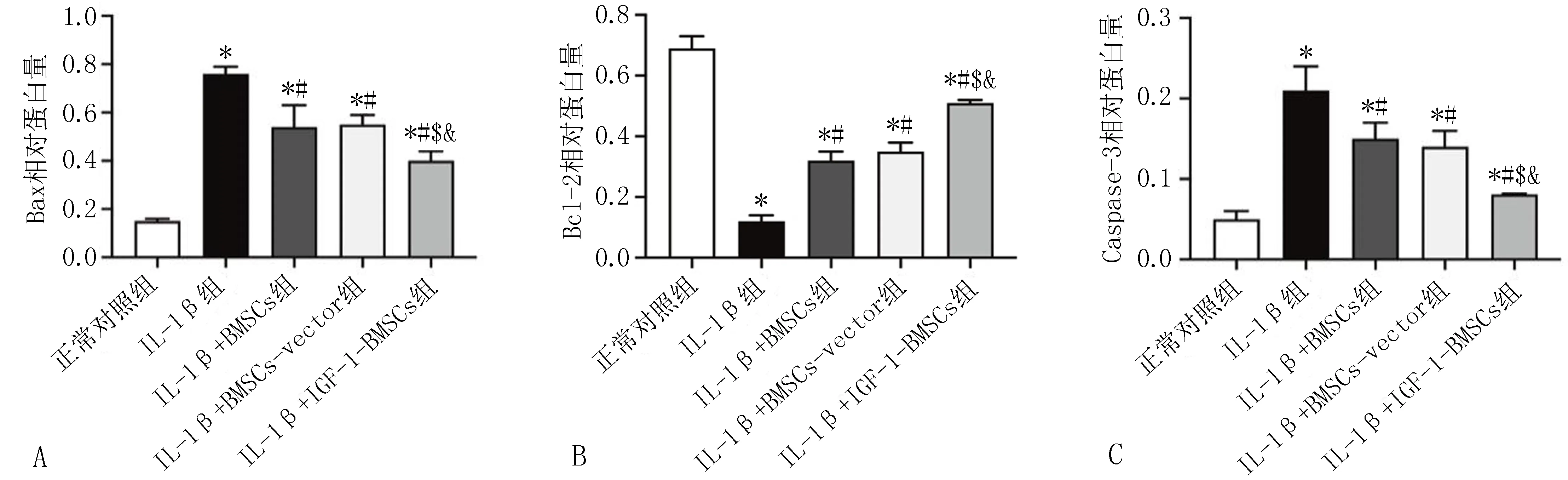
注: A, 各组Bax蛋白的表达; B, 各组Bcl-2蛋白的表达; C, 各组Caspase-3蛋白的表达; D, 各组Cytc蛋白的表达; E, 各组软骨细胞凋亡相关蛋白的表达(1-5分别为正常对照组、IL-1β组、IL-1β+BMSCs组、IL-1β+BMSCs-vector组、IL-1β+IGF-1-BMSCs组。 与正常对照组相比, *P<0.05; 与IL-1β组相比, #P<0.05; 与IL-1β+BMSCs组相比, $P<0.05; 与IL-1β+BMSCs-vector组相比, &P<0.05)。
2.5 各组细胞炎症因子的浓度变化比较与正常对照组相比,IL-1β组提取液中TNF-α、IL-6、IL-1β浓度均显著升高(P<0.05)。与IL-1β组相比,IL-1β+BMSCs组、IL-1β+BMSCs-vector组、IL-1β+IGF-1-BMSCs组中的TNF-α、IL-6、IL-1β浓度均显著降低(P<0.05)。与IL-1β+BMSCs组相比,IL-1β+IGF-1-BMSCs组TNF-α、IL-6、IL-1β浓度降低明显(P<0.05)。与IL-1β+BMSCs-vector组相比,IL-1β+IGF-1-BMSCs组TNF-α、IL-6、IL-1β浓度显著降低(P<0.05),见表2。
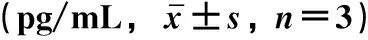
表2 各组细胞间炎症因子浓度变化比较
3 讨论
软骨损伤是多种骨关节炎的关键特征[10],软骨细胞是软骨中唯一存在的细胞类型,软骨细胞的凋亡增强以及细胞合成代谢减少均会破坏软骨基质的完整性,导致骨关节病变[11],临床实践中缺乏有效的治疗方法逆转软骨损伤和阻止OA的进展。近年来,BMSCs成为软骨修复领域研究热点[12],大量体内外研究证实BMSCs可以定向归巢至组织损伤位置、分化成不同的细胞种类并分泌多种细胞修复因子,参与免疫反应,抑制机体炎症反应[13-14]。已有研究发现BMSCs改善膝骨关节炎患者的软骨损伤,减少滑膜炎症,且不良反应发生率低[15],其机体免疫调节和再生能力能够改善OA中关节软骨合成代谢和分解代谢的平衡。重组基因是在再生医学中实现BMSCs潜力的有效策略[16]。IGF-1是一种促生长的内分泌激素[17],对软骨具有合成代谢和软骨保护特性,无论内源或外源性IGF-1,都可以在细胞周期进程中发挥着重要作用,进而促进软骨细胞的细胞活性和细胞增殖分化[18-19],而低水平的内源性分泌IGF-1不足以有效再生[20]。本研究通过慢病毒转染技术成功地构建IGF-1过表达的BMSCs。慢病毒转染法作为一种基于干细胞的治疗策略而兴起,有望成为治疗OA的有效途径。
骨关节炎中,ECM降解产物会激活关节软骨细胞表面的机械感受器、细胞因子受体和促炎细胞因子,如TNF-α、IL-1β、IL-6[21]。其中IL-1β是造成软骨破坏的重要炎症因子之一,可用于体外诱导骨关节炎细胞模型,软骨细胞经IL-1β干预后,其增殖活性显著降低,细胞提取液中炎症因子IL-6和TNF-α水平显著升高[22-23]。IGF-1对外界刺激诱导的细胞损伤具有保护作用,Lin等[24]的研究显示,IGF-1在缺氧条件下,降低心肌细胞凋亡,提高细胞存活率,有效治疗急性心肌梗死大鼠。Al-Zikri等[25]的研究报道称,IGF通过下调miR-22-3p增强BMSCs衍生的神经祖细胞(NPCs)的细胞增殖和存活,治疗脊髓损伤。本研究通过5 ng/mL IL-1β干预正常软骨细胞构建骨关节炎细胞模型,进一步采用IGF-1过表达的BMSCs与IL-1β诱导的软骨细胞共培养,发现IGF-1过表达的BMSCs可提高IL-1β诱导的软骨细胞增殖活性,降低细胞提取液中IL-1β、IL-6和TNF-α水平及细胞凋亡水平,下调软骨细胞中凋亡蛋白Bax、Caspase-3、Cytc的表达,上调抗凋亡蛋白Bcl-2的表达,说明IGF-1过表达的BMSCs对IL-1β诱导的软骨细胞损伤具有保护作用,可能也具有治疗骨关节炎的潜能。
本研究中,应用慢病毒转染法获得IGF-1过表达的BMSCs。IGF-1-BMSCs抑制IL-1β诱导的软骨细胞凋亡,同时降低炎性因子水平,抑制炎症反应,有效的延缓了骨关节炎的进展。
