苦荞种质资源芦丁含量与SSR标记关联分析
2023-09-28吴怡超李晓瑜何星星岳林清崔静斌丁梦琦张建易泽林方小梅
吴怡超, 李晓瑜, 何星星, 岳林清, 崔静斌,丁梦琦, 张建, 易泽林, 方小梅
西南大学 农学与生物科技学院,重庆 400715
苦荞(FagopyrumtataricumL. Gaertn), 属于蓼科(Polygonaceae)荞麦属(Fagopyrum), 是我国传统的药食两用杂粮作物[1], 其籽粒中营养物质极为丰富, 除蛋白质、 淀粉、 脂肪和多种维生素外, 还富含其他粮食作物没有的黄酮类化合物芦丁. 芦丁对人体有巨大的益处, 包括预防肝损伤、 氧化应激、 血管疾病和某些形式的癌症[2]. 因此, 苦荞被人们誉为“五谷之王”, 是一种集营养、 保健、 治疗于一体的健康食品[3-4]. 苦荞芦丁含量属多基因控制的数量性状, 遗传基础比较复杂, 表现型和基因型的对应关系也不明确, 对其遗传基础的研究比较困难[5]. 因此, 了解和研究苦荞芦丁含量的遗传规律, 开发和鉴定与苦荞芦丁显著关联的分子标记对选育高芦丁含量的苦荞种质具有重要的现实意义.
黄酮类物质对人体极为有益[6], 而芦丁是苦荞所含的主要黄酮类物质. 吕丹[7]利用59对SSR引物对230份苦荞种质资源的15个性状进行了关联分析, 发现引物TatG-110显著关联籽粒黄酮含量、 籽粒产量、 籽粒周长和百粒质量; 引物TatG-172显著关联籽粒黄酮含量、 初花期、 主茎分枝数. DING等[8]研究发现FtERF-EAR3可以通过结合FtF3H启动子中的GCC-box来抑制FtF3H的表达和类黄酮的生物合成, 而茉莉酸盐(jasmonates, JAs)可以诱导FtERF-EAR3基因表达, 这个结果揭示了JAs响应转录抑制因子参与类黄酮生物合成的精确调控机制, 将有助于进一步提高苦荞类黄酮生物合成效率. 此外, TAK等[9]建立了50个苦荞基因型的芦丁谱, 比对了芦丁含量高和含量低的两种基因型的PAL基因序列, 检测到19个氨基酸变异, 推测蛋白质结构在两种不同基因型中显示出构象变化, 并可能对芦丁的生物合成有影响. LI等[10]对芦丁浓度和生物量成长曲线进行研究, 发现FtMYB16与Ftimportin-α1相互作用, 直接介导芦丁的生物合成, 当FtMYB16过表达时会抑制芦丁积累和根系生长. XU等[11]利用转录组-代谢组相关网络中的GGT基因进行探索, 鉴定了苦荞中连接鼠李糖糖苷元的FtUGT79A15蛋白, 证实了FtUGT79A15在体外和植物体内均具有催化槲皮素3-O-葡萄糖苷生成芦丁的鼠李糖转移酶活性, 并确定FtUGT79A15参与苦荞类黄酮二糖苷的生物合成途径. 彭艳[12]以川荞2号种子为供试材料建立了突变体库, 进行F3′H基因的TILLING分析, 结果表明:F3′H基因的突变可以促进槲皮素的合成, 为芦丁的合成提供底物, 且类黄酮葡糖苷转移酶可能影响芦丁合成.
关联分析是鉴定群体内目标性状与遗传标记关系的方法, 是遗传解析复杂数量性状的有效工具, SSR标记属于关联分析常用的分子技术之一. SONG等[13]利用110对SSR引物对97个苦荞资源进行基因分型, 对芦丁含量、 株高、 主茎节数等性状进行关联分析, 发现SXAU2034引物在至少两种环境中与芦丁含量显著关联的同时, 与根长也显著关联[13]. 石桃雄等[14]使用62对SSR引物对193份材料进行关联分析, 检测到与黄酮含量显著关联的SSR标记分别为S2310,S2304,TatG0124,S2312,S6853, 其中标记TatG0124和S6853的表型贡献率较高. 综上所述, 尽管国内外研究者对芦丁等黄酮类物质在苦荞内的生物合成相关基因或显著关联的分子标记已有一定研究, 但苦荞中芦丁含量的合成机制仍不清楚, 当前亟需深入挖掘苦荞芦丁含量关联的标记, 加深对苦荞芦丁分子调控机制的理解.
本研究收集263个苦荞种质资源, 对其芦丁含量进行测定和分析, 结合实验室前期318份苦荞种质资源的77对SSR基因型数据[17], 对苦荞芦丁进行了群体结构分析, 亲缘关系分析, SSR关联分析, 以筛选与芦丁紧密关联的标记, 为高芦丁苦荞分子育种奠定基础.
1 试验材料与方法
1.1 供试材料
供试材料共263份, 其中中国重庆57份, 四川57份(西昌12份), 北京17份, 贵州29份, 山西 7份, 陕西 28份, 西藏28份, 云南24份, 江西14份; 国外材料来自韩国与日本, 各1份.
1.2 田间种植
供试材料于2022年春季种植于西南大学合川农场试验基地(106° 7′ 51″ E, 30° 0′ 4″ N). 田区完全随机设计, 每个资源种植3行, 行长2.0 m, 行距0.5 m, 种植密度每公顷90万株. 苦荞生长发育期间不施肥, 其他田间管理同一般大田管理. 待75%籽粒成熟后, 各种质资源随机选取无病害、 长势相对一致的 3 株植株, 分别进行人工脱粒, 烘干, 备用.
1.3 苦荞籽粒芦丁含量的测定
(1) 籽粒总黄酮提取: 每份苦荞种质材料选取20 g左右的饱满籽粒, 自然风干, 然后置于烘箱内, 以60 ℃烘干至恒重, 用高速粉碎机充分研磨, 称取0.020 g粉末, 置于2 mL的离心管中. 加入2 mL 75%的甲醇, 60 ℃恒温水浴2 h后, 在离心机内以8 000 r/min室温离心10 min, 过滤. 取10 μL溶液, 加0.1 mmol/L氯化铝80 μL, 再加1.0 mol/L醋酸钾120 μL, 用甲醇定容至250 μL, 作待测样品. 用酶标仪在波长420 nm处测吸光度.
(2) 芦丁标准曲线绘制: 分别吸取浓度为80 μg/mL的芦丁标准对照品溶液0 mL, 0.8 mL, 1.6 mL, 2.4 mL, 3.2 mL, 4.0 mL于25 mL容量瓶中, 加0.1 mol/L氯化铝8 mL, 再加1 mol/L醋酸钾12 mL, 用75%甲醇溶液定容至25 mL, 摇匀. 以第一管为空白对照, 用酶标仪在波长420 nm处测定吸光度. 以浓度值C为横坐标, 吸光值A为纵坐标, 绘制芦丁标准曲线, 建立一元线性回归方程, 确定相关系数.
(3) 籽粒芦丁含量测定: 通过标准曲线, 获得每个苦荞种质籽粒黄酮提取物中的芦丁浓度, 然后按照公式(1)进行芦丁的百分含量计算.
X%=(C×N×V/M×106)×100%
(1)
式中:X为芦丁含量;C为样品吸光度;V为体积(mL);N为稀释倍数;M为称样量(g).
1.4 SSR标记分型
本试验所用 SSR 引物分为3批, 共77对. 第一批44对 SSR 引物由FANG等[15]根据苦荞全基因组序列开发; 第二批12对 SSR 引物以“ S ”开头命名, 由李月[16]根据苦荞种子转录组Unigene序列开发; 第三批21对 SSR 引物是石桃雄等[14]根据合成类黄酮化合物的关键基因、 落粒相关的关键基因及合成种子关键蛋白基因等序列所设计的. 基因分型数据来源于本课题前期318份(含本试验使用的263份)苦荞种质资源基因分型[17], 用“0-1”读带法标记条带, 在相同水平线上的条带, 有条带记为“1”, 无条带记为“0”, 形成二元矩阵.
1.5 数据分析
考种数据用Excel表格汇总后, 进行苦荞种质资源芦丁含量的遗传多样性分析, 计算各个苦荞资源品种的芦丁含量的平均值、 标准差、 变异系数等; 使用Powermarker处理得到二元矩阵, 并用MEGA 7.0软件构建Neighbor-Joining tree聚类图, 用Fig Tree v 1.4.4软件对聚类图作进一步的美化. 用Structure2.3.4软件对263份苦荞种质材料进行群体结构分析, 并得到最佳K值. 把K值设定为2~10, 并对每个K值假设重复进行15次运算, 将不作数迭代(Length of burn in period)和MCMC (Markov Chain Monte Carlo)均设为100 000次. 将结果所在的文件压缩为zip.格式, 上传至网络在线软件Structure Harvester处理, 得到最佳K值与Q值(每份种质被分配到对应亚群中的概率), 完成群体结构分析; 利用TASSEL_5软件对263份苦荞种质资源进行亲缘关系分析, 得到亲缘关系矩阵, 并用R语言绘制亲缘关系热图; 用TASSEL_5软件对263份苦荞种质资源的芦丁含量和SSR标记进行关联分析, 分别使用一般线性模型(general linear model, GLM)和混合线性模型(MLM), 设置阈值p<(-log10(p)=3)统计显著性位点, 使用R语言绘制Manhattan图和QQ plot图. 关联分析结果得到p值、 表型变异贡献率(R2)和关联位点等数据. 若p<0.05, 则说明该标记与该性状存在显著关联; 若p<0.01, 则说明该标记与该性状存在极显著关联.
2 结果分析
2.1 苦荞种质资源芦丁含量的变异分析
对263个苦荞种质资源的芦丁含量进行遗传多样性分析. 其中各品种的芦丁含量变异范围较大, 变异系数为21.63%, 芦丁含量范围为0.46%~1.43%. 芦丁含量较低的品种有藏苦12变异1(0.46%), 额拉6(0.51%). 芦丁含量较高的品种有晋苦荞6号2(1.40%), 黔苦荞1号(1.40%), 藏苦12变异3(1.43%). 263个苦荞资源品种的平均芦丁含量为1.04%. 来自四川西昌的12个苦荞品种的芦丁含量整体表现优异, 芦丁均值含量为1.17%, 优于263个品种的均值. 偏度系数小于0, 说明数据分布形态与正态分布相比为负偏, 长尾巴在左, 表明左侧边数据有较多的极端值; 峰度系数小于0, 表明该性状数据分布与正态分布相比较为平坦, 为平顶峰(表1). 频率分布图表明263份苦荞资源芦丁含量呈偏态分布(图1).

表1 苦荞种质资源芦丁含量的变异情况
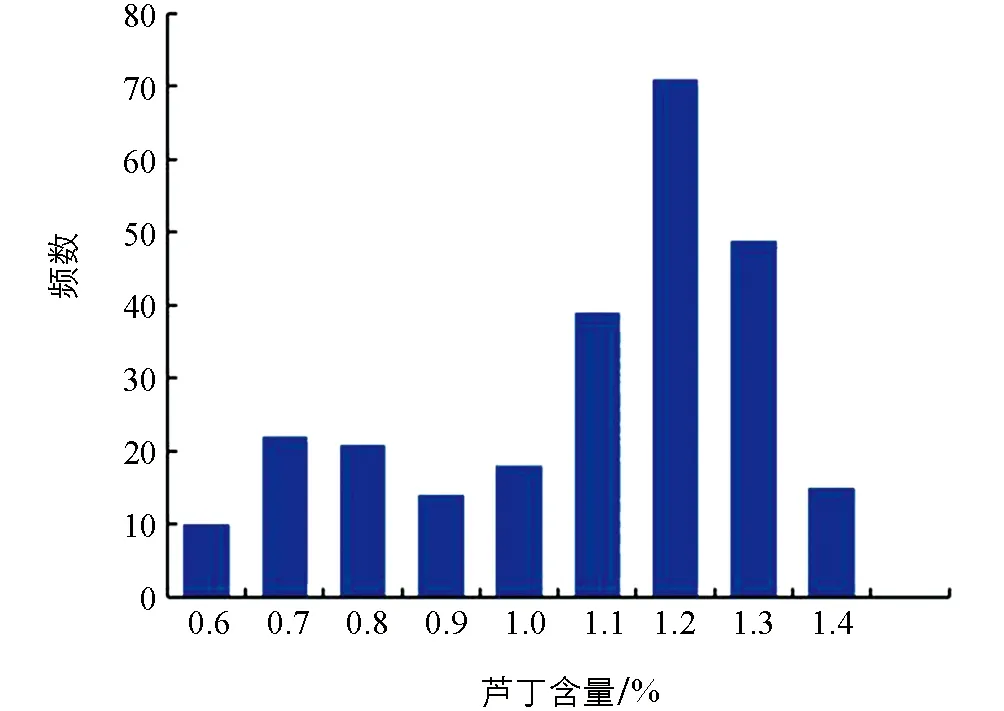
图1 263份苦荞资源芦丁含量频率分布图
2.2 基于SSR标记的聚类分析
利用77对SSR标记对263份供试苦荞资源材料进行聚类分析, 结果如图2所示. 由图2可知, 苦荞种质资源可分为3个类群. 第Ⅰ类群包括27份材料(北京2份, 贵州5份, 江西1份, 陕西2份, 四川4份, 西藏1份, 云南2份, 重庆10份), 第II类群包括 106份(北京4份, 贵州14份, 江西6份, 山西6份, 陕西10份, 四川28份, 西藏8份, 云南9份, 重庆20份, 韩国1份), 第III类群包括 130份(北京11份, 贵州10份, 江西7份, 山西1份, 陕西16份, 四川25份, 西藏19份, 云南13份, 重庆27份, 日本1份), 其中49.4%的材料被聚集到第Ⅲ类群中.
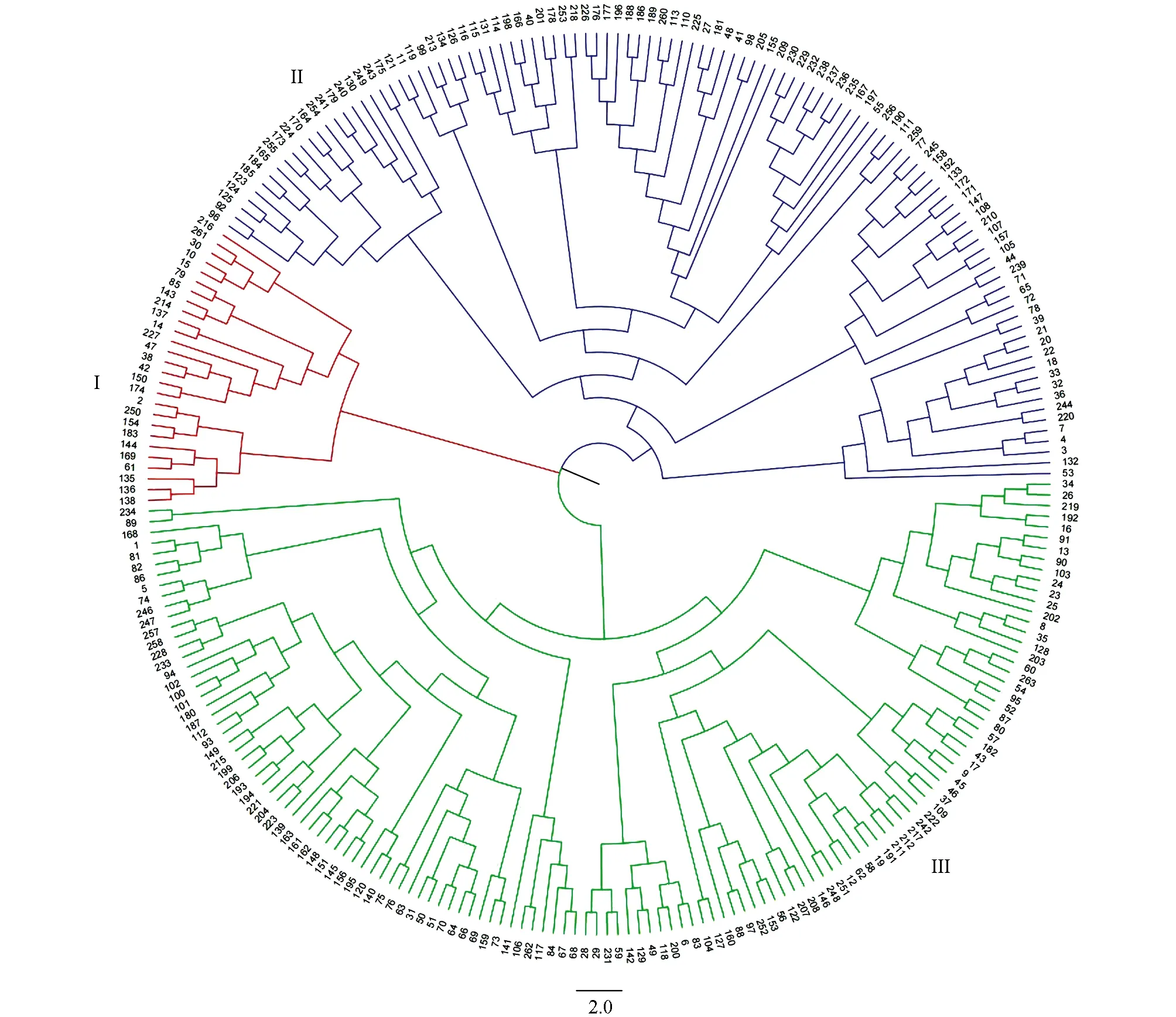
图2 基于SSR标记263份苦荞种质资源的聚类结果
2.3 苦荞种质的群体结构分析和亲缘关系分析
基于实验室前期对263份苦荞种质资源进行的PCR扩增及电泳检测, 获得了77对多态性引物基因分型数据, 本研究利用Structure 2.3.4软件来对263份苦荞种质资源材料进行群体结构分析, 设定K值为2~10, 重复次数15次, 结果如图3所示. 由图3可知, 当K=3时, ΔK有明显的峰值. 供试材料可分为3组, 分别命名为P1、 P2、 P3. 其中P1种群有包含110个个体, 占总材料的41.8%; P2种群包含83个个体, 占总材料的31.6%; P3种群包含70个个体, 占总材料的26.6%. 由群体结果图看(图4), 3个种群的基因并不纯粹, 可能是由长期积累的、 偶然性的基因交流导致携带了其他种群的基因.
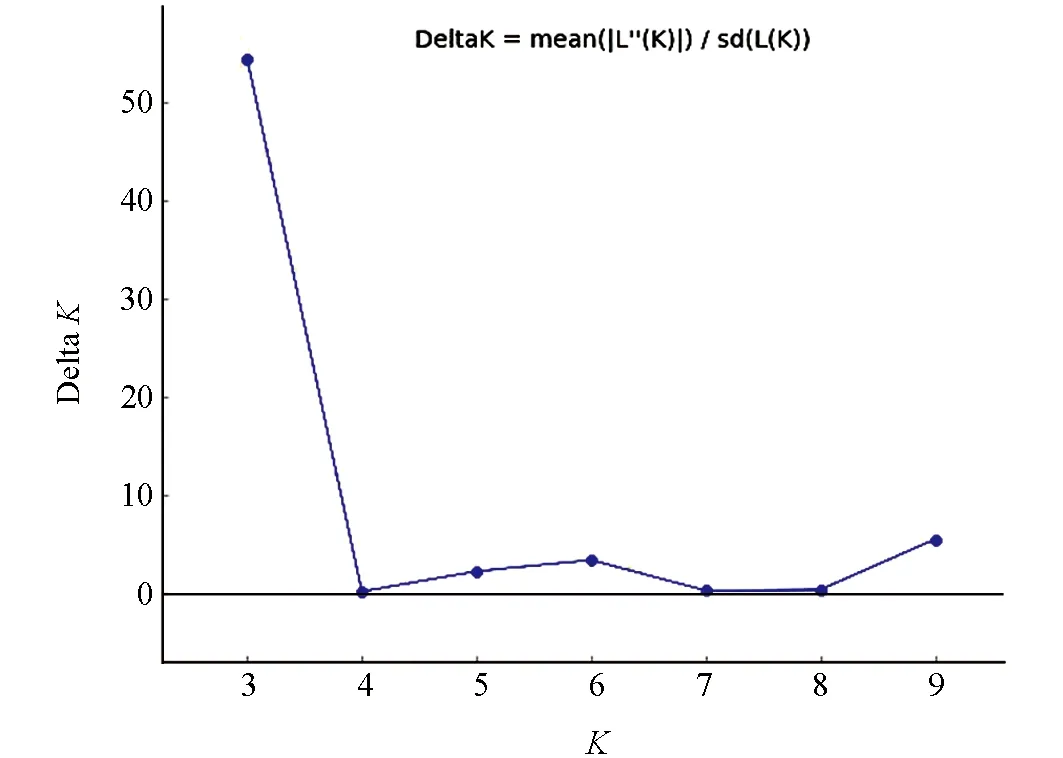
图3 263份苦荞资源群体结构分析的 Delta K值分布
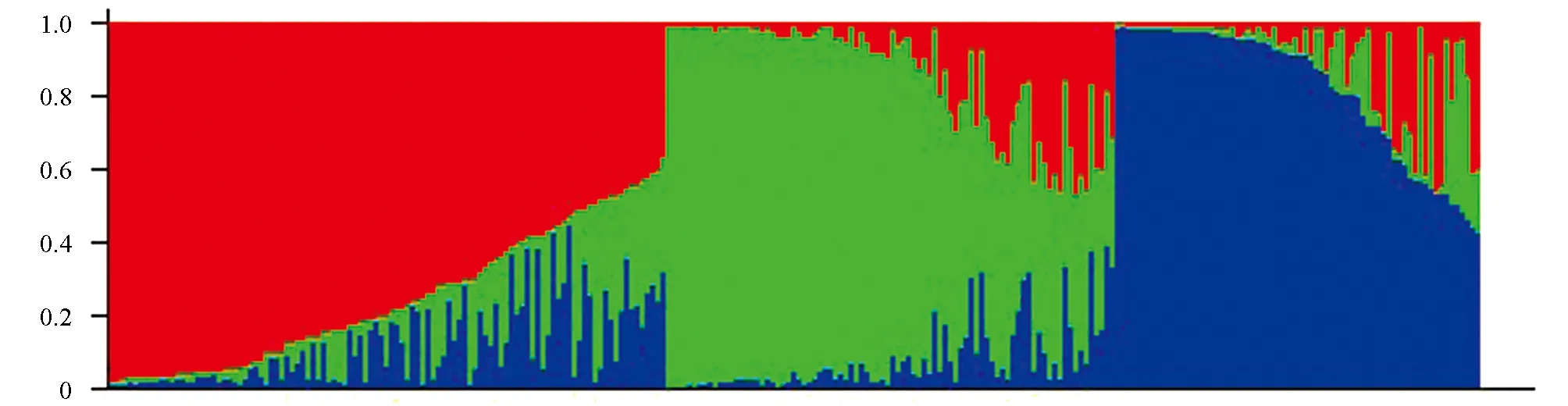
图4 263份苦荞种质资源群体结构图
对263份苦荞资源材料进行亲缘关系分析, 结果如图5所示. 从该图可以发现, 该群体亲缘关系系数大多处于0附近, 说明各材料亲缘关系较远, 对后期基因组关联分析的结果影响较小.
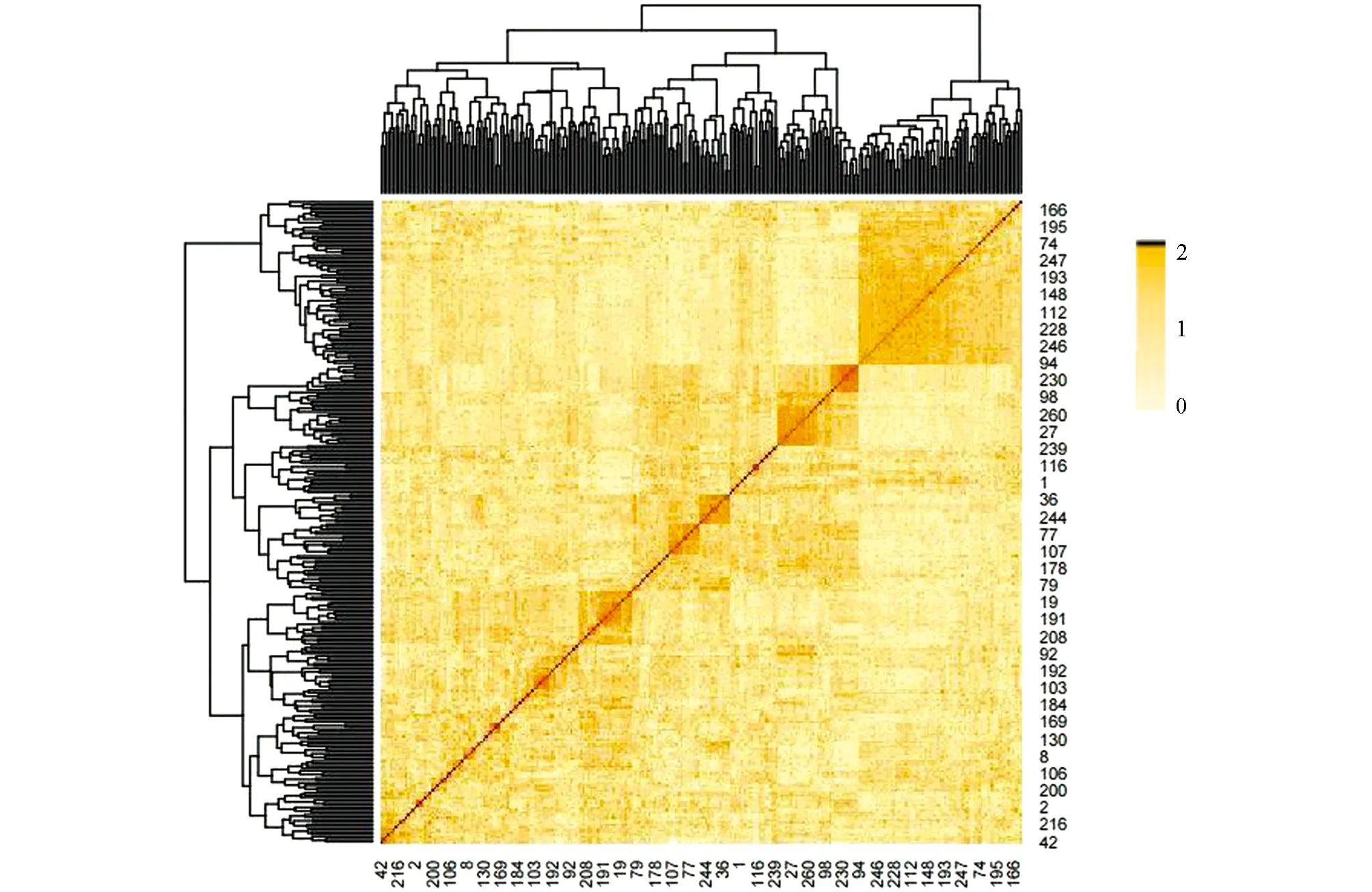
图5 263份苦荞种质资源亲缘关系图
2.4 苦荞种质资源的芦丁含量和SSR标记关联分析
为了确定模型是适合分析苦荞芦丁含量相关位点, 本研究利用苦荞芦丁含量与SSR基因分型关联分析, 分别计算了GLM和MLM两种情况下的p值, 进行QQ plot图可视化, 结果如图6所示. 两个模型假阳性率都较低, 因此GLM和MLM模型都适合进行芦丁含量的SSR关联分析.
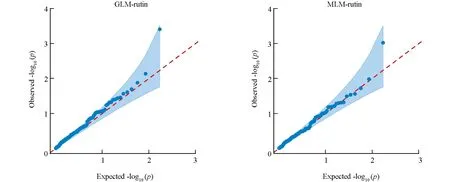
图6 芦丁含量QQ plot图
将苦荞芦丁含量与SSR标记进行关联分析, 用所得到的数据, 以p值的负对数为纵坐标, 以标记基因的所在位置为横坐标, 绘制Manhattan图, 结果如图7所示. 由图7可知, 苦荞芦丁含量与部分标记出现了一定强度的关联.
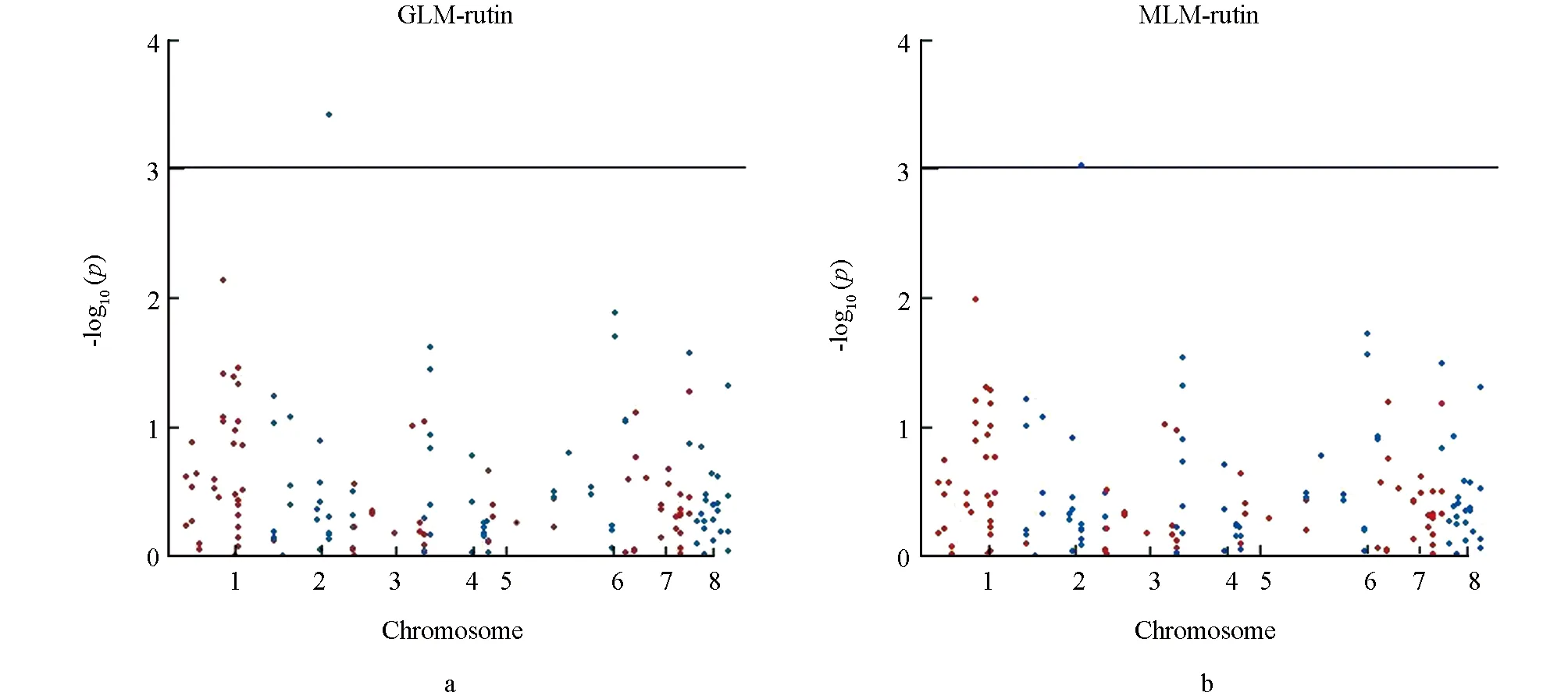
图7 芦丁含量Manhattan图
在GLM模型下, 由苦荞芦丁含量的Manhattan图(图7a)可以明显看出, 在2号染色体2.95 Mb位置上有一个SSR与芦丁含量极显著关联.
在MLM模型下, 由苦荞芦丁含量的Manhattan图(图7b)可以明显看出, 在2号染色体20 Mb至40 Mb之间有一个SSR与芦丁含量极显著关联.
对263份苦荞种质资源的遗传关系以及群体结构进行分析, 得到苦荞种质资源对应的Q值. 使用77对已发表的SSR标记, 利用 TASSEL_5软件包中的GLM模型和MLM对苦荞种质资源芦丁含量与分子标记进行关联分析. 苦荞芦丁含量与SSR标记关联结果如表2所示.
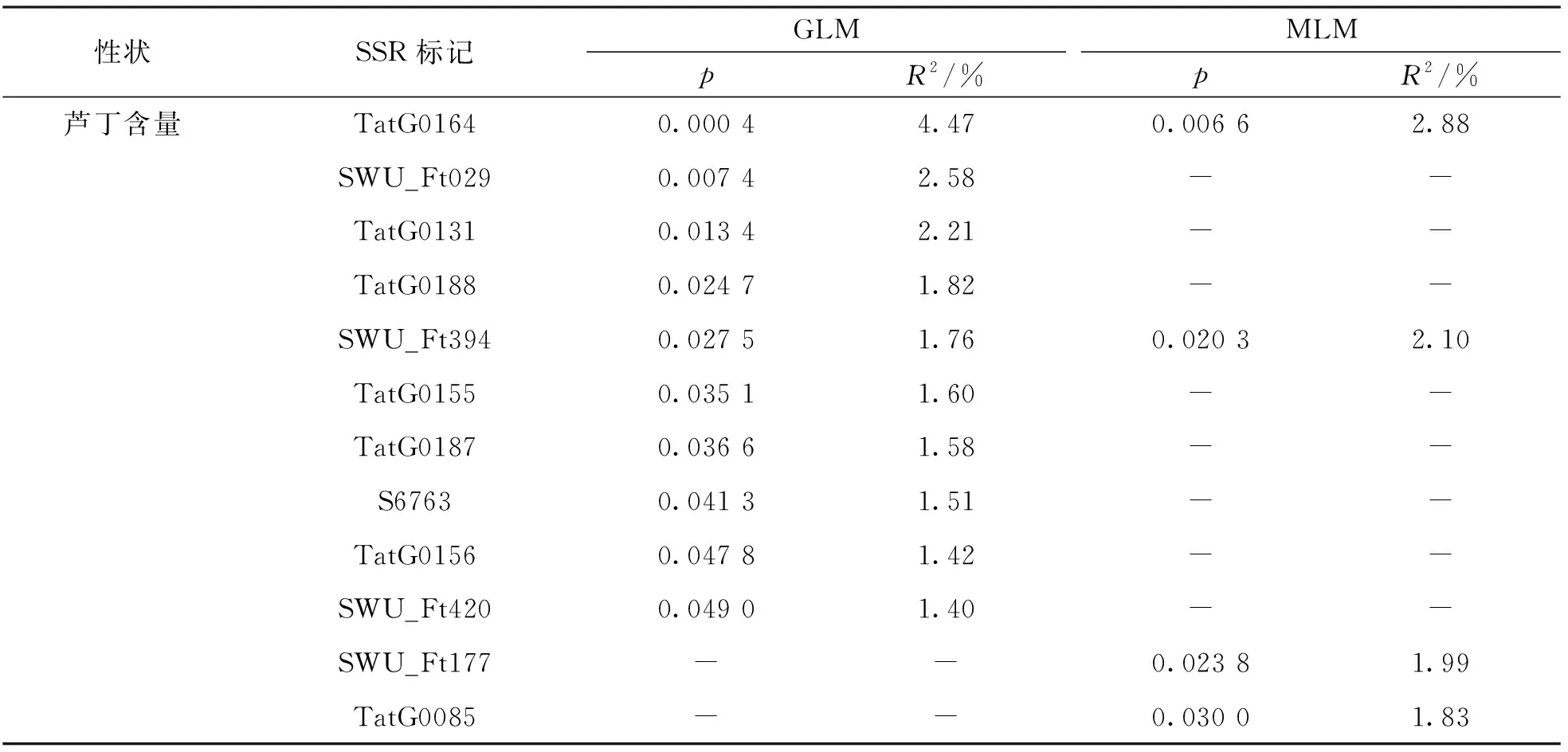
表2 GLM和 MLM模型的关联分析结果
(1) 在GLM模型下得到的结果中, 共检测到10个标记与芦丁含量有显著关联(p<0.05)或极显著相关(p<0.01). 其中有8个标记与芦丁含量存在显著相关(p<0.05), 有2个标记(TatG0164和SWU_Ft029)与芦丁含量存在极显著相关(p<0.01). 呈显著关联的各标记对芦丁含量指标的贡献率范围为1.40%~2.21%, 平均贡献率为1.66%. 呈极显著关联的各标记对芦丁含量指标的贡献率为2.58%~4.47%, 平均贡献率为3.53%.
(2) 在MLM模型下得到的结果中仅有4个标记与芦丁含量有显著关联(p<0.05)或极显著相关(p<0.01). 其中有3个标记与芦丁含量存在显著相关(p<0.05), 有1个标记与芦丁含量存在极显著相关(p<0.01). 呈显著关联的各标记对芦丁含量指标的贡献率为1.83%~2.10%, 平均贡献率为1.97%. 呈极显著关联的标记对芦丁含量指标的贡献率为2.88%.
其中TatG0164在两个模型中与芦丁含量均呈极显著关联, SWU_Ft394在两个模型中与芦丁含量呈显著性关联.
3 讨论
3.1 苦荞种质资源芦丁含量的变异及资源筛选
苦荞是重要的杂粮作物, 其籽粒中含有丰富的芦丁. 芦丁功能多样, 能够降低血糖、 血压和血脂; 能够抑制肿瘤细胞, 对癌症有一定预防作用; 有抗氧化作用从而可以延缓衰老[18-20]. 本研究中263份苦荞种质资源的芦丁含量变异范围为0.46%~1.43%, 高于汪燕等[21]报道的来自于不同地区的20份苦荞种质芦丁含量的变异范围(0.95%~1.52%); 变异系数为21.63%, 高于吕丹[7]报道的230份苦荞种质资源在3个不同环境中籽粒黄酮含量的变异系数(12.06%,13.27%和14.33%), 说明本研究中苦荞种质籽粒黄酮含量变异范围仍然是比较丰富的, 不同苦荞种质籽粒中黄酮含量存在较大的基因型差异, 可以通过良种选配和改善栽培措施等方法, 使籽粒黄酮含量获得一定程度的改善和提高, 这为选育籽粒黄酮含量极端苦荞种质提供了理论基础.
本试验对263份苦荞种质资源材料的芦丁含量进行了统计分析, 结果表明: 263个苦荞资源品种的平均芦丁含量为1.04%, 芦丁含量最高的是藏苦12变异3(1.43%), 晋苦荞6号2(1.40%)和黔苦荞1号1(1.40%)次之, 可作为培育高产黄酮品种的种质资源. 晋苦荞2号(1.23%)、 晋苦荞6号(1.39%)芦丁含量较高, 并且前人研究得出此二品种产量也较高[22-23], 说明这两个品种优质高产, 是培育苦荞新品种的优秀种质资源.
3.2 苦荞种质资源芦丁含量与SSR标记的关联分析
传统育种方法主要依赖育种家对植株表型的选择, 育种周期长, 效率低. 苦荞芦丁含量为数量性状, 受微效多基因控制, 极易受环境影响, 因此通过连锁分析或者关联分析等遗传手段筛选控制重要数量性状的位点, 有助于为培育高产优质苦荞品种提供优质的基因资源[24]. 苦荞属于严格闭花授粉作物, 且花朵非常小, 杂交困难[25], 利用自然群体对苦荞重要性状进行关联分析, 对苦荞重要性状调控位点鉴定及苦荞分子标记辅助育种具有重要作用. 目前, 在苦荞种质资源中利用SSR分子标记进行关联分析的相关研究较少[7]. 本研究利用77对SSR分子标记, 采用GLM模型和MLM模型对263份苦荞种质资源进行芦丁含量的关联分析, 检测到12个SSR标记(TatG0085,TatG0131,TatG0155,TatG0156,TatG0164,TatG0187,TatG0188,S6763,SWU_Ft029,SWU_Ft177,SWU_Ft394,SWU_Ft420)与芦丁含量显著相关. 在前人的研究中, TatG0131、 SWU_Ft420还同时与籽粒面积极显著相关[17], SWU_Ft177、 SWU_Ft394与籽粒周长极显著相关[17], TatG0164与粒宽极显著相关[17], 且该引物对应基因编码天冬氨酸蛋白酶[26]; S6763与籽粒圆度极显著相关[17]; TatG0187与籽粒圆度[17]和主茎分枝数[7]极显著相关, 且该引物对应基因编码12s球蛋白种[26]; TatG0155与植株株高极显著相关[17]. 以上SSR标记与芦丁含量显著相关的同时, 与其他重要性状也显著相关, 表明其可能有“一因多效”的功能, 参与调控苦荞多个重要性状, 但仍需进一步验证. 本研究结果将为苦荞高芦丁种质资源筛选及分子标记辅助选择育种奠定基础.
4 结论
苦荞种质资源芦丁含量与SSR标记关联分析的试验结果表明, 本研究中263份苦荞种质籽粒芦丁含量变幅为0.46%~1.43%, 变异系数为21.64%. SSR的聚类分析将263份苦荞资源分为3个类群. 群体结构将263份苦荞资源划分为3个亚群. 但聚类分析的3个类群和群体结构分析的3个亚群并不相同. 分析两者差异, 可能是因为两种方法的分析角度不同. 群体结构分析主要是基于模型角度研究的, 而SSR聚类分析可以直观表现各苦荞种质资源的亲缘关系远近. 亲缘关系热图可以直观表明各苦荞资源之间的亲缘关系远近. GLM和MLM两种模型下的p值, QQ plot图显示两个模型都适合苦荞资源芦丁含量的SSR关联分析. 对263份苦荞种质籽粒芦丁含量与77对SSR基因分型进行了基于GLM模型和MLM模型的关联分析. 其中TatG0164(4.47%)解释的表型变异率较大. 由此可以推测TatG0164是控制苦荞籽粒芦丁含量的重要位点, 可进一步开发为实用性标记, 这将为分子标记辅助育种选育高芦丁含量苦荞籽粒品种提供依据.
