基于数据库分析ANLN在宫颈癌中预后价值及其与免疫浸润的相关性
2023-09-27张鲁燕菅金波张玲玲刘书斌
张鲁燕 菅金波 张玲玲 赵 靓 刘书斌 巩 方
1 滨州市人民医院肿瘤科 山东 滨州 256610; 2 滨州医学院附属医院肿瘤科 山东 滨州 256603
宫颈癌是一种常见的妇科肿瘤,在全球女性恶性肿瘤的发病率和死亡率排第四位,仅次于乳腺癌、结肠直肠癌和肺癌[1]。但是,在发展中国家女性恶性肿瘤中,宫颈癌的发病率和死亡率仅次于乳腺癌[2]。宫颈癌可以通过筛查来预防。随着筛查技术的广泛普及,宫颈癌的发病率逐年下降。然而,由于早期宫颈癌没有症状,许多患者在被诊断时已经处于疾病的中晚期[3]。宫颈癌的主要治疗方法包括手术、放疗和辅助化疗。这些治疗手段降低了宫颈癌的死亡率,但5年无病生存率(disease free survival,DFS)仍较低,特别是对于晚期患者,DFS仅为50%[4]。近年来,免疫治疗的出现对恶性肿瘤的治疗具有里程碑式意义,肿瘤免疫微环境成为当前研究的热点。
Anillin(ANLN)是一种肌动蛋白结合蛋白,其作为细胞分裂的关键因子与许多蛋白相互作用[5]。ANLN在多种肿瘤中均表达上调,参与肿瘤的发生、发展过程,并能增加肿瘤细胞的增殖、迁移和侵袭[6]。肿瘤微环境中的免疫细胞浸润水平在肿瘤的发生、进展、转移和治疗耐药性中起着重要作用[7-9]。目前,关于ANLN对肿瘤免疫微环境影响的研究较少。
随着大数据时代的到来,基因数据库的共享使得从基因水平揭示宫颈癌的发生、发展成为当下研究的热点。本研究通过多个生物数据库分析ANLN对宫颈癌的免疫微环境的影响及其预后的关系,旨在为宫颈癌综合治疗及预后评价提供新的思路。
1 材料和方法
1.1 数据的采集和处理 本研究从癌症基因组图谱(the cancer genome atlas,TCGA)数据库下载宫颈癌RNA表达谱和临床信息,剔除重复样本后,TCGA数据库收集了306例宫颈鳞状细胞癌和宫颈内腺癌(cervical squamous cell carcinoma and endocervical adenocarcinoma,CESC)标本和3例正常对照标本。FRKM(Fregments Per Kilibase per Million)格式的RNAseq转换成TPM(transcripts per million reads)格式,并进行log2转化,以供后续分析。本研究还从UCSC Xena(https://xenabrowser.net/数据图/)中下载了TPM格式的RNA-seq数据,这些数据在TCGA中经过统一处理。
基因表达谱数据集(GSE29570、GSE52903、GSE63514)均来源于GEO(gene expression omnibus)数据库(https://www.ncbi.nlm.nih.gov/gds)。基于人类蛋白图谱(human protein atlas,HPA)数据库(https://www.proteinatlas.org/)的免疫组化数据,探索宫颈组织中ANLN蛋白的表达水平。
1.2 TISIDB数据库分析 肿瘤-免疫系统相互作用数据库(tumor-immune system interaction database,TISIDB)(http://cis.hku.hk/TISIDB)是一个针对肿瘤和免疫系统交互的门户网站,集成了多种异构数据类型。TISIDB数据库涉及988个已报道的免疫相关抗肿瘤基因、高通量筛选技术、分子图谱分析和癌旁多组学数据,以及从7个公共数据库中收集的大量免疫学数据资源。本研究通过TISIDB数据库提供了ANLN与免疫调节剂和趋化因子的关联。
1.3 统计学方法 采用R(v.3.6.3)软件进行。宫颈癌的免疫浸润分析采用R包GSVA包中的单样本基因集富集分析(single sample gene set enrichment analysis,ssGSEA)方法。本研究从文献中的基因表达谱中定量了24种免疫细胞类型的浸润水平[10]。采用Spearman和Wilcoxon秩和检验分析ANLN与24个免疫细胞浸润水平之间的相关性。采用Kaplan-Meier计算患者的生存率。采用Cox比例风险模型进行单因素和多因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 ANLN基因在宫颈癌中的表达 为了确定ANLN在肿瘤和正常组织中的表达差异,本研究使用TCGA和GTEx数据库分析了不同癌症类型和正常组织中ANLN的转录水平(图1A)。本研究显示,ANLN在多种类型的癌症中的表达均高于正常组织。本研究进一步利用TCGA和GEO数据评估了宫颈癌中ANLN的表达水平,发现宫颈癌组织中ANLN的表达水平均显著高于正常组织(图1B~E)。同时,本研究基于HPA数据库分析了CESC中ANLN的蛋白表达水平(图1F),数据显示,ANLN在肿瘤中的表达水平高于正常组织。
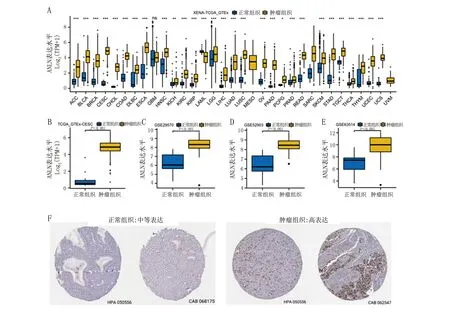
*P<0.05;**P<0.01,***P<0.001,ns差异无统计学意义。
2.2 ANLN与宫颈癌预后诊断的关系 为了分析ANLN在CESC中表达的诊断价值,本研究对TCGA数据库中的ANLN基因表达数据进行了受试者工作特征曲线(receiver operating characteristic curve,ROC)分析,以评估该基因的诊断价值。ROC曲线下面积(area under curve,AUC)为0.993,提示诊断价值较高(图2A)。为了了解其对CESC预后的作用,本研究采用了Kaplan-Meier分析,结果显示,在TCGA队列中,较高的ANLN表达与较差的总生存期(overall survival,OS)、无进展生存期(progression free survival,PFS)相关(图2B、C)。单因素分析显示,较高的ANLN表达、晚期T分型、阳性淋巴结、远处转移和晚期临床分期与较差的OS相关。然而,多变量分析显示,ANLN的表达并不是CESC患者OS的独立危险因素(表1)。

表1 使用Cox回归分析TCGA数据库中宫颈癌患者总生存和临床病理特征的相关性

图2 TCGA数据库中ANLN表达与宫颈癌预后分析
2.3 ANLN基因与免疫浸润的相关性研究 众所周知,肿瘤微环境(tumor microenvironment,TME)在调节恶性肿瘤进展和治疗反应方面起着至关重要的作用。因此,近年来靶向TME的治疗策略已成为一种很有前途的癌症治疗方法。为了评估ANLN对TME的影响,本研究将TCGA数据库中宫颈癌患者根据ANLN表达量的中位数分为高表达组和低表达组,采用ssGSEA法评估TCGA队列中24个免疫细胞的比例(图3A)。在ANLN高表达的宫颈癌中,16种免疫细胞的比例低于ANLN低表达组,而辅助型T细胞(T helper cells)、中央记忆型T细胞(central memory T cell,Tcm)、γδT细胞(gamma delta T cell,Tgd)、辅助型T细胞2(Th2 cell)的比例高于ANLN低表达组。进一步将 ANLN的表达和各类免疫细胞的占比进行相关性检验,其中15种免疫细胞与ANLN的表达成负相关,T helper cells、Tcm、Tgd、Th2与ANLN的表达成正相关,与上述结果一致(图3B、C)。本研究使用ESTIMATE来计算CESC中的基质和免疫评分,结果表明,与ANLN低表达组相比,ANLN高表达组的基质评分和免疫评分均较低(图3D、E)。

*P<0.05;**P<0.01,***P<0.001,ns差异无统计学意义。
2.4 ANLN基因与趋化因子、趋化因子受体的相关性研究 趋化因子和趋化因子受体是免疫细胞浸润到肿瘤的关键[11]。因此,本研究使用TISIDB数据库分析了CESC中ANLN的表达水平与免疫细胞趋化因子和趋化因子受体之间的相关性(图4A、B)。热图结果显示,趋化因子CCL14、趋化因子受体CXCR4与CESC中ANLN的表达显著负相关,与趋化因子CXCL8显著正相关(图4C、D、E)。

红色代表正相关,蓝色代表负相关
2.5 ANLN与免疫检查点的相关性研究 免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)是一种显著的新型肿瘤免疫治疗策略,它逐渐改善了多种癌症患者的预后[12]。本研究使用TISIDB数据库分析了ANLN与不同类型的人类癌症中免疫抑制剂和免疫刺激剂的表达之间的相关性(图5A、B)。本研究可见在CESC中ANLN与免疫抑制剂LGALS9、TGFB1、TGFBR1、VTCN1显著相关,与免疫刺激剂CXCR4、RAET1E、TNFRSF14显著相关。需要指出的是,CD274(PD-L1)是一种对免疫检查点抑制剂应答的生物标志物,与CESC中ANLN的表达相关(图5C-L)。这提示,ANLN基因可能在调节肿瘤免疫中发挥了作用。
3 讨论
ANLN是一种肌动蛋白结合蛋白,在细胞增殖和迁移,特别是细胞分裂中起重要作用。 ANLN的表达水平在肿瘤发生、发展过程中扮演重要角色,其表达水平与肿瘤侵袭性密切相关。本研究发现,ANLN在CESC中高表达,同时蛋白水平也验证了ANLN在CESC中高表达。本研究还发现,ANLN高表达与CESC的不良预后相关,这与文献[13]一致。这提示,ANLN可能作为一种致癌基因促进宫颈癌的发展,可作为CESC患者预后相关的潜在生物学标志物。
肿瘤微环境是肿瘤细胞交换物质和能量的地方,它在肿瘤生物学中起着重要的作用[14]。目前关于ANLN基因对于肿瘤免疫微环境影响的研究鲜有报道。本研究进一步探索了ANLN基因表达与CESC免疫微环境的关系,结果显示,ANLN基因与多种免疫细胞浸润水平相关。与辅助型T细胞、Tcm、Tgd、Th2细胞的呈正相关,与其他16种免疫细胞呈负相关。根据估计算法,肿瘤免疫评分是影响肿瘤进展和免疫治疗结果的重要因素[15]。Yang等[16]认为在宫颈癌中免疫评分高的预后高于免疫评分低的。本研究表明,ANLN高表达组的基质评分和免疫评分均较低。这表明,ANLN可能是一种新的宫颈癌免疫相关治疗靶点。然而,ANLN在肿瘤免疫微环境中的确切作用仍需进一步深入探索。
趋化因子在癌症免疫浸润中具有重要作用[17-19]。Gu等[20]发现,CCL14表达水平与肝癌浸润性B细胞、CD4+T细胞、CD8+T细胞、巨噬细胞、嗜中性粒细胞和树突状细胞水平具有强相关性。CCL14 表达水平与PD-1、TIM-3和CTLA-4表达水平呈负相关。Lin等[21]发现,在胃癌组织中,CXCL8主要由巨噬细胞分泌,CSF-2促进巨噬细胞来源的CXCL8的分泌。高水平的CXCL8与CD8+T细胞浸润和Ki67+CD8+T细胞比例下降相关。CXCL8通过诱导巨噬细胞上PD-L1的表达抑制CD8+T细胞的功能。阻断CXCL8通路有助于PD-L1+巨噬细胞的减少,抑制免疫逃避。本研究利用TISIDB数据库分析了CESC中ANLN的表达水平与免疫细胞趋化因子和趋化因子受体的表达之间的相关性。结果显示,ANLN的表达水平与CCL14、CXCR4的表达呈负相关,而与CXCL8呈正相关。这提示,ANLN的表达可能抑制免疫细胞向TME的迁移,促进肿瘤免疫逃逸。
免疫检查点是免疫反应过程中起抑制性免疫调节作用的位点,会被肿瘤细胞利用,成为免疫逃逸的机制之一。而ICIs可通过封闭免疫检查点,解除免疫抑制,活化T细胞功能,增强免疫,提高对肿瘤细胞的杀伤作用[22-23]。免疫检查点抑制剂在宫颈癌中显示出良好的结果[24-25],美国食品和药品监督管理局批准派姆单抗用于化疗期间或化疗后疾病进展的晚期宫颈癌[26]。然而,抗PD-1/PD-L1单药治疗的客观缓解率徘徊在20%左右。阻断PD-1/PD-L1治疗在几乎80%的宫颈癌患者中没有显示出疗效。这提示,PD-1/PD-L1在免疫治疗中的潜在作用机制有待进一步阐明。因此,迫切需要新的免疫检查点抑制剂或全面了解PD-1/PD-L1在癌变过程中调控的具体机制。
本研究发现,在CESC中ANLN与免疫抑制剂LGALS9、TGFB1、TGFBR1、VTCN1显著相关,与免疫刺激剂CXCR4、RAET1E、TNFRSF14显著相关。TGF-β受体1(TGFBR1)在TGF-β家族中发挥重要作用,并对许多生物过程产生重要影响,包括细胞生长、生殖能力和免疫反应[27]。本研究发现,CESC中ANLN与TGFB1、TGFBR1正相关。这提示,ANLN可能通过TGFB1、TFRBR1参与肿瘤免疫逃逸,进一步促进肿瘤进展。
综上所述,ANLN可能是宫颈癌预后不良的潜在分子标志物,其表达与肿瘤免疫细胞浸润相关,有助于免疫逃逸的发生,为临床CESC治疗提供新的思路。
