基于转录组分析金属离子对绿绒蒿属3种植物花瓣呈色的影响
2023-09-27陈丽琦李拓键
罗 军, 陈丽琦, 李拓键, 区 智, 屈 燕
(西南林业大学园林园艺学院 国家林业和草原局西南风景园林工程技术研究中心 云南省功能性花卉资源及产业化技术工程研究中心, 云南 昆明 650224)
绿绒蒿属(MeconopsisVig.)植物隶属于罂粟科(Papaveraceae),一年生或多年生草本,主要分布在青藏高原,是传统藏药植物[1]。绿绒蒿属植物株型姿态优美,花朵硕大秀丽,花色丰富,有黄色、白色、蓝色、蓝紫色、紫红色和酒红色等[2]。花色是绿绒蒿属植物关键分类特征之一,其中全缘叶绿绒蒿〔M.integrifolia(Maxim.) Franch.〕花黄色[3],红花绿绒蒿(M.puniceaMaxim.)花红色[4],川滇绿绒蒿(M.wilsoniiGrey-Wilson)花蓝紫色[5],是绿绒蒿属植物的典型花色,为绿绒蒿属植物花色形成机制研究的理想材料。
花色作为植物的重要生物性状,是多因子综合作用的结果,除环境因子外,还受细胞介质pH值[6]、花色素种类和含量[7]以及金属离子等影响。已有研究结果表明:金属离子在越橘(Vacciniumvitis-idaeaLinn.)[8]、金花茶组(Sect.ChrysanthaChang)植物[9]和郁金香(TulipagesnerianaLinn.)[10]等植物花瓣呈色中具有重要作用。高宇等[11]认为,Na+、K+和Ca2+对软枣猕猴桃〔Actinidiaarguta(Sieb. et Zucc.) Planch. ex Miq.〕花青素稳定性无显著影响,但Mg2+和Cu2+却促使花青素发生氧化反应,降低花青素稳定性。Miller等[12]认为,自然状态下法国万寿菊(TagetespatulaLinn.)的花瓣呈淡黄色,Cu2+使花色转变为褐色,Cr3+使花瓣呈暗橘色。在大花绿绒蒿(M.grandisPrain)中,Fe3+、Mg2+、黄酮醇和矢车菊素衍生物相结合能形成一种区分于常见花色素的新型金属复合体色素,进而形成花瓣中的蓝色色素[13]。Shoji等[14]认为,自然条件下部分郁金香品种的花萼呈现紫红色,在花瓣底部喷施外源Fe3+,花萼颜色会转变为蓝紫色。由此表明金属离子的种类和含量与花瓣颜色的形成有密切联系,研究不同颜色绿绒蒿属植物花瓣中的金属离子对探究绿绒蒿属植物花瓣的呈色有重要意义。
鉴于此,本研究对不同花色的绿绒蒿属植物(包括全缘叶绿绒蒿、红花绿绒蒿和川滇绿绒蒿)盛开期花瓣中金属离子含量进行测定,同时利用转录组数据分析并筛选出这3种植物花瓣中金属离子相关的差异表达unigene,探究不同金属离子对绿绒蒿属3种植物花瓣呈色的影响,以期为绿绒蒿属植物的引种栽培、花色调控和园林应用提供理论依据。
1 材料和方法
1.1 材料
供试全缘叶绿绒蒿、红花绿绒蒿和川滇绿绒蒿采集于2021年6月,根据开花时期的形态及颜色等特征分为花蕾期(花蕾里的花瓣完全着色)、开裂期(花蕾裂开,花瓣从花蕾露出)和盛开期(花瓣完全展开)(图1)。在花开放过程中,全缘叶绿绒蒿花瓣黄色程度逐渐加深,红花绿绒蒿花瓣红色程度逐渐变浅,而川滇绿绒蒿花瓣蓝紫色程度先加深后变浅。每种植物选择长势相近的5株,各时期每株选择1朵生长状态及大小相似的花朵。自然光照下,使用英国皇家园艺协会比色卡(Royal Horticultural Society colour chart,RHSCC)确定各时期花瓣颜色。绿绒蒿属3种植物的采集信息见表1。
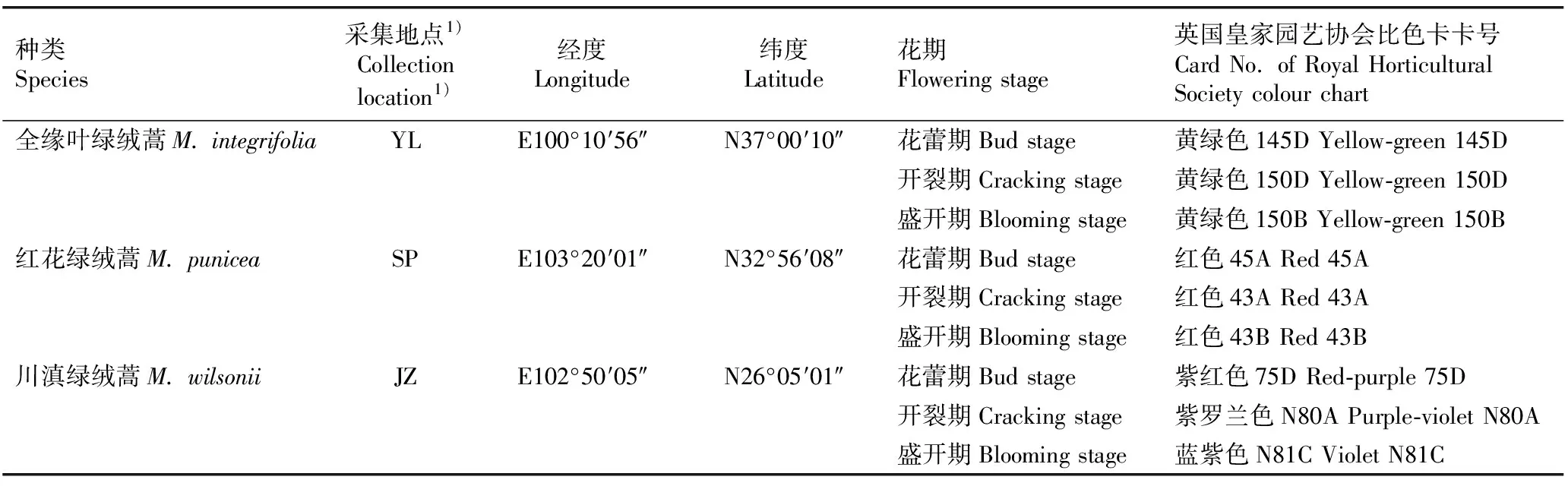
表1 绿绒蒿属3种植物花部的采集信息

Mi: 全缘叶绿绒蒿M. integrifolia (Maxim.) Franch.; Mp: 红花绿绒蒿M. punicea Maxim.; Mw: 川滇绿绒蒿M. wilsonii Grey-Wilson. 从左到右依次为花蕾期、开裂期和盛开期From left to right are the bud stage, cracking stage, and blooming stage.
花蕾期和开裂期从3株植株分别取2 g花瓣样品,盛开期从3株植株分别取5 g花瓣样品,即为3次重复。采集前用体积分数75%乙醇对采样工具进行消毒,采集后迅速用锡箔纸包裹花瓣,装入密封袋后立即置于干冰桶中,带回实验室后移入-80 ℃超低温冰箱保存、备用。
1.2 方法
1.2.1 花瓣中金属离子含量测定 参考黄奇等[15]的方法,取盛花期绿绒蒿属3种植物花瓣于60 ℃烘干24 h,每种植物准确称取3份,每份0.5 g,然后于700 ℃碳化0.5 h,500 ℃灰化3.5 h,冷却后以体积分数5%硝酸定容至50 mL,待测。分别取质量浓度1 000 μg·mL-1Fe3+、Mg2+、Ca2+、K+、Mn2+、Cu2+和Zn2+标准液,用超纯水配制不同梯度的标准工作液,其中,Fe3+、Mg2+、Ca2+和Zn2+工作液的质量浓度范围为1.0~10.0 μg·mL-1,K+工作液的质量浓度范围为10.0~100.0 μg·mL-1,Mn2+和Cu2+工作液的质量浓度范围为0.1~1.0 μg·mL-1。使用AA-7000型原子火焰吸收光谱仪(日本岛津公司)测定标准工作液的吸光值,以吸光值为纵坐标(y)、各金属离子含量为横坐标(x)绘制标准曲线。Fe3+的线性回归方程为y=0.007 5x-0.008 7(r=0.999 7),Mg2+的线性回归方程为y=0.077 4x+0.771 6(r=0.999 9),Ca2+的线性回归方程为y=0.051 9x+0.028 9(r=0.999 6),K+的线性回归方程为y=0.009 2x+1.180 5(r=0.999 5),Mn2+的线性回归方程为y=0.018 0x-0.001 4(r=0.999 7),Cu2+的线性回归方程为y=0.153 2x-0.004 9(r=0.999 5),Zn2+的线性回归方程为y=0.049 7x+0.005 6(r=1.000 0)。加标回收率良好,均在95%以上。测定盛开期花瓣样品待测液的吸光值,根据标准曲线计算待测液金属离子含量,进一步计算花瓣样品中Fe3+、Mg2+、Ca2+、K+、Mn2+、Cu2+和Zn2+7种金属离子含量。
1.2.2 转录组数据分析
1.2.2.1 总RNA提取及检测 使用TIANGEN植物总RNA提取试剂盒〔天根生化科技(北京)有限公司〕提取各时期花瓣样品的总RNA,经质量体积分数1%琼脂糖凝胶电泳和NanoDrop 2000超微量紫外分光光度计(美国ThermoFisher公司)检测其质量、浓度和纯度。
1.2.2.2 转录组测序及拼接 委托深圳华大基因科技有限公司建立cDNA文库,将质量检测合格的cDNA使用HiSeqTM2000测序平台(美国Illumina公司)测序,利用SOAPnuke软件将测序所得raw read过滤,去除冗余与质量低的序列,得到clean read,利用Trinity(v2.0.6)软件组装,再利用TGICL软件对转录本进行聚类去冗余,获得最终的unigene。
1.2.2.3 Unigene功能注释 通过BLAST软件将所得unigene与GO、KOG、KEGG、SwissProt、NT和NR数据库比对,预测unigene的氨基酸序列之后,利用HMMER软件与Pfam数据库比对,获得unigene的注释信息。
1.2.2.4 差异unigene分析 利用RSEM(v1.2.8)软件计算各样品中unigene的表达水平。用FPKM(fragments per kilobase of transcript per million fragments mapped)值表示unigene的相对表达量,基于27个花瓣样品转录本的相对表达量,以|log2FC|大于等于1、FDR小于等于0.05为基准〔FC为差异倍数(fold change),FDR为错误发现率(false discovery rate)〕,利用DESeq2软件检测任意2个阶段间的差异表达转录本,筛出差异unigene,将差异unigene进行GO功能分类,同时利用R软件中的phyper函数进行富集分析,计算p值,然后对p值进行FDR校正,通常Q值(p值的错误发现率)小于等于0.05的功能视为显著富集,对其进行GO富集分析。
1.2.2.5 实时荧光定量PCR(qRT-PCR)验证 参照“1.2.2.1”提取和检测花瓣样品的总RNA,逆转录参照GoldenstarTMRT6 cDNA Synthesis Kit试剂盒(北京擎科生物科技有限公司)说明书,qRT-PCR以actin(CL3969.Contig4_All)为内参基因,利用Primer Premier 6.0软件设计引物,引物序列见表2。实时荧光定量PCR反应体系参照2×T5 Fast qPCR Mix (SYBR Green Ⅰ)(北京擎科生物科技有限公司),使用LightCycler©480实时荧光定量PCR仪(上海土森视觉科技有限公司)扩增,qRT-PCR程序为:95 ℃预变性2 min;95 ℃变性30 s、56 ℃退火15 s、72 ℃延伸30 s,35个循环。采用2-ΔΔCT法[16]计算unigene的相对表达量。
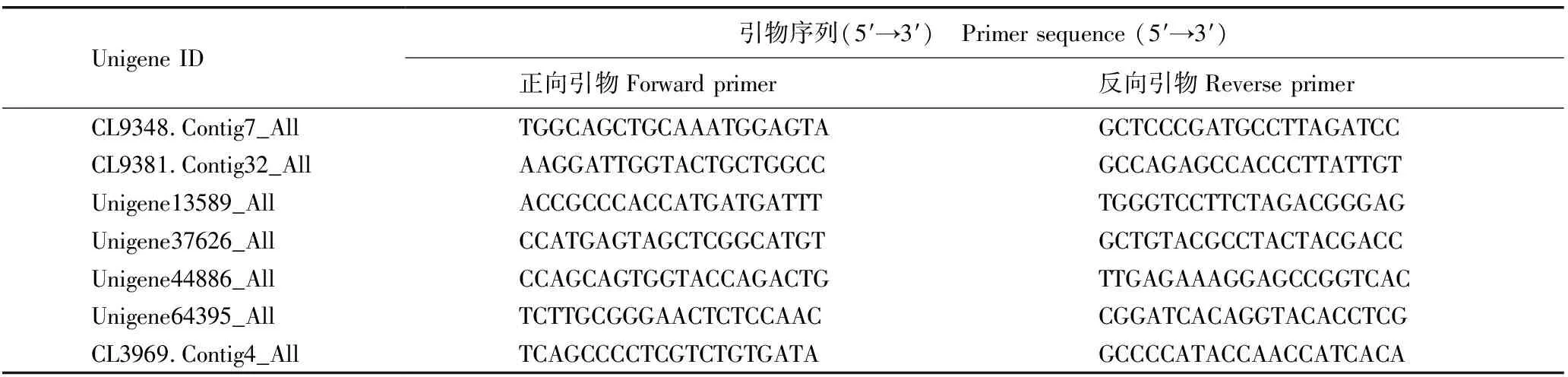
表2 用于实时荧光定量PCR的引物
1.3 数据处理和统计分析
利用EXCEL 2019软件整理和分析数据,利用SPSS 26.0统计分析软件对数据进行统计分析,利用Origin 2020和TBtools软件作图,其中,利用TBtools软件中的HeatMap程序绘制unigene表达热图,均一化后的相对表达量大于0.5表示差异unigene明显表达。
2 结果和分析
2.1 盛开期绿绒蒿属3种植物花瓣中金属离子含量的比较
盛开期绿绒蒿属3种植物花瓣中金属离子含量见表3。由表3可见:盛开期绿绒蒿属3种植物花瓣的7种金属离子中均为K+含量最高,Cu2+含量最低。全缘叶绿绒蒿花瓣中7种金属离子含量均显著(P<0.05)高于红花绿绒蒿和川滇绿绒蒿;红花绿绒蒿花瓣中Fe3+、Mg2+、K+、Mn2+和Zn2+含量显著低于川滇绿绒蒿,Ca2+和Cu2+含量显著高于川滇绿绒蒿。从绿绒蒿属3种植物花瓣中金属离子含量的差异倍数来看,全缘叶绿绒蒿与红花绿绒蒿之间以及红花绿绒蒿与川滇绿绒蒿之间金属离子含量差异倍数较大的均为Fe3+、Mn2+和Zn2+,全缘叶绿绒蒿与川滇绿绒蒿之间金属离子含量差异倍数最大的为Fe3+,其次是Ca2+和Mg2+,说明Fe3+含量在绿绒蒿属不同种类间的差异均较大。
表3 盛开期绿绒蒿属3种植物花瓣中金属离子含量
2.2 绿绒蒿属3种植物花瓣的转录组数据分析
2.2.1 转录组测序数据质量 对不同花期绿绒蒿属3种植物27个花瓣样品进行转录组测序,获得了1 297.10 Mb的raw read,过滤并筛选后得到1 175.19 Mb的clean read,平均每个花瓣样品获得43.53 Mb的clean read,各花瓣样品的Q20和Q30的平均值分别为97.51%和90.22%。共获得411 557个unigene,平均长度为1 949 bp,N50值为2 754 bp,GC含量为38.49%。
2.2.2 数据库功能注释 将获得的411 557个unigene进行注释,被GO、Pfam、KOG、KEGG、SwissProt、NT和NR 7大数据库注释到的unigene共318 657个,占unigene总数的77.4%。其中注释到GO数据库的unigene共171 730个,占unigene总数的41.7%。被注释的unigene分为3大类,包括生物过程、细胞组成和分子功能,分别有98 560、116 067和194 385个,分别占unigene总数的23.9%、28.2%和47.2%,其中,分子功能中注释unigene数超过10 000的二级分类有结合(87 710)、催化活性(84 496)和转运蛋白活性(10 010)。
2.3 绿绒蒿属3种植物花瓣中金属离子相关差异unigene的GO富集分析
绿绒蒿属3种植物花瓣中金属离子相关差异unigene的GO富集结果见表4。由表4可见:Fe3+和Fe2+以及Mg2+、Ca2+、K+、Mn2+、Cu2+、Zn2+相关差异unigene分别富集于5、3、3、3、1、2和2条GO条目中,其中,Fe3+和Fe2+相关差异unigene富集的GO条目数量最多,包括三价铁结合、亚铁结合、铁离子转运、铁离子的细胞内螯合和亚铁螯合酶活性;锌离子结合条目中的差异unigene数量最多(18)。

表4 绿绒蒿属3种植物花瓣中金属离子相关差异unigene的GO富集结果
2.3.1 Fe3+和Fe2+相关GO富集条目 绿绒蒿属3种植物花瓣中Fe3+和Fe2+相关差异unigene的表达热图见图2。由图2可见:全缘叶绿绒蒿花瓣中各条目明显表达的差异unigene数量均较多。三价铁结合条目中,除Unigene41916_All外,红花绿绒蒿花瓣中差异unigene的相对表达量较低;川滇绿绒蒿花瓣中仅Unigene21411_All和Unigene41916_All明显表达。亚铁结合条目中,红花绿绒蒿花瓣中仅Unigene23941_All在不同花期的相对表达量较低,川滇绿绒蒿花瓣中仅Unigene38400_All在开裂期明显表达。铁离子转运条目中,除Unigene41916_All外,全缘叶绿绒蒿花瓣中差异unigene的相对表达量在开花过程中总体呈先升高后降低的趋势;红花绿绒蒿花瓣中仅Unigene41916_All和Unigene30354_All有表达,川滇绿绒蒿花瓣中仅Unigene41916_All和Unigene37626_All明显表达。铁离子的细胞内螯合条目中,红花绿绒蒿花瓣中Unigene30354_All在花蕾期明显表达,川滇绿绒蒿花瓣中Unigene164988_All在花蕾期和盛开期明显表达。亚铁螯合酶活性条目中,红花绿绒蒿花瓣中Unigene268239_All、Unigene161123_All和Unigene268237_All有明显表达,且其相对表达量在开花过程中呈先升高后降低的趋势;川滇绿绒蒿花瓣中除Unigene94643_All、Unigene105961_All和Unigene156789_All外,其他差异unigene表达不明显。
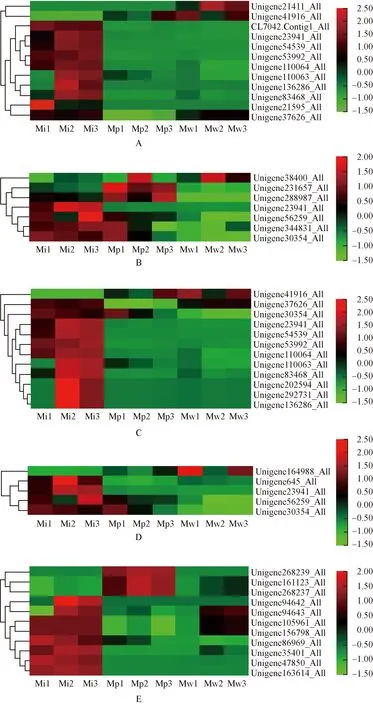
A: 三价铁结合Ferric iron binding; B: 亚铁结合Ferrous iron binding; C: 铁离子转运Iron ion transport; D: 铁离子的细胞内螯合Intracellular sequestering of iron ion; E: 亚铁螯合酶活性Ferrochelatase activity. 图中标尺表示均一化后的相对表达量The scale in the figure represents the relative expression after normalization. Mi1,Mi2,Mi3: 分别为全缘叶绿绒蒿花蕾期、开裂期和盛开期Bud stage, cracking stage, and blooming stage of M. integrifolia (Maxim.) Franch., respectively; Mp1,Mp2,Mp3: 分别为红花绿绒蒿花蕾期、开裂期和盛开期Bud stage, cracking stage, and blooming stage of M. punicea Maxim., respectively; Mw1,Mw2,Mw3: 分别为川滇绿绒蒿花蕾期、开裂期和盛开期Bud stage, cracking stage, and blooming stage of M. wilsonii Grey-Wilson, respectively.
2.3.2 Mg2+相关GO富集条目 绿绒蒿属3种植物花瓣中Mg2+相关差异unigene的表达热图见图3。由图3可见:镁离子结合条目中,全缘叶绿绒蒿花瓣中明显表达的差异unigene中,Unigene104503_All、Unigene18125_All和CL3868.Contig1_All的相对表达量在开花过程中呈升高趋势;红花绿绒蒿花瓣中差异unigene的相对表达量在开花过程中总体表现为先升高后降低;川滇绿绒蒿花瓣中明显表达的差异unigene主要是CL9348.Contig7_All、Unigene302777_All和Unigene332283_All,其相对表达量在开花过程中也呈先升高后降低的趋势。镁螯合酶活性条目中,全缘叶绿绒蒿花瓣中明显表达的差异unigene数量较多;而红花绿绒蒿和川滇绿绒蒿花瓣中明显表达的差异unigene数量较少,其中,红花绿绒蒿花瓣 中Unigene64395_All、Unigene96662_All和Unigene104686_All明显表达,川滇绿绒蒿花瓣中Unigene64395_All、Unigene81539_All和Unigene2709_All明显表达。镁离子转运条目中,全缘叶绿绒蒿花瓣中CL458.Contig43_All、Unigene41826_All和Unigene28725_All明显表达,红花绿绒蒿花瓣中Unigene212513_All、Unigene131644_All和Unigene167437_All明显表达,川滇绿绒蒿花瓣中Unigene212513_All、CL8483.Contig8_All和Unigene28725_All明显表达。
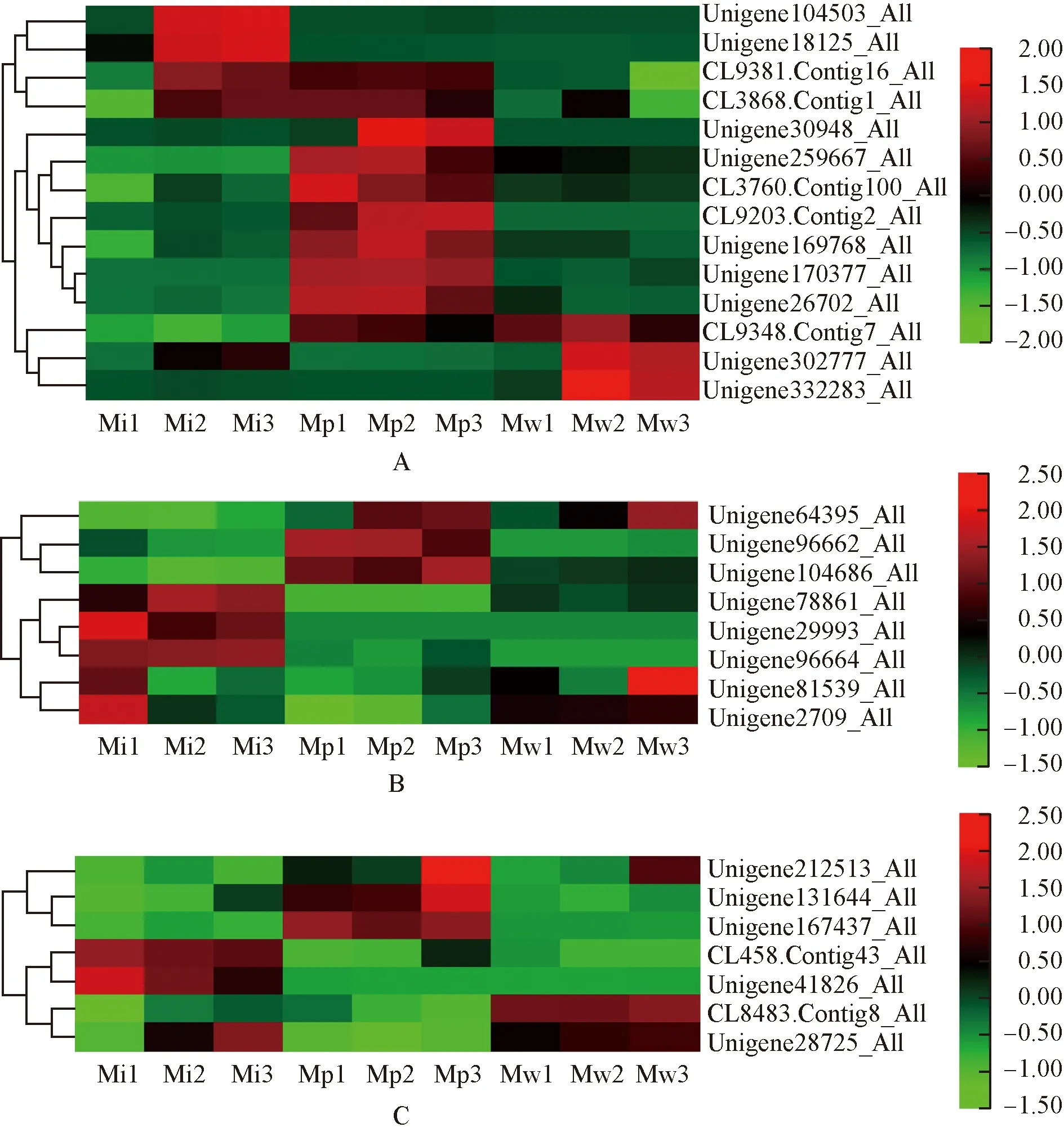
A: 镁离子结合Magnesium ion binding; B: 镁螯合酶活性Magnesium chelatase activity; C: 镁离子转运Magnesium ion transport. 图中标尺表示均一化后的相对表达量The scale in the figure represents the relative expression after normalization. Mi1,Mi2,Mi3: 分别为全缘叶绿绒蒿花蕾期、开裂期和盛开期Bud stage, cracking stage, and blooming stage of M. integrifolia (Maxim.) Franch., respectively; Mp1,Mp2,Mp3: 分别为红花绿绒蒿花蕾期、开裂期和盛开期Bud stage, cracking stage, and blooming stage of M. punicea Maxim., respectively; Mw1,Mw2,Mw3: 分别为川滇绿绒蒿花蕾期、开裂期和盛开期Bud stage, cracking stage, and blooming stage of M. wilsonii Grey-Wilson, respectively.
2.3.3 Ca2+相关GO富集条目 绿绒蒿属3种植物花瓣中Ca2+相关差异unigene的表达热图见图4。由图4可见:钙离子结合条目中,红花绿绒蒿花瓣中明显表达的差异unigene数量最多,其次为全缘叶绿绒蒿,而川滇绿绒蒿花瓣中明显表达的差异unigene数量最少。螯合钙离子释放到细胞溶质条目中,全缘叶绿绒蒿花瓣中Unigene107949_All、Unigene107945_All和Unigene76013_All在开花过程中明显表达,红花绿绒蒿和川滇绿绒蒿花瓣中这3个差异unigene的相对表达量均较低。细胞钙离子稳态条目中,绿绒蒿属3种植物花瓣中明显表达的差异unigene差异较大,全缘叶绿绒蒿花瓣中CL7794.Contig6_All、Unigene40892_All和CL7794.Contig2_All明显表达,红花绿绒蒿花瓣中CL7431.Contig21_All、CL8529.Contig5_All和Unigene73196_All明显表达,川滇绿绒蒿花瓣中Unigene307276_All、Unigene63608_All、Unigene307271_All、Unigene307273_All和Unigene307272_All明显表达。
2.3.4 K+相关GO富集条目 绿绒蒿属3种植物花瓣中K+相关差异unigene的表达热图见图5。由图5可见:钾离子结合条目中,红花绿绒蒿花瓣中明显表达的差异unigene数量最多;其次为全缘叶绿绒蒿;川滇绿绒蒿仅4个差异unigene明显表达,其 中Unigene173262_All、CL9381.Contig32_All和Unigene339291_All的相对表达量在开花过程中呈逐渐降低的趋势。钾离子稳态条目中,绿绒蒿属3种植物花瓣中明显表达的差异unigene差异较大,全缘叶绿绒蒿花瓣中Unigene58784_All、CL6642.Contig12_All、CL6642.Contig38_All、CL6642.Contig31_All、CL6642.Contig9_All和CL6642.Contig39_All在开裂期和盛开期明显表达,且除Unigene58784_All和CL6642.Contig9_All外,其他4个差异unigene的相对表达量在开花过程中呈逐渐升高的趋势;红花绿绒蒿花瓣中CL6642.Contig1_All、CL6642.Contig27_All、CL6642.Contig32_All、CL6642.Contig26_All、CL6642.Contig13_All和CL6642.Contig24_All明显表达,且除CL6642.Contig27_All外,其他5个差异unigene的相对表达量在开花过程中均呈先降低后升高的趋势;川滇绿绒蒿花瓣中无明显表达的差异unigene。钾离子转运条目中,全缘叶绿绒蒿花瓣中差异unigene总体无明显表达(除Unigene31522_All外);红花绿绒蒿花瓣中明显表达的差异unigene数量最多,但其相对表达量在开花过程中的变化趋势存在差异;在开花过程中,川滇绿绒蒿花瓣中Unigene69123_All和Unigene173429_All的相对表达量呈先升高后降低的趋势,Unigene331561_All的相对表达量呈逐渐升高的趋势。
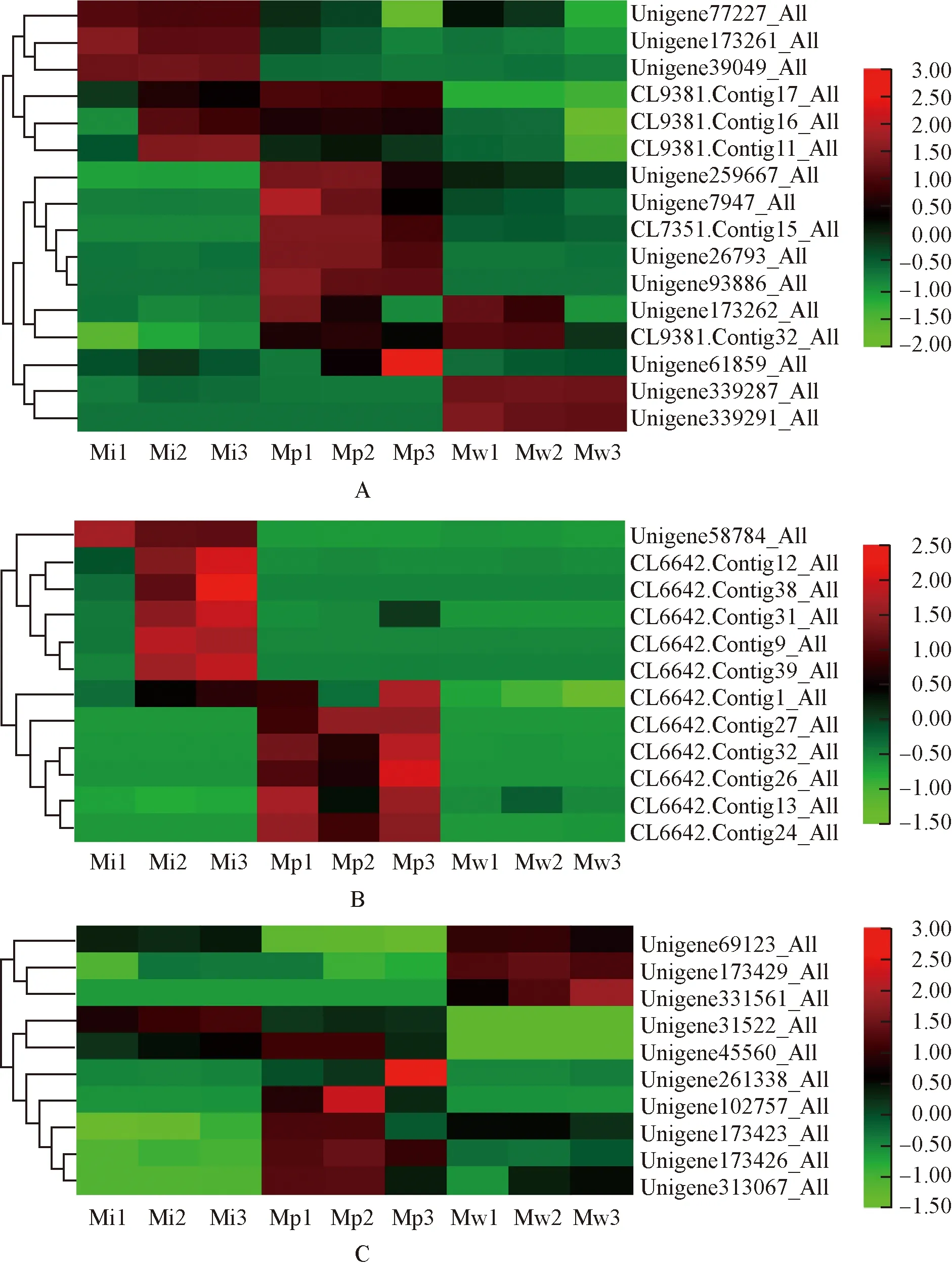
A: 钾离子结合Potassium ion binding; B: 钾离子稳态Potassium ion homeostasis; C: 钾离子转运Potassium ion transport. 图中标尺表示均一化后的相对表达量The scale in the figure represents the relative expression after normalization. Mi1,Mi2,Mi3: 分别为全缘叶绿绒蒿花蕾期、开裂期和盛开期Bud stage, cracking stage, and blooming stage of M. integrifolia (Maxim.) Franch., respectively; Mp1,Mp2,Mp3: 分别为红花绿绒蒿花蕾期、开裂期和盛开期Bud stage, cracking stage, and blooming stage of M. punicea Maxim., respectively; Mw1,Mw2,Mw3: 分别为川滇绿绒蒿花蕾期、开裂期和盛开期Bud stage, cracking stage, and blooming stage of M. wilsonii Grey-Wilson, respectively.
2.3.5 Mn2+相关GO富集条目 绿绒蒿属3种植物花瓣中Mn2+相关差异unigene的表达热图见图6。由图6可见:锰离子结合条目中,全缘叶绿绒蒿花瓣中Unigene336679_All、Unigene75693_All、Unigene66376_All和Unigene31339_All明显表达,但其相对表达量在开花过程中的变化趋势不一致;红花绿绒蒿花瓣中明显表达的差异unigene数量较多,且相对表达量在开花过程中总体呈降低趋势,如Unigene257235_All和Unigene66186_All;川滇绿绒蒿花瓣中明显表达的差异unigene数量最多,且在开花过程中,大部分差异unigene的相对表达量呈逐渐降低的趋势(如Unigene66186_All和Unigene255534_All),少数差异unigene的相对表达量呈先升高后降低的趋势(如Unigene48515_All)。

图中标尺表示均一化后的相对表达量The scale in the figure represents the relative expression after normalization. Mi1,Mi2,Mi3: 分别为全缘叶绿绒蒿花蕾期、开裂期和盛开期Bud stage, cracking stage, and blooming stage of M. integrifolia (Maxim.) Franch., respectively; Mp1,Mp2,Mp3: 分别为红花绿绒蒿花蕾期、开裂期和盛开期Bud stage, cracking stage, and blooming stage of M. punicea Maxim., respectively; Mw1,Mw2,Mw3: 分别为川滇绿绒蒿花蕾期、开裂期和盛开期Bud stage, cracking stage, and blooming stage of M. wilsonii Grey-Wilson, respectively.
2.3.6 Cu2+相关GO富集条目 绿绒蒿属3种植物花瓣中Cu2+相关差异unigene的表达热图见图7。由图7可见:铜离子结合条目中,绿绒蒿属3种植物花瓣均存在大量明显表达的差异unigene,以全缘叶绿绒蒿花瓣中明显表达的差异unigene数量最多,且其中大部分差异unigene的相对表达量在开花过程中呈逐渐升高的趋势,如CL1723.Contig2_All、Unigene3029_All和Unigene54639_All;红花绿绒蒿花瓣中明显表达的差异unigene的相对表达量在开花过程中的变化趋势存在差异,部分差异unigene的相对表达量呈逐渐降低的趋势(如Unigene332749_All、Unigene59760_All和Unigene453_All),部分差异unigene的相对表达量呈先升高后降低的趋势(如Unigene150192_All和Unigene230440_All);川滇绿绒蒿花瓣中明显表达的差异unigene的相对表达量在开花过程中总体呈先升高后降低的趋势,如Unigene332749_All、Unigene44886_All和Unigene24329_All。铜离子转运条目中,全缘叶绿绒蒿花瓣中明显表达的差异unigene数量最多(4),除Unigene111170_All外,其他3个差异unigene的相对表达量在开花过程中均呈先升高后降低的趋势;红花绿绒蒿花瓣中仅CL8182.Contig4_All和CL8182.Contig5_All明显表达,其相对表达量在开花过程中呈逐渐降低的趋势;川滇绿绒蒿仅CL8182.Contig5_All明显表达,其相对表达量在开花过程中呈先降低后升高的趋势。

A: 铜离子结合Copper ion binding; B: 铜离子转运Copper ion transport. 图中标尺表示均一化后的相对表达量The scale in the figure represents the relative expression after normalization. Mi1,Mi2,Mi3: 分别为全缘叶绿绒蒿花蕾期、开裂期和盛开期Bud stage, cracking stage, and blooming stage of M. integrifolia (Maxim.) Franch., respectively; Mp1,Mp2,Mp3: 分别为红花绿绒蒿花蕾期、开裂期和盛开期Bud stage, cracking stage, and blooming stage of M. punicea Maxim., respectively; Mw1,Mw2,Mw3: 分别为川滇绿绒蒿花蕾期、开裂期和盛开期Bud stage, cracking stage, and blooming stage of M. wilsonii Grey-Wilson, respectively.
2.3.7 Zn2+相关GO富集条目 绿绒蒿属3种植物花瓣中Zn2+相关差异unigene的表达热图见图8。由图8可见:锌离子结合条目中,全缘叶绿绒蒿花瓣中明显表达的差异unigene数量最少,其相对表达量在开花过程中的变化趋势差异较大;红花绿绒蒿花瓣中明显表达的差异unigene数量最多,在开花过程中,Unigene39244_All、Unigene55928_All、Unigene253766_All和Unigene42220_All的相对表达量呈先升高后降低的趋势,Unigene332253_All、Unigene45551_All和Unigene256195_All的相对表达量呈逐渐升高的趋势,而CL9410.Contig10_All和Unigene111383_All的相对表达量呈逐渐降低的趋势;在开花过程中,川滇绿绒蒿花瓣中Unigene88077_All、Unigene335024_All、Unigene307637_All和Unigene332253_All的相对表达量呈先升高后降低的趋势,Unigene74051_All、Unigene313940_All、Unigene45551_All和Unigene256195_All的相对表达量呈逐渐升高的趋势。对锌离子的反应条目中,全缘叶绿绒蒿花瓣中Unigene91043_All、Unigene60679_All和Unigene81741_All明显表达;红花绿绒蒿花瓣中Unigene42528_All和Unigene335547_All明显表达;川滇绿绒蒿花瓣中仅Unigene335547_All明显表达。
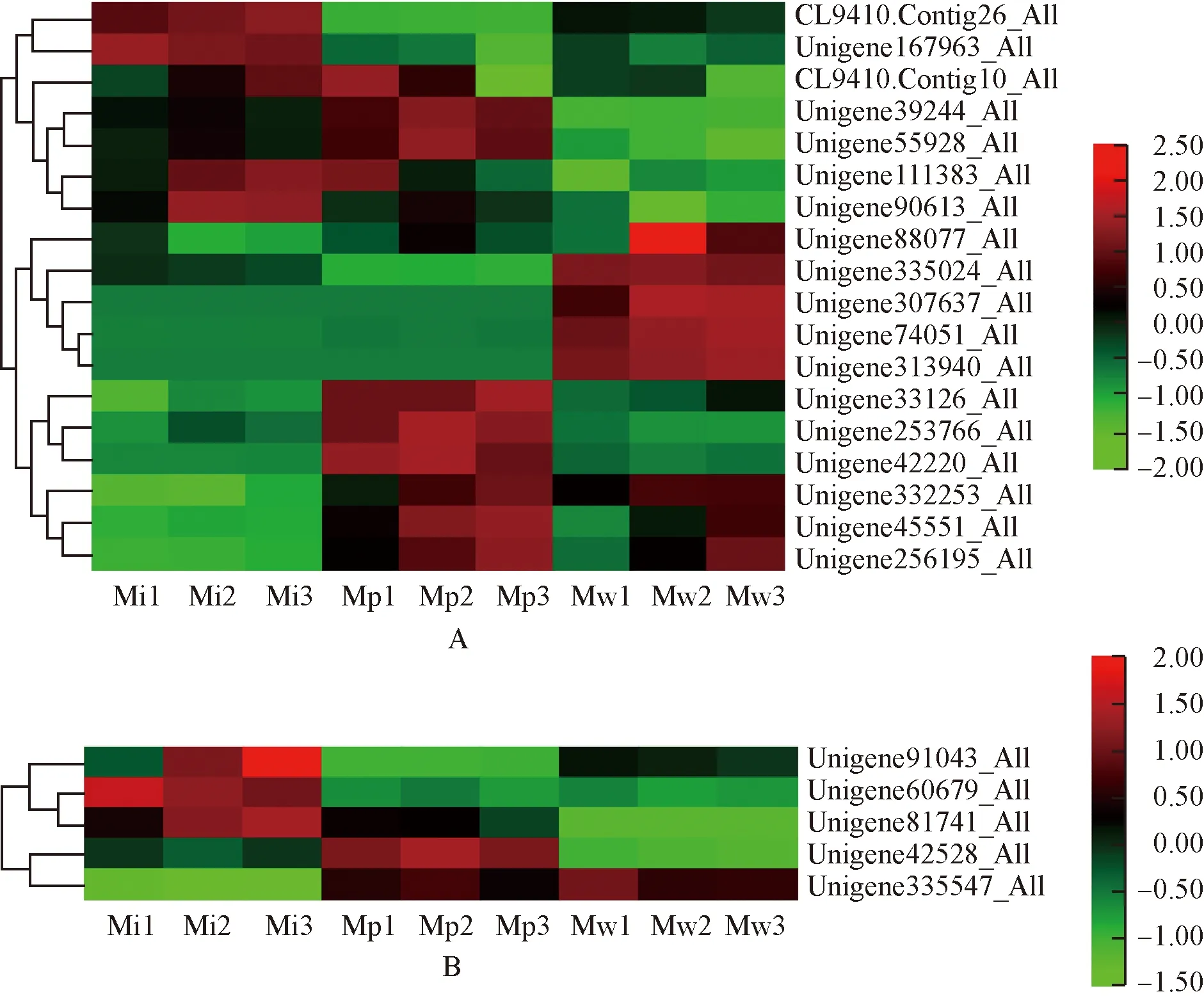
A: 锌离子结合Zinc ion binding; B: 对锌离子的反应Response to zinc ion. 图中标尺表示均一化后的相对表达量The scale in the figure represents the relative expression after normalization. Mi1,Mi2,Mi3: 分别为全缘叶绿绒蒿花蕾期、开裂期和盛开期Bud stage, cracking stage, and blooming stage of M. integrifolia (Maxim.) Franch., respectively; Mp1,Mp2,Mp3: 分别为红花绿绒蒿花蕾期、开裂期和盛开期Bud stage, cracking stage, and blooming stage of M. punicea Maxim., respectively; Mw1,Mw2,Mw3: 分别为川滇绿绒蒿花蕾期、开裂期和盛开期Bud stage, cracking stage, and blooming stage of M. wilsonii Grey-Wilson, respectively.
2.4 绿绒蒿属3种植物花瓣中差异unigene的实时荧光定量PCR验证
从上述与绿绒蒿属3种植物花瓣中金属离子相关的差异unigene中,随机挑选6个明显表达的差异unigene进行实时荧光定量PCR验证,结果见图9。由图9可见:绿绒蒿属3种植物花瓣中6个差异unigene的相对表达量在开花过程中的变化趋势与转录组数据基本一致,说明转录组数据以及筛选出的与金属离子相关的差异unigene的表达具有较高的可靠性和准确性。
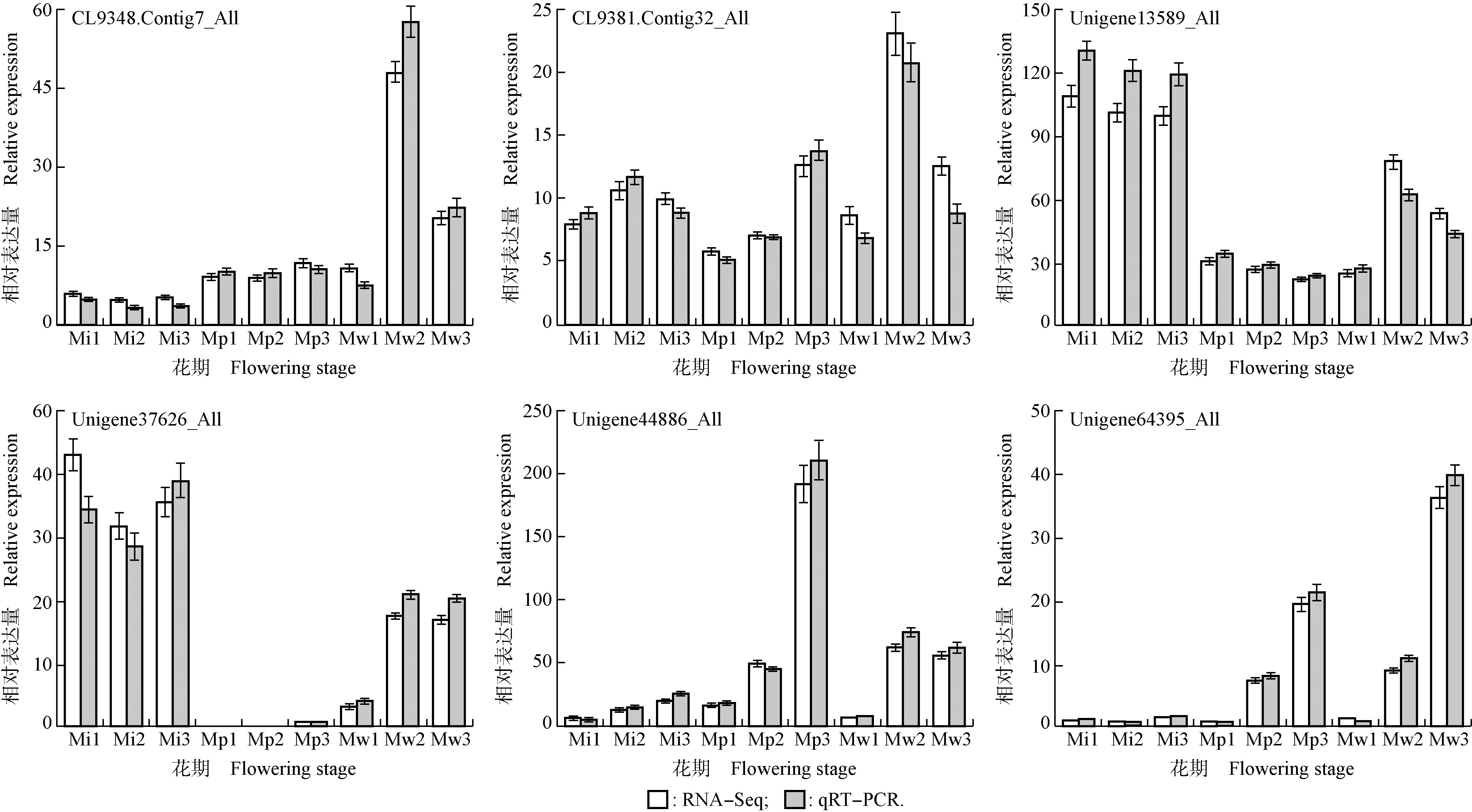
Mi1,Mi2,Mi3: 分别为全缘叶绿绒蒿花蕾期、开裂期和盛开期Bud stage, cracking stage, and blooming stage of M. integrifolia (Maxim.) Franch., respectively; Mp1,Mp2,Mp3: 分别为红花绿绒蒿花蕾期、开裂期和盛开期Bud stage, cracking stage, and blooming stage of M. punicea Maxim., respectively; Mw1,Mw2,Mw3: 分别为川滇绿绒蒿花蕾期、开裂期和盛开期Bud stage, cracking stage, and blooming stage of M. wilsonii Grey-Wilson, respectively.
3 讨论和结论
花瓣中的金属离子含量对开花过程花瓣呈色有十分重要的影响,是影响花色的主要因子之一。盛开期,全缘叶绿绒蒿花瓣中Fe3+、Mg2+、Ca2+、K+、Mn2+、Cu2+和Zn2+7种金属离子含量均显著(P<0.05)高于红花绿绒蒿和川滇绿绒蒿;红花绿绒蒿花瓣中Fe3+、Zn2+、Mn2+、Mg2+和K+含量显著低于川滇绿绒蒿,Cu2+和Ca2+含量显著高于川滇绿绒蒿。菊花(ChrysanthemummorifoliumRamat.)花色形成的表型研究结果表明:Fe3+、Mg2+、Al3+和Ca2+与菊花红色品种花瓣中的花青素共同作用对花瓣起到增色作用;而菊花白色品种花瓣中以黄酮类化合物为主,这4种金属离子对其花瓣颜色无明显影响[17]。本研究中,盛开期全缘叶绿绒蒿花瓣Fe3+和Mg2+含量显著高于红花绿绒蒿和川滇绿绒蒿,且其花瓣富含黄酮类化合物[18],并在Fe3+与Fe2+相关GO富集条目存在明显表达的差异unigene数量在供试绿绒蒿属3种植物中最多,在Mg2+相关GO富集条目中明显表达的差异unigene数量也较多,推测其花瓣中富含的Fe3+和Mg2+与黄酮类化合物未共同作用,进而没有对花瓣起增色作用,说明Fe3+和Mg2+并非黄色花形成的主要原因。红花绿绒蒿花瓣中明显表达的差异unigene数量在亚铁结合和镁离子结合条目中较多,推测其花瓣中Fe2+和Mg2+与花青素共同作用对花瓣有增色作用,使其花瓣在开花过程中呈红色,并且红花绿绒蒿富集于亚铁螯合酶活性和镁螯合酶活性条目的差异unigene存在明显表达,可能Fe2+和Mg2+在花瓣中的螯合作用也影响其花色形成。对川滇绿绒蒿在Fe3+、Fe2+和Mg2+相关GO富集条目所富集的差异unigene整体分析,发现除三价铁结合条目外,川滇绿绒蒿花瓣中明显表达的差异unigene数量在供试绿绒蒿属3种植物中最少,镁离子结合条目上明显表达的差异unigene数量相对较多,如CL9348.Contig7_All、Unigene302777_All和Unigene332283_All,且这3个差异unigene的相对表达量均呈现先升高后降低的趋势,与该种花瓣蓝紫色程度在开花过程先加深后变浅相吻合。已有研究结果表明:川滇绿绒蒿花瓣中矢车菊素可与Fe3+形成蓝色复合物[19],而在大花绿绒蒿的蓝色花瓣中影响花色形成的新型金属复合体色素是由Fe3+、Mg2+与黄酮醇、矢车菊素衍生物结合形成[13],由此分析川滇绿绒蒿花瓣呈蓝紫色可能与Fe3+、Mg2+形成了金属复合物有一定的联系。
花色研究结果显示:白及〔Bletillastriata(Thunb. ex Murray) Rchb. f.〕花瓣中总花青素含量与Zn2+含量呈显著正相关关系,而与Mn2+含量则呈显著负相关关系[20]。虽然全缘叶绿绒蒿花瓣中Mn2+和Zn2+含量最高,但Mn2+和Zn2+相关GO富集条目(对锌离子的反应条目除外)存在明显表达的差异unigene数量在供试绿绒蒿属3种植物中最少,分析该植物花瓣中Zn2+和Mn2+相关unigene的不明显表达可能影响了Zn2+和Mn2+对花色的作用,这2种金属离子可能与全缘叶绿绒蒿花色无关;虽然红花绿绒蒿花瓣中Zn2+和Mn2+相关GO富集条目中明显表达的差异unigene较多,但其花瓣中Zn2+和Mn2+含量最低,推测红花绿绒蒿花瓣中花青素的形成与Mn2+有一定联系;川滇绿绒蒿花瓣中锌离子结合条目中存在明显表达的差异unigene,但是对锌离子的反应条目仅Unigene335547_All明显表达,而Mn2+相关GO富集条目中明显表达的差异unigene数量在供试绿绒蒿属3种植物中最多,推测与Zn2+相比较其花瓣颜色更受Mn2+影响。
有关‘芙蓉李’(Prunussalicina‘Furong’)花色苷稳定性的研究结果表明:高含量K+有助于花色苷构型稳固[21]。高赛等[22]研究了长春花〔Catharanthusroseus(Linn.) G. Don〕的花色,认为随着Ca2+含量的升高,花瓣的亮度逐渐升高,而红度降低,花色呈现变浅的趋势。赵雨朦等[23]通过水培试验测定不同Zn2+和Cu2+含量下翅碱蓬〔Suaedasalsa(Linn.) Pall.〕的花青素和叶绿素含量,认为低含量Zn2+和Cu2+能够促进翅碱蓬花青素和叶绿素的合成及植株生长。李慧波[24]认为,大量Ca2+和Mg2+与花色素(矢车菊素与飞燕草素的含量比为10∶1)形成的螯合物可能是紫露草(TradescantiaohiensisRaf.)花瓣呈蓝紫色的主要原因。全缘叶绿绒蒿花瓣中Ca2+含量最高,Ca2+相关GO富集条目中钙离子结合和细胞钙离子稳态条目存在的明显表达差异unigene数量仅次于红花绿绒蒿,螯合钙离子释放到细胞溶质条目中仅全缘叶绿绒蒿花瓣中的差异unigene明显表达;该种类花瓣在Cu2+相关GO富集条目存在明显表达的差异unigene数量在供试绿绒蒿属3种植物中最多,其中铜离子结合条目中明显表达的差异unigene主要呈逐渐升高的趋势,与开花过程中黄色花瓣颜色的加深相对应。结合高赛等[22]的研究结果,全缘叶绿绒蒿花瓣中Ca2+含量最高,其花瓣呈亮度较高的黄色,推测其花色形成与花瓣中Ca2+含量相关,全缘叶绿绒蒿花瓣颜色可能受Cu2+和Ca2+及相关GO富集条目中差异unigene明显表达的影响。红花绿绒蒿花瓣在钙离子结合条目中明显表达的差异unigene数量在供试绿绒蒿属3种植物中最多,但螯合钙离子释放到细胞溶质条目中无明显表达的差异unigene;其花瓣中Ca2+含量仅次于全缘叶绿绒蒿,但其花瓣呈鲜艳的红色,推测花瓣中Ca2+与其花色形成无关;K+相关GO富集条目中,红花绿绒蒿花瓣明显表达的差异unigene数量除钾离子稳态条目仅次于全缘叶绿绒蒿外,其余条目均为最高;而该花瓣在铜离子结合条目有较多数量明显表达的差异unigene,铜离子转运条目中2个差异unigene也存在表达,这些unigene相对表达量总体在开花过程中随花期表现为持续降低,与花瓣的红色程度在开花过程中变浅相吻合,由此推测红花绿绒蒿的花色形成与K+和Cu2+相关差异unigene的表达有密切联系。川滇绿绒蒿花瓣中Ca2+含量最低,且其螯合钙离子释放到细胞溶质条目中无明显表达的差异unigene,结合李慧波[24]的研究结果,分析该花瓣呈蓝紫色未受到Ca2+影响;川滇绿绒蒿花瓣在K+相关GO富集条目上明显表达的差异unigene数量在供试绿绒蒿属3种植物中均最少,故推测K+不是影响蓝紫色花形成的关键金属离子;该植物花瓣在铜离子结合条目中存在较多明显表达的差异unigene,且其相对表达量总体在开花过程中呈先升高后降低的趋势,与川滇绿绒蒿蓝紫色花瓣在开花过程中呈先加深后变浅的变化相对应,而在供试绿绒蒿属3种植物中川滇绿绒蒿花瓣中Cu2+含量最低,低含量Cu2+又会促进花青素的合成,由此推测蓝紫色花的形成与低含量的Cu2+及其相关差异unigene的表达有关。
绿绒蒿属不同种类开花过程中的花色存在明显差异,本研究从生理和分子2个方面联合探究了7种金属离子与花瓣呈色的关系,认为各金属离子及其相关的差异unigene对花色的形成具有不同程度的调控,尤其是Fe3+和Mg2+。目前对花色在分子层面的研究已经越来越受到重视,但更多的还是停留于KEGG通路及相关花色素合成的基因,金属离子方面还存在大量空白,需要进一步探究,进而为花色调控机制提供更全面的理论依据,推进植物花色调控的研究进程。
