术前玻璃体腔注射康柏西普联合25G+玻璃体切割术治疗增殖性糖尿病视网膜病变
2023-09-27韩彦辉孟繁超于广委王东林
韩彦辉,赵 楠,孟繁超,于广委,王东林
目的:探讨术前玻璃体腔注射康柏西普联合25G+玻璃体切割术(PPV)治疗增殖性糖尿病视网膜(PDR)病变的疗效。
方法:回顾性分析。收集2019-01/2021-06我院收治的PDR患者154例176眼临床资料。根据治疗方法分为联合治疗组80例92眼采用术前玻璃体腔注射康柏西普联合25G+PPV治疗,对照组74例84眼仅采用25G+PPV治疗。比较两组患者治疗后临床疗效,手术前后血清脂肪因子[脂联素(APN)、视黄醇结合蛋白4(RBP4)]水平。
结果:术后1mo联合治疗组临床疗效优于对照组(P<0.05)。术后3mo,两组RBP4水平低于术前(P<0.05),且联合治疗组术后低于对照组(P<0.05);两组血清APN显著高于术前(P<0.05),联合治疗组高于对照组(P<0.05)。随访3mo,联合治疗组视网膜增殖、术后并发症发生率低于对照组(P<0.05)。
结论:术前玻璃体腔注射康柏西普联合25G+PPV有利于提高PDR治疗效果,降低并发症发生率,可能与调控脂肪因子的表达有关。
•KEYWORDS:proliferative diabetic retinopathy; 25G+ pars plana vitrectomy; Conbercept; adiponectin; retinol binding protein 4
0 引言
糖尿病是临床常见代谢性疾病之一,近年来糖尿病发病率不断提高,糖尿病相关并发症患病人数也随之增多。据相关资料显示,约有23%患者会发展为增殖性糖尿病视网膜(proliferative diabetic retinopathy,PDR)[1],PDR发生主要与波动性高糖诱发的细胞自噬、细胞凋亡、氧化应激、血管内皮生长因子(vascular endothelial growth factor,VEGF)大量释放等有关,这些过程均可造成视网膜组织炎症反应、DNA损伤等,促进疾病进展。玻璃体切割术(pars plana vitrectomy,PPV)是治疗复杂性PDR的有效手段,但PPV后仍有一定比例患者发生玻璃体积血、牵拉性视网膜脱离和新生血管性青光眼等并发症[2]。VEGF是PDR患者视网膜新生血管发生和血-视网膜屏障破坏的重要细胞因子[3],因此目前部分学者主张应用抗VEGF药物联合手术治疗PDR,以减少视网膜新生血管渗漏和使新生血管消退。25G+PPV较其他手术系统具有降低医源性损伤和并发症发生率等优势,而康柏西普是新型有效抗VEGF药物,故本研究将25G+PPV和康柏西普联用,以寻求理想PDR治疗方案。此外,近年研究发现,脂肪因子可能参与PDR发生机制[4]。因此本研究分析154例PDR患者临床资料,以探究25G+PPV联合抗VEGF药物治疗PDR病变的疗效及对脂肪因子的影响,为该联合治疗方案的应用价值及可能的作用机制提供参考数据,现报告如下。
1 对象和方法
1.1对象回顾性分析。收集2019-01/2021-06我院收治的PDR患者154例176眼临床资料。根据治疗方法分为联合治疗组80例92眼采用术前玻璃体腔注射康柏西普联合25G+PPV治疗,对照组74例84眼仅采用25G+PPV治疗。纳入标准:(1)符合《我国糖尿病视网膜病变临床诊疗指南(2014年版)》[5]中PDR诊断标准,且均经裂隙灯显微镜、眼部B超、FFA、OCT和超声生物显微镜等检查诊断明确;(2)Ⅴ、Ⅵ期PDR患者;(3)糖尿病病史5a以上者;(4)临床资料完整。排除标准:(1)严重器官功能不全或合并其他系统疾病;(2)患有青光眼、白内障等其他眼部疾病患者;(3)既往激光及眼部手术史者;(4)1a内行其他药物玻璃体腔注射者。本研究经我院伦理委员会审批,所有患者均知情同意。
1.2方法玻璃体腔注药前5d术眼予以左氧氟沙星滴眼液每天4次,严格无菌操作常规消毒术前准备,使用盐酸奥布卡因滴眼液眼表局部麻醉,生理盐水冲洗结膜囊,于角膜缘后3~4mm处睫状体平坦部注射康柏西普0.05mL/0.5mg;注射完毕后用无菌棉签轻压穿刺口,涂妥布霉素地塞米松眼膏,再用无菌纱布遮盖术眼,术后继续使用左氧氟沙星滴眼液每天4次;玻璃体腔注药后5d行25G+PPV。25G+PPV[6]治疗方法:术前使用复方托吡卡胺滴眼液散瞳,常规术前准备,2%利多卡因和75%布比卡因混合液局部注射麻醉,采用25G+套管穿刺刀系统做常规玻璃体切割三切口,穿刺刀斜行巩膜穿刺入玻璃体腔内,开启玻璃体切割机,去除中央区玻璃体和血性玻璃体液,注射曲安奈德0.1mL后切除玻璃体厚皮质;从视网膜表面仔细剥离新生血管膜及纤维膜;若发生医源性视网膜裂孔,在裂孔周围行激光光凝术封闭裂孔,联合组术中有6眼出现医源性视网膜裂孔,对照组有14眼出现医源性视网膜裂孔,根据术中情况选择填充硅油或气体;术后封闭3个穿刺口,眼表结膜囊内涂妥布霉素地塞米松眼膏;术后1mo使用妥布霉地塞米松滴眼液和左氧氟沙星滴眼液,每天4次。
疗效标准[7]:两组患者均于术后1mo评估疗效,根据视力及眼底荧光血管造影变化情况判定,分为显效(视力提高≥2行以上,或视力达到5.0,眼底荧光造影示新生血管基本消失及黄斑水肿明显减轻)、有效(视力提高≥1行及无明显变化,新生血管明显减少及黄斑水肿减轻)、无效(视力下降,新生血管及黄斑水肿不变或加重),总有效率=(显效眼数+有效眼数)/总眼数×100%。
比较两组患者手术时间、术中出血、医源性视网膜裂孔、硅油填充情况。术前、术后3mo,使用国际标准视力表测定两组患者最佳矫正视力(BCVA),使用光学相干断层扫描检查测定黄斑中心凹厚度,采集患者外周静脉血,使用酶联免疫法测定血清VEGF、胰岛素样生长因子(insulin like growth factor 1,IGF-1)、白介素-19(interleukin-19,IL-19)、脂联素(adiponectin, APN)水平变化,采用双抗体夹心法检测视黄醇结合蛋白4(retinol binding protein 4, RBP4)。统计随访3mo视网膜增殖程度及并发症发生率。

2 结果
2.1两组患者术前一般资料比较两组患者术前一般资料比较差异均无统计学意义(P<0.05),见表1。
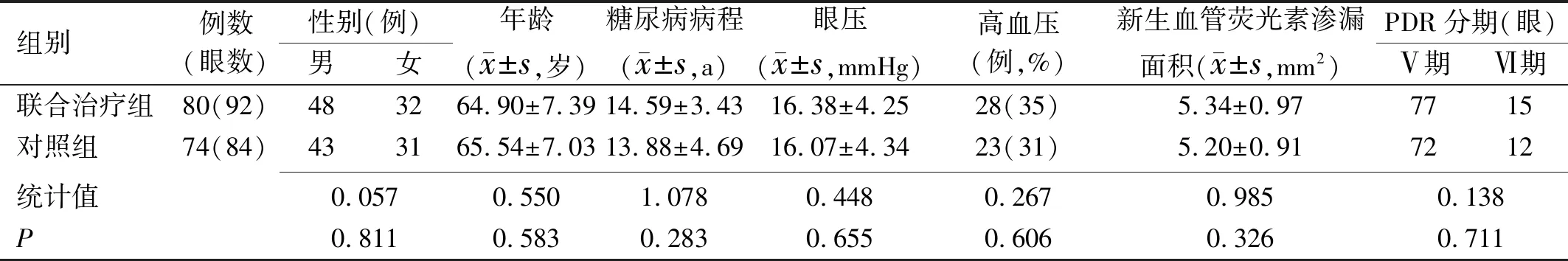
表1 两组患者术前一般资料比较
2.2两组患者手术时间和术中情况比较联合治疗组手术时间低于对照组(P<0.05),术中出血、医源性视网膜裂孔、硅油填充比例均低于对照组(P<0.05),见表2。
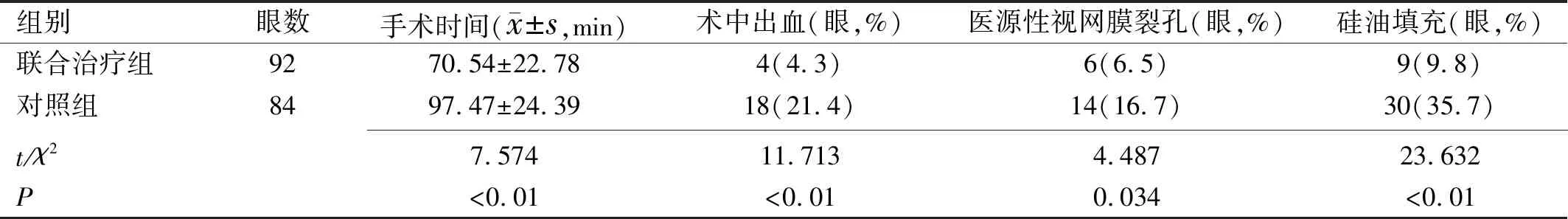
表2 两组患者手术时间和术中情况比较
2.3两组患者手术前后BCVA和黄斑中心凹厚度比较术后3mo,两组患者BCVA、黄斑中心凹厚度均显著低于术前,差异均有统计学意义(P<0.01),且术后联合治疗组显著低于对照组,差异均有统计学意义(P<0.01),见表3。

表3 两组患者手术前后BCVA和黄斑中心凹厚度比较
2.4两组患者手术前后血清VEGF和IGF-1及IL-19水平比较两组患者术后3mo血清VEGF、IGF-1及IL-19水平均显著低于术前,差异均有统计学意义(t联合治疗组=41.946、17.736、58.012,t对照组=29.375、10.344、25.282,均P<0.01),且联合治疗组显著低于对照组,差异均有统计学意义(P<0.01),见表4。

表4 两组患者手术前后血清VEGF和IGF-1及IL-19水平比较
2.5两组患者手术前后血清APN和RBP4比较两组患者术后3mo血清APN显著高于术前,RBP4显著低于术前,差异均有统计学意义(P<0.01),联合治疗组血清APN高于对照组,RBP4低于对照组,差异均有统计学意义(P<0.01),见表5。

表5 两组患者手术前后血清APN和RBP4比较
2.6两组患者临床疗效比较术后1mo时,联合治疗组治疗总有效率显著高于对照组,差异有统计学意义(χ2=5.947,P=0.015),见表6。
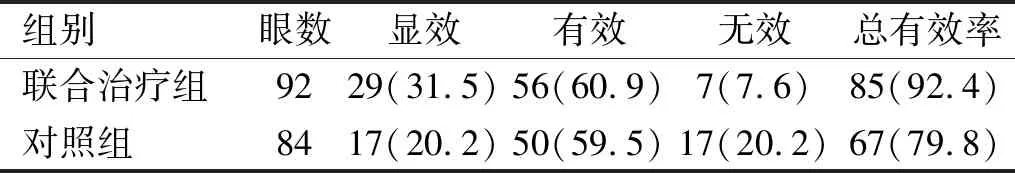
表6 两组患者临床疗效比较 眼(%)
2.7两组患者术后视网膜增殖及并发症比较术后随访3mo,联合治疗组12眼出现视网膜增殖,对照组25眼出现视网膜增殖,联合治疗组视网膜增殖发生率低于对照组,差异有统计学意义(χ2=7.392,P=0.007);联合治疗组术后玻璃体出血2眼、对照组玻璃体出血12眼,联合治疗组术后并发症发生率低于对照组,差异有统计学意义(χ2=8.797,P=0.003)。
3 讨论
PPV是目前治疗PDR的首选术式,主要通过清除玻璃体积血、解除玻璃体视网膜黏连、牵拉、剥除机化膜以及封闭相关裂孔缓解患者视网膜缺血,恢复患者视力[8]。目前PPV使用的手术系统中25G系统过于纤细柔软,在处理周边玻璃体视网膜中受限,而25G+手术系统应用于PPV中较23G医源性损伤及并发症发生率风险更低,但术中仍有一定比例患者出现医源性视网膜裂孔、出血等[9-11]。有文献指出VEGF高表达是视网膜病变形成的主要原因,缺血缺氧及糖基化终末产物生成增多等因素均会引起VEGF分泌过多,VEGF高表达可使视网膜新生血管形成和血-视网膜屏障破坏[12]。而新生血管出血影响PPV术野清晰度,且不利于术中分离剥除纤维增殖膜[13],因此本研究考虑康柏西普联合PPV手术治疗,以期降低手术难度。
本研究结果显示,联合治疗组临床疗效优于对照组,手术时间短于对照组,术中出血、医源性视网膜裂孔和硅油填充比例也低于对照组,提示康柏西普联合25G+PPV手术在围术期安全性和疗效方面均较单独手术更具有优势,与目前的报道一致[7]。PPV手术可直接有效地去除玻璃体积血,解除玻璃体视网膜牵拉,剥离新生血管增殖膜,封闭视网膜裂孔,使患者术后不同程度低提高或保留视力[14]。但由于术中需剥除与视网膜黏连紧密的纤维增殖膜,因此剥离过程中具有一定医源性视网膜裂孔发生风险。康柏西普是一种新型抗VEGF药物,与VEGF-A、VEGF-B及胎盘生长因子(PIGF)均能结合且亲和性良好,抗VEGF效果较雷珠单抗更优[15-16]。康柏西普通过与VEGF竞争性结合,达到阻断眼底部异常增殖新生毛细血管的目的[17-18]。在PPV术前应用康柏西普,能抑制新生血管生长、促使新生血管消退,可以减少术中出血及更换器械止血频率,缩短手术时间[19];新生血管纤维膜生长明显,新生血管消退,降低医源性视网膜裂孔发生率[20]。术后随访中数据也指出,联合治疗组视网膜增殖程度和并发症发生率低于对照组,也进一步表明该联合疗法具有良好疗效及安全性。
PDR的发生发展与炎症反应密切相关[21]。有研究指出,炎症可促进炎症细胞增殖,致使IGF-1分泌增加,从而加速内皮细胞增殖、促进新生血管生成[22]。近年报道认为,IL-19也与PDR关系密切[23],有研究证实,IL-19可诱导单核细胞产生IL-6、CRP等炎症因子,促进细胞凋亡[24];还可直接对血管细胞发挥作用,通过诱导及刺激巨噬细胞,促进VEGF血管新生因子分泌,加重视神经组织损伤[25]。本研究发现,术后3mo,联合治疗组患者BCVA、黄斑中心凹厚度及血清VEGF、IGF-1及IL-19水平均优于对照组。考虑其原因为:康柏西普注射直接给药于玻璃体腔内,克服了血-眼屏障,眼内较高的血药浓度能较大限度地提高临床疗效,降低患者VEGF、IGF-1及IL-19指标水平,延缓新生血管生长[26]。糖尿病患者高血糖状态能使患者血管-视网膜屏障受损,改变眼部局部血流动力学,最终导致视网膜微循环障碍。而康柏西普能优化眼部血流动力、提高血管微循环,有助于患者整体病情改善[27],这也与增强自身对渗出物质的吸收、降低炎症反应有关。APN可抑制肝脏糖异生及肝糖原输出,促进肝脏对葡萄糖直接磷酸化,低水平APN可加速2型糖尿病及其微血管并发症的发生[28];RBP4作为新发现的脂肪因子,主要由肝脏合成,与2型糖尿病及胰岛素抵抗有关,可介导视黄醇转运,影响视网膜结构及功能,参与PDR的发生[29-30]。本研究中,两组术后3mo血清APN显著高于术前,RBP4显著低于术前,而术后联合治疗组指标优于对照组,提示康柏西普联合25G+PPV手术可能还对调控脂肪因子的表达有利,可能是其疗效显著的原因之一。然而,本研究作为单中心小样本量研究,不具有代表性,研究结论还需后续大样本量多中心研究的证实。另外,目前抗VEGF药物与眼科手术的报道均以调控炎症因子或VEGF的表达有关,关于二者联合治疗使脂肪因子下调的具体机制尚未得知。我们通过PubMed数据库、知网数据库查阅文献,未发现康柏西普及(或)25G+PPV手术对脂肪因子调节作用的相关报道,其具体作用机制仍待后续研究的论证。
综上所述,25G+PPV切割术联合抗VEGF药物治疗PDR效果良好,有利于改善围术期状况,降低术后视网膜增殖、并发症风险,并在调节VEGF、IGF-1、IL-19及脂肪因子RBP4、APN指标方面发挥积极作用。
