sua-CMS烟草不育系COXⅡ的功能分析
2023-09-27望锦刘艳芳刘文文王雅琦宋时洋张幸子李凤霞
望锦,刘艳芳,刘文文,王雅琦,宋时洋,张幸子,李凤霞
-CMS烟草不育系的功能分析

1中国农业科学院烟草研究所,山东青岛 266100;2中国农业科学院研究生院,北京 100081;3中国科学院青岛生物能源与过程研究所,山东青岛 266100
【目的】细胞质雄性不育由细胞质基因组(主要是线粒体基因组)控制,在杂交种的育种和生产中起重要作用。长期以来,我国烟草种植以不育系和杂交种为主,其面积占烟草总种植面积的80%以上,不育类型均为-CMS,但该不育类型的控制基因、不育机制尚不清楚。COXⅡ是细胞色素氧化酶(COX)的第二亚基,由线粒体基因组编码。在-CMS烟草不育系中,末端发生多个碱基变异,导致C端编码蛋白Thr257被Ser取代。研究-CMS烟草功能,为阐明-CMS烟草不育分子机制奠定基础。【方法】以4组-CMS不育系和可育对照为材料,RNA印迹杂交和qRT-PCR方法分析在-CMS不育系和可育对照之间的转录本、基因表达差异,western杂交、COX酶活性试验分析COX蛋白表达和COX酶活性,并测定ATP含量;将可育烟草的在-CMS不育系中过表达,研究过表达对表达量、COX酶活性、ATP含量以及烟草雄蕊发育的影响。【结果】通过对COXⅡ多序列比对,发现C端Thr257在物种间高度保守,表达分析显示不育系中转录本显著低于可育对照,在不育系烟草中的表达量只有对照的0.3%—0.4%,COX蛋白表达量和COX酶活性均显著低于可育对照,ATP含量为可育对照的52%。将可育烟草在不育系烟草中过表达,转基因植株在花芽中的表达量最高提高171倍,COX酶活性提高70%,ATP含量提高90%,但转基因植株在花药中的表达量、COX酶活性和ATP含量等各项指标均低于可育对照。转基因植株的花药形态发生了明显的改变,并出现了花药壁的分化,但花药内无胞母细胞分化,最终也无花粉粒产生。【结论】-CMS烟草不育系变异影响COX功能,是其花药能量缺陷的重要原因,也是影响花药发育的一个重要因素。
烟草;-CMS;;功能鉴定
0 引言
【研究意义】植物细胞质雄性不育(cytoplasmic male sterility,CMS)是指高等植物不能产生或释放功能性花粉,而雌性生殖正常的一种母系遗传性状[1]。细胞质雄性不育系是作物利用杂种优势的重要遗传工具,在水稻、棉花、油菜、洋葱、向日葵、普通豆类、烟草和胡萝卜等作物的杂交育种中都有广泛使用[2]。烟草是我国重要的经济作物,近十年来,雄性不育烟草及由烟草雄性不育系制成的杂交种的种植面积占我国烟草总种植面积的80%以上,不育类型均为-CMS,但雄性不育的控制基因以及作用机制尚不清楚。【前人研究进展】植物细胞质雄性不育通常与线粒体基因组的变异相关,线粒体基因变异导致核基因组和线粒体基因组的不协调、不相容性,进而导致花粉发育受阻,不能产生有功能的花粉[3]。在植物中,线粒体基因组编码约30种蛋白质,包括呼吸链复合体Ⅰ—Ⅴ的部分亚基以及核糖体成分的组装因子,线粒体编码基因的表达改变可能引起相应复合体的功能受损进而影响花粉发育,例如,在高粱、水稻的细胞质雄性不育系中,线粒体ATP合酶的亚基6(atp6)转录本降低与雄性不育有关[4-5],当育性恢复后atp6转录本增加[6-7]。小麦atp9第37碱基的RNA编辑产生了终止密码子,是小麦CMS的主要原因[8],将小麦未编辑的转化烟草引起烟草的雄性不育[9]。CMS-S玉米中通过抑制atp9的表达导致CMS[10]。在水稻CMS系Ying Xiang A中,非功能性atp9亚基使atp9转录本下降[11]。G型雄性不育野生甜菜的COX2亚基截短的C端,细胞色素c氧化酶活性降低50%[12]。Nad7的缺失导致复合物Ⅰ和呼吸缺陷的损害[13]。呼吸链复合体Ⅳ(细胞色素c氧化酶复合体,COX),是线粒体电子传递链的终端电子受体,负责将电子从细胞色素c传递到分子氧。COX是电子传递链氧化磷酸化中的限速酶,在能量代谢和其他相关过程中起重要作用[14-15]。COX由13个亚基组成,其中最大的和疏水性最强的3个亚基Ⅰ—Ⅲ为核心亚基,由线粒体DNA编码[16-17],另外10个亚基由核基因编码。细胞色素c氧化酶亚基Ⅱ(COXⅡ)是线粒体DNA编码的COX核心亚基,含有双核心CuA活性位点,也是细胞色素c结合部位。作为COX的重要亚基,COXⅡ不仅参与电子转移和能量产生,还参与动物各组织的细胞凋亡病理过程[18-19],并影响ROS的产生[20-21]。肿瘤坏死因子受体相关蛋白1(TRAP1)在缺氧心肌细胞中发挥保护作用,过表达阻止了由沉默引起的促凋亡作用,敲低能降低过表达诱导的抗凋亡功能[22],RNAi敲除玉米粒蝇具有致死性[23]。的碱基突变与人类多种疾病表型相关,例如MELAS[24]、Alpers-Huttenlocher样疾病[25]、骨髓增生异常综合征[26]、严重乳酸酸中毒[27]、的错义突变与家族性腺瘤性息肉病(familial adenomatous polyposis,FAP)有极显著的相关性[28]。在多个烟草不育系和保持系中克隆,核苷酸序列比对发现不育系中均有C770G、G772A、G773C的变异[29-30]。由于线粒体基因组存在大量的RNA编辑,郑业强[31]进一步分析了在不育系和可育烟草中RNA编辑特点,发现在这三个位置没有发生RNA编辑。因此,不育系中的碱基变异是错义突变,导致氨基酸序列Thr257转换为Ser、Gly258转换为Thr。【本研究切入点】烟草不育系中的碱基变异功能尚未研究,是否是影响雄蕊发育的一个原因,尚不清楚,而且在植物发育中的功能未有报道。【拟解决的关键问题】本研究首先分析了变异位点的保守性,接着通过基因表达分析、蛋白表达以及生理生化分析等方法比较了不育系和可育对照中的表达特征、COX蛋白表达量、酶活性及ATP含量的差别,进一步在的5′端连接线粒体信号肽序列(mitochondria targeting sequence,MTS),在花药特异启动子的驱动下转化烟草不育系,鉴定在能量产生以及花药发育上的功能,为阐明-CMS烟草不育分子机制奠定基础。
1 材料与方法
1.1 试验材料
材料包括-CMS类型烟草不育系、杂交种和可育对照、亲本(表1)。将其种植在中国农业科学院烟草研究所(青岛)。

表1 sua-CMS烟草不育系和可育对照
1.2 COXⅡ蛋白序列的比对
在NCBI数据库(https://www.ncbi.nlm.nih.gov/)中下载茄科、十字花科、禾本科等植物的COXⅡ蛋白序列,利用ClustalX2软件进行蛋白质多序列比对。
1.3 烟草COXⅡ的表达分析
以烟草根、茎、叶、花芽(<2 mm)和小花蕾(2—3 mm)为材料进行表达分析。烟草从花芽萌出至花芽1.5 mm左右时,处于雄蕊原基分化到花药分化的时期,当花蕾2—3 mm时,分化出完整花药并进入四分孢子时期[32]。-CMS表现为柱头状花药,无药室结构的分化,败育发生在花药发育早期,因此,本研究重点关注对雄蕊早期发育的影响,分花芽和小花蕾2个阶段进行。
使用Trizol试剂盒(Vazyme生物科技股份有限公司,中国南京)提取烟草各器官和花蕾发育不同时期的RNA,并用DNaseⅠ酶消化DNA。用引物N-COXⅡ、N-Actin分别扩增(GenBank:ALD61757.1)全长、特异性DNA片段作为探针(表2),采用DIG标记试剂盒(罗氏制药有限公司,中国上海)对探针进行标记并检测探针效率。制备MOPS甲醛凝胶,将3 μg RNA加入2倍体积的上样缓冲液65 ℃变性后上样,电泳2—3 h。之后利用虹吸法将RNA转移至Hybond N+上,紫外交联并烤膜。采用Northern blot试剂盒(罗氏制药有限公司,中国上海)进行预杂交、杂交、洗膜并进行免疫检测,再加入CDP-Star显色剂显色5—30 min,成像。
定量表达分析采用荧光定量方法进行利用cDNA反转录试剂盒(Vazyme生物科技股份有限公司,中国南京)将RNA反转录合成cDNA。设计的qRT-PCR引物qCOXⅡ,以烟草作为内参基因(表2),采用2-△△CT方法计算相对表达量。

表2 本研究中的引物序列
1.4 COX的蛋白表达分析
用线粒体蛋白提取试剂盒(杰美基因医药科技有限公司,中国上海)提取MS中烟100和中烟100的花芽线粒体总蛋白,使用BCA法测蛋白浓度(Vazyme生物科技股份有限公司,中国南京)。以核编码的线粒体外膜蛋白PORIN作内参蛋白,验证不育系和可育对照中COX的蛋白表达特征。将提取的线粒体蛋白100 ℃煮沸10 min变性,用12%预制胶进行电泳,上样量为20 μg,140 V电泳1 h,转膜后在封闭缓冲液(20 mL TBST+1 g脱脂奶粉)封闭3 h,TBST洗涤3次,每次5 min,加PORIN抗体(Sigma-Aldrich,美国)或COX抗体(Agrisera公司,瑞典)于37 ℃孵育2 h,TBST洗涤3次,每次5 min,加入IRDye 800cw Goatanti Rabbit避光孵育2 h,TBST洗3次后,用化学发光系统(BIO-RAD,ChemiDoc XRS+)曝光拍照。
1.5 花蕾COX酶活性和ATP含量测定
采用线粒体复合体Ⅳ试剂盒(苏州科铭生物有限公司,中国江苏)测定COX酶活性,其基本原理是还原型细胞色素c在550 nm有特征光吸收,COX催化还原型细胞色素c生成氧化型细胞色素c,因此,550 nm光吸收下降速率能够反映COX酶活性。
使用ATP测定试剂盒(苏州科铭生物有限公司,中国江苏)测定花芽、小花蕾的ATP含量。
以上试验,每个材料均取3个样品进行生物学重复。
1.6 COXⅡ过表达载体构建和遗传转化
在烟草中克隆线粒体靶向信号肽序列()、、花药特异表达基因(GenBank:NC_ 003074.8)启动子,、的上下游序列分别添加相应的同源片段(表2)。首先通过同源重组的方式先将与连接,胶回收后,再通过同源重组与启动子连接,构建-基因盒。利用RⅠ和Ⅰ内切酶对植物表达载体pCHF3进行双酶切后,胶回收片段与-片段同源重组进行连接,随后对所得克隆载体进行测序,以确保表达载体的完整、正确。再将表达载体冻融法转化到农杆菌LBA4404中,通过农杆菌介导的叶盘法将-基因盒转化到不育系MS中烟100中。
1.7 烟草转基因植株的筛选及COXⅡ表达模式分析
提取转基因烟草叶片DNA,以AP3-F和载体P-R引物,以含-基因质粒为阳性对照,非转基因植株DNA作为阴性对照进行PCR扩增。
采用上述RNA提取试剂盒提取转基因烟草花芽RNA,反转后以cDNA为模板,q为特异引物进行qRT-PCR反应,检测转基因烟草的表达量。
1.8 转基因烟草花药发育和花粉活性分析
取MS中烟100和过表达植株OE-4的花芽、小花蕾,FAA固定后,乙醇分步脱水,用石蜡进行包埋,切片厚度为5 μm,二甲苯脱蜡,苏木精染色,显微镜观察(Nicon,80i)、拍照。
采用胺蓝染色方法测定花粉粒活性[33]。剥开即将开放的花蕾,将花药放在载玻片上,用锋利的刀片切开花药释放花药内容物,在花粉粒中滴2—3滴荧光素二乙酸酯(fluorescein diacetate,FDA)溶液,黑暗孵育5 min,在显微镜下(Nicon,80i)观察花粉状态。
2 结果
2.1 COXⅡ的蛋白序列比对
COXⅡ是真核生物线粒体编码的细胞色素c氧化酶的氧化-还原中心。COXⅡ通过2个半胱氨酸(Cys)和1个组氨酸(His)残基还有另外一个氮原子与细胞色素c的Cu相连,是细胞色素c结合部位。运用ClustalX2对烟草不育系-COXⅡ(ALD61757.1)与普通烟草(BAD83476.2)、林烟草(YP_009241435.1)、马铃薯(QEQ76338.1)、拟南芥(YP_009472098.2)、油菜(YP_717172.1)、水稻(YP_002000571.1)、小麦(YP_009433727.1)、玉米(XP_035818464.1)和陆地棉(AFZ85273.1)进行氨基酸序列比对(图1)。结果表明,257位的Thr在所比对的可育植物中高度保守,均为Thr,而不育系中该位点为Ser。

图1 COXⅡ多序列比对
2.2 COXⅡ的表达分析
以全长为探针,地高辛标记探针后,对不育系MS中烟100和中烟100的花芽RNA转膜之后的片段进行杂交,杂交结果显示,在保持系中烟100中可以看到明显的条带印迹,在不育系MS中烟100中条带要弱很多(图2-A)。
进一步对在MS中烟100-中烟100、MS云烟87-云烟87、MS中烟300-中烟300、中烟202-中烟98 4组-CMS不育烟草和可育对照之间的表达量进行定量分析。4组材料中,在-CMS烟草中的花芽、小花蕾中的表达量均很低,在花芽中表达量仅占可育对照的0.4%(图2-B),在小花蕾中表达量占可育对照的0.3%(图2-C)。
组织特异性表达显示,无论不育系还是可育系,在不同组织以及花蕾发育的不同时期有相似的表达模式,花芽中表达量高于小花蕾,而在根中表达量最低,在茎中的表达量也相对较高(图2-D)。花芽是雄蕊等生殖器官分化、旺盛生长的时期,该过程需要更多的能量,在花芽中表达量高暗示其在能量代谢中的作用。
2.3 COX蛋白表达和酶活性分析
COXⅡ是COX的一个重要亚基,为了鉴定- CMS不育系变异对COX功能的影响,分析MS中烟100和中烟100中COX的蛋白表达特征。提取花芽线粒体蛋白,当不育系和保持系定量蛋白量相同时,不育系中COX的蛋白水平低于可育系(图3-A)。推测不育系COX低表达可能与的碱基变异有关。
通过分析MS中烟100、中烟100在花芽和小花蕾中的COX酶活性。在MS中烟100中,COX酶活性显著降低,在花芽中,MS中烟100的COX酶活性是中烟100的70%,在小花蕾中,COX酶活性是中烟100的50%(图3-B)。
花芽、小花蕾的ATP含量分析显示,MS中烟100花芽的ATP含量为中烟100的47%,小花蕾中ATP含量占中烟100的53%(图3-C)。
2.4 COXⅡ的遗传转化及阳性植株筛选
为进一步阐明在花药发育中的生物学功能,构建花药特异表达基因启动子驱动-的载体表达盒(图4-A),对烟草不育系MS中烟100进行遗传转化。克隆启动子、序列、后,两步同源重组后,融合成::-基因盒(图4-B),进一步与植物表达载体pCHF3同源重组连接,测序结果表明,载体构建正确。将pCHF3-::-转化到农杆菌LBA4404后,叶盘法侵染烟草叶片,通过卡那霉素耐药性筛选获得12株转基因植株,PCR鉴定11株含有::-片段,为转基因阳性植株。

A:COXⅡ在sua-CMS不育系和可育对照花芽中的RNA印迹杂交;B:COXⅡ在4组sua-CMS不育烟草和可育对照花芽中的定量表达;C:COXⅡ在4组sua-CMS不育烟草和可育对照小花蕾中的定量表达;D:COXⅡ在不同器官和花蕾发育不同时期的表达分析
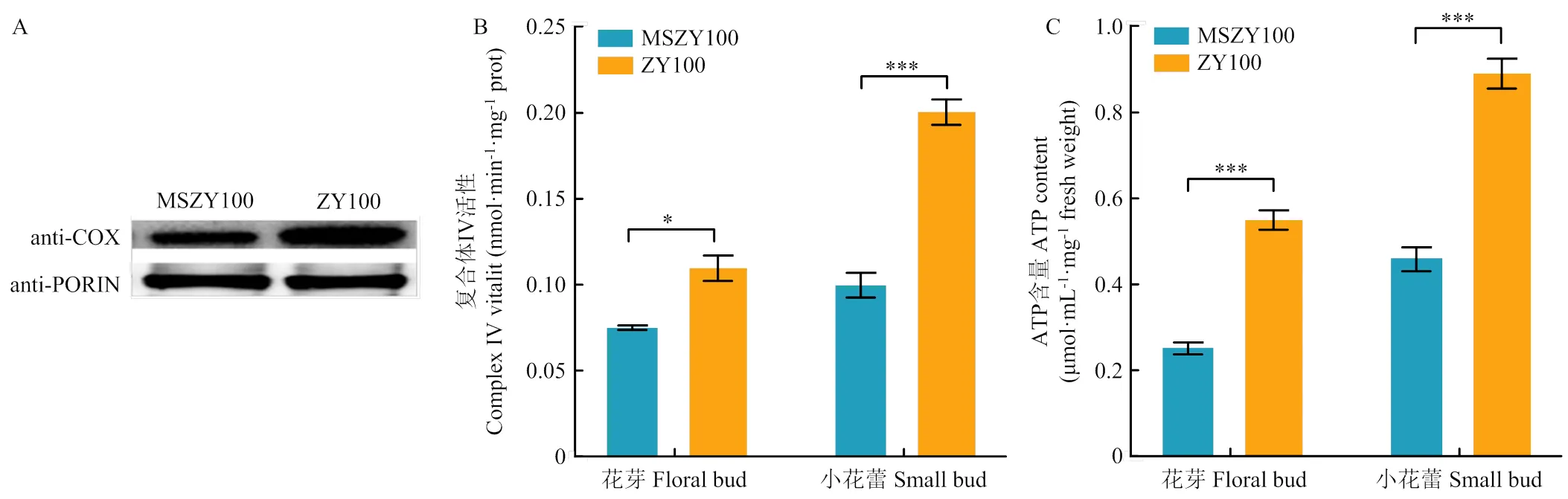
A:MS中烟100和中烟100的COX蛋白印迹分析;B:不同育性的花芽和小花蕾中复合体Ⅳ的酶活性分析;C:不同育性的花芽和小花蕾中ATP含量分析。*表示P<0.05,***表示P<0.001
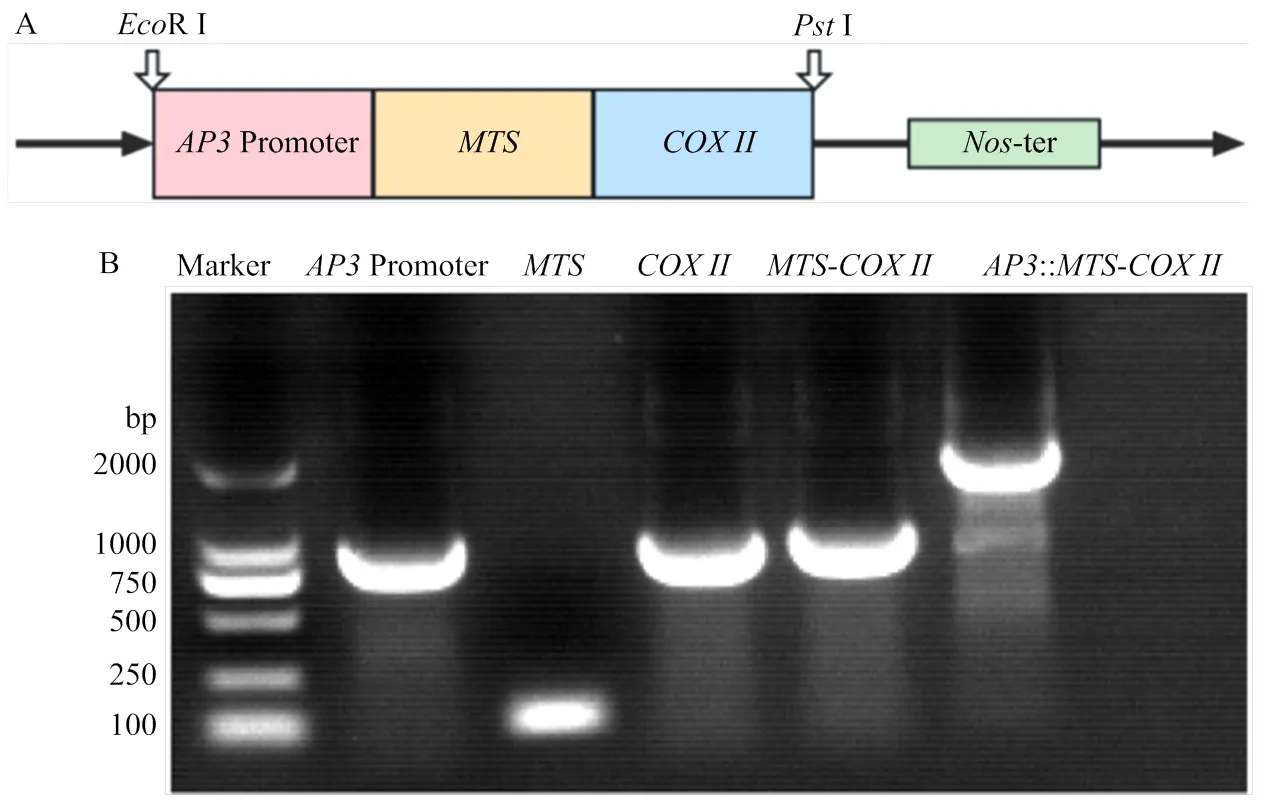
A:过表达载体示意图;B:载体构建中的片段扩增
转基因烟草qRT-PCR结果表明,11个转基因株系均能过量表达,其中,OE-3、OE-4和OE-11表达量较高,花芽中,OE-4的表达量是对照的171倍,小花蕾中,OE-4的表达量是对照的225倍(图5)。但同时也可以看出,与中烟100相比,过表达株系中的表达量仍然低于中烟100。
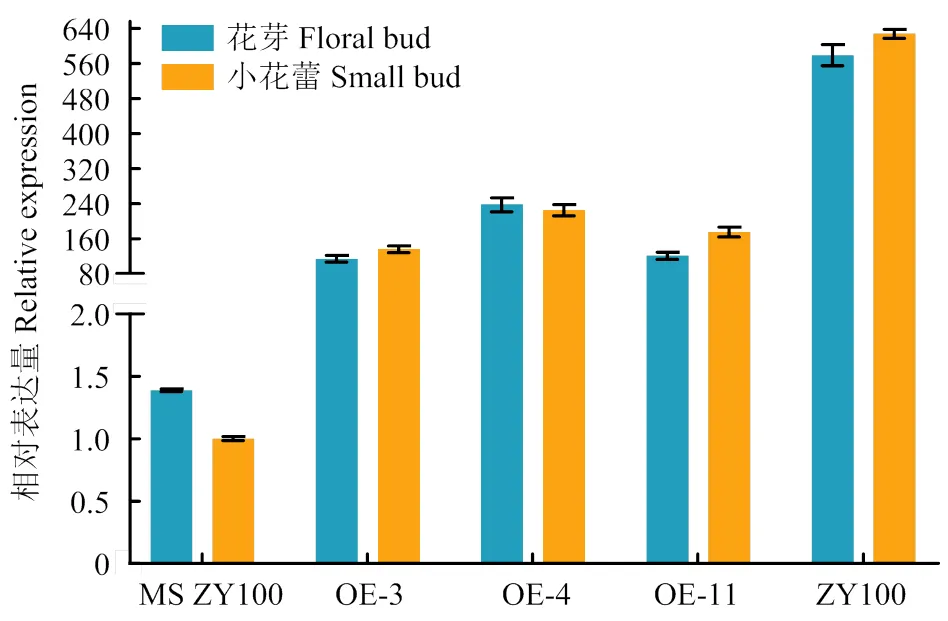
图5 转基因材料COXⅡ表达分析
2.5 转基因植株COX酶活性分析和ATP含量分析
分析转基因烟草OE-3、OE-4和OE-11花芽中COX酶活性,结果显示,转基因烟草的COX酶活性比野生型MS中烟100普遍增高,但比中烟100的COX酶活性低20%—30%(图6-A),表明在不育系中过表达,部分弥补了变异引起的COX酶活性降低。进一步分析转基因植株的ATP含量,发现花芽中ATP含量比对照显著增高,OE-4的ATP含量比MS中烟100花芽增加了90%,小花蕾增加了67%,但ATP含量比可育烟草中烟100低10%—12%(图6-B)。
2.6 转基因植株花药发育
由于是花药特异表达启动子,重点关注转基因植株的花药发育变化,野生型MS中烟100花药为柱头状或完全退化(图7-A),石蜡切片显示其无花药结构分化(图7-B),在转基因烟草中,花药形态发生了显著的变化,由柱头状变为蝴蝶状(图7-D);细胞学观察发现,OE-4花药具有明显的花药壁,但随着花的发育,其内部无进一步的分化(图7-E);FDA染色显示转基因烟草花药内容物无亮蓝色荧光,没有正常的花粉粒产生(图7-F),在可育中烟100的花药中则可观察到明显亮蓝色荧光(图7-C)。
3 讨论
3.1 呼吸链复合体线粒体编码亚基的碱基突变的功能
呼吸链复合体一般由多个亚基组成,每个亚基由核基因或线粒体基因编码。编码基因的突变可能会影响呼吸链复合体的功能进而表现在植物发育上的缺陷,如在玉米NCS2突变体中,线粒体基因缺失,显示出带条纹叶的孢子体发育受损[34],林烟草、突变后,复合物Ⅰ功能障碍。COX是线粒体电子传递链的终端电子受体,负责将电子从细胞色素c传递到分子氧,作为一个电子传输链氧化磷酸化中的限速酶,COX在能量代谢中起重要作用和其他相关过程[14]。
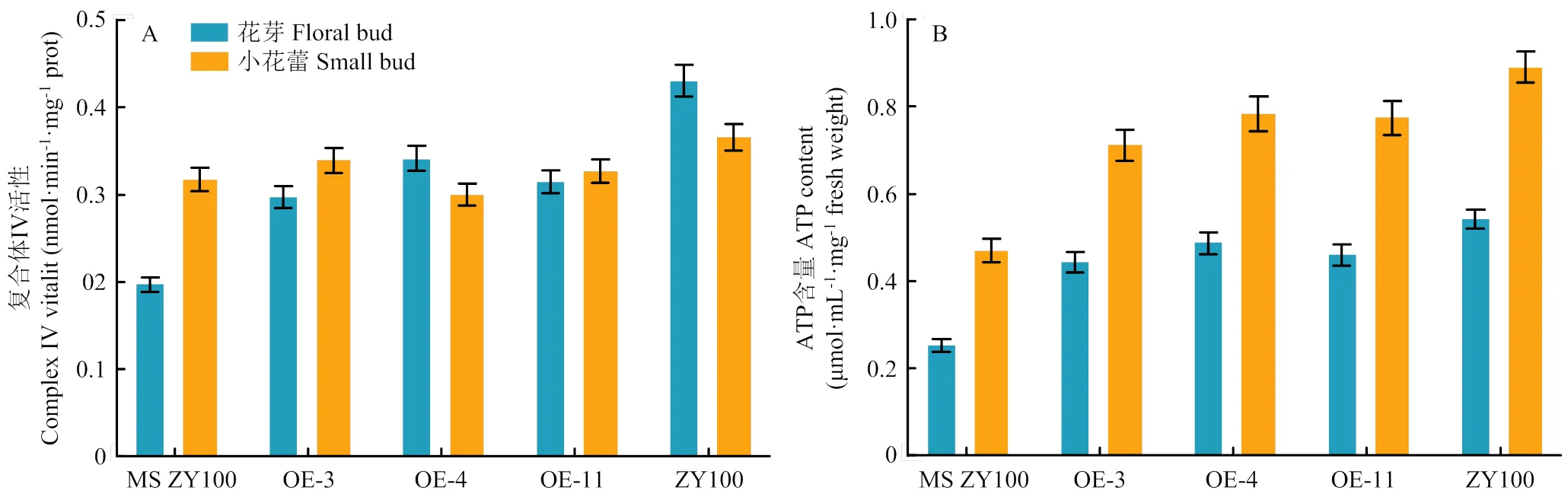
A:COXⅡ过表达株系的COX酶活性;B:COXⅡ过表达株系的ATP含量
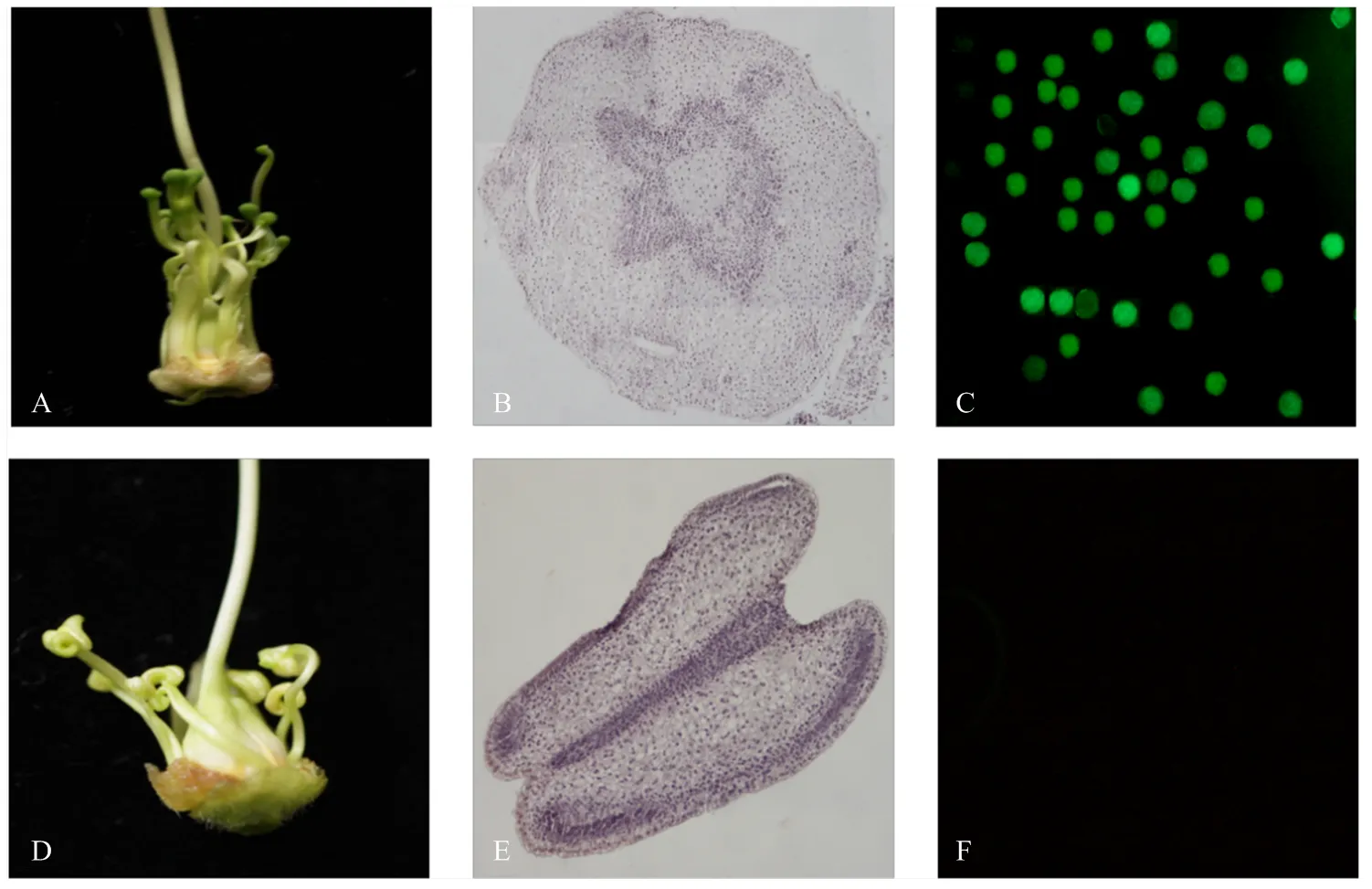
A:MS中烟100花药形态;B:MS中烟100花药结构;C:中烟100花粉粒荧光染色;D:OE-4花药形态;E:OE-4花药结构;F:OE-4花粉粒荧光染色
在COX的13个亚基中,线粒体编码的COXⅠ、COXⅡ亚基构成了发生氧化还原反应和质子转移的酶的核心[35],其中,COXⅡ的C末端位于线粒体的膜间,是COXⅡ与复合物相结合并构成CuA活性位点的部位。在雄性不育甜菜中,当COXⅡ的C末端氨基酸缺失时,COX酶活性降低50%,推测COXⅡ的C末端缺失可能会局部改变复合物Ⅳ构象和其对细胞色素c的亲和力,并导致电泳过程中活性降低和复合物不稳定[12]。本研究中,-COXⅡ的C端770、772、773 3个位置分别发生了C-G、G-A、G-C的碱基突变,导致保守氨基酸位点T257、G258发生S、T的变异,进而在表达、COX蛋白表达以及酶活性上的差异,ATP含量下降。
3.2 能量缺陷与花粉发育
高等植物生殖阶段尤其是小孢子以及花粉发育过程,花药细胞对能量要求巨大,花药的绒毡层细胞中线粒体的数量为体细胞线粒体数量的40倍[1]。在多个研究中均发现CMS基因可导致花药ATP合成的降低[36-38],因此,大多数CMS类型的作用机制在很大程度上可以用能量缺乏模型来解释,即使在花粉发育过程中ATP生成的轻微中断也会导致雄性不育[39]。在-CMS不育系MS中烟100中,花芽、小花蕾的ATP含量为对照中烟100的47%—53%,当将在MS中烟100中过表达后,ATP含量大幅上升,转基因植株的花药发育出现了表型改变,花药由柱头状变成蝴蝶状,进一步细胞学观察发现,与对照MS中烟100相比,转基因植株有了花药壁分化,但随着花蕾的进一步发育,花药结构不再进一步分化,没有功能性花粉产生。通过分析了转基因植株COX酶活性和ATP含量,发现与不育系MS中烟100相比,转基因植株OE-4的在花药中的表达量增加了171倍,COX酶活性和ATP含量是对照的1.7和1.9倍,但仍达不到可育烟草中烟100的水平,其中,在花芽中的表达量为中烟100的0.4倍,COX在花芽中的酶活性为中烟100的0.79倍,ATP含量为中烟100的0.88倍,目前尚不清楚转基因植株花药没有进一步发育是否与能量不足有关,但本研究已证明COXⅡ C端的碱基变异能影响COX酶活性和蛋白功能,进而导致ATP合成不足。
4 结论
烟草-CMS不育系的C端碱基变异显著降低了的表达,进而影响COX的蛋白表达和酶活性,造成ATP合成减少,是其花药能量缺陷的重要原因,也是影响花药发育的一个重要因素。
[1] CHEN L T, LIU Y G. Male sterility and fertility restoration in crops. Annual Review of Plant Biology, 2014, 65: 579-606.
[2] YANG F, ZHANG J J, LIU Q E, LIU H, ZHOU Y H, YANG W Y, MA W J. Improvement and re-evolution of tetraploid wheat for global environmental challenge and diversity consumption demand. International Journal of Molecular Sciences, 2022, 23(4): 2206.
[3] TANG H W, ZHENG X M, LI C L, XIE X R, CHEN Y L, CHEN L T, ZHAO X C, ZHENG H Q, ZHOU J J, YE S, GUO J X, LIU Y G. Multi-step formation, evolution, and functionalization of new cytoplasmic male sterility genes in the plant mitochondrial genomes. Cell Research, 2017, 27(1): 130-146.
[4] HOWAD W, KEMPKEN F. Cell type-specific loss of atp6 RNA editing in cytoplasmic male sterile. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(20): 11090-11095.
[5] AKAGI H, SAKAMOTO M, SHINJYO C, SHIMADA H, FUJIMURA T. A unique sequence located downstream from the rice mitochondrial atp6 may cause male sterility. Current Genetics, 1994, 25(1): 52-58.
[6] PRING D, TANG H, HOWAD W, KEMPKEN F. A unique two-gene gametophytic male sterility system in sorghum involving a possible role of RNA editing in fertility restoration. Journal of Heredity, 1999, 90(3): 386-393.
[7] IWABUCHI M, KYOZUKA J, SHIMAMOTO K. Processing followed by complete editing of an altered mitochondrial atp6 RNA restores fertility of cytoplasmic male sterile rice. The EMBO Journal, 1993, 12(4): 1437-1446.
[8] NOWAK C, Kück U. RNA editing of the mitochondrial atp9 transcript from wheat. Nucleic Acids Research. 1990, 18(23): 7164.
[9] HERNOULD M, SUHARSONO S, LITVAK S, ARAYA A, MOURAS A. Male-sterility induction in transgenic tobacco plants with an unedited atp9 mitochondrial gene from wheat. Proceedings of the National Academy of Sciences of the United States of America, 1993, 90(6): 2370-2374.
[10] GALLAGHER L J, BETZ S K, CHASE C D. Mitochondrial RNA editing truncates a chimeric open reading frame associated with S male-sterility in maize. Current Genetics, 2002, 42(3): 179-184.
[11] WEI L, YAN Z X, DING Y. Mitochondrial RNA editing of F0-ATPase subunit 9 gene (atp9) transcripts of Yunnan purple rice cytoplasmic male sterile line and its maintainer line. Acta Physiologiae Plantarum, 2008, 30(5): 657-662.
[12] DUCOS E, TOUZET P, BOUTRY M. The male sterile G cytoplasm of wild beet displays modified mitochondrial respiratory complexes. The Plant Journal, 2001, 26(2): 171-180.
[13] SABAR M, DE PAEPE R, DE KOUCHKOVSKY Y. Complex I impairment, respiratory compensations, and photosynthetic decrease in nuclear and mitochondrial male sterile mutants of. Plant Physiology, 2000, 124(3): 1239-1250.
[14] PICCOLI C, SCRIMA R, BOFFOLI D, CAPITANIO N. Control by cytochrome c oxidase of the cellular oxidative phosphorylation system depends on the mitochondrial energy state. The Biochemical Journal, 2006, 396(3): 573-583.
[15] VILLANI G, ATTARDI G.measurements of respiration control by cytochrome c oxidase and in situ analysis of oxidative phosphorylation. Methods in Cell Biology, 2001, 65: 119-131.
[16] HELLING S, HÜTTEMANN M, RAMZAN R, KIM S H, LEE I, MÜLLER T, LANGENFELD E, MEYER H E, KADENBACH B, VOGT S, MARCUS K. Multiple phosphorylations of cytochrome c oxidase and their functions. Proteomics, 2012, 12(7): 950-959.
[17] WANGGOU S Y, JIANG X J, LI Q Y, ZHANG L H, LIU D Y, LI G F, FENG X L, LIU W D, ZHU B, HUANG W, SHI J A, YUAN X R, REN C P. HESRG: A novel biomarker for intracranial germinoma and embryonal carcinoma. Journal of Neuro-Oncology, 2012, 106(2): 251-259.
[18] KADENBACH B, ARNOLD S, LEE I, HÜTTEMANN M. The possible role of cytochrome c oxidase in stress-induced apoptosis and degenerative diseases. Biochimica et Biophysica Acta, 2004, 1655: 400-408.
[19] PANG L J, QIU T, CAO X, WAN M. Apoptotic role of TGF-β mediated by Smad4 mitochondria translocation and cytochrome c oxidase subunit II interaction. Experimental Cell Research, 2011, 317(11): 1608-1620.
[20] HUA P Y, SUN M, ZHANG G X, ZHANG Y F, SONG G, LIU Z Y, LI X, ZHANG X Y, LI B J. Costunolide induces apoptosis through generation of ROS and activation of P53 in human esophageal cancer eca-109 cells. Journal of Biochemical and Molecular Toxicology, 2016, 30(9): 462-469.
[21] LEADSHAM J E, SANDERS G, GIANNAKI S, BASTOW E L, HUTTON R, NAEIMI W R, BREITENBACH M, GOURLAY C W. Loss of cytochrome c oxidase promotes RAS-dependent ROS production from the ER resident NADPH oxidase, Yno1p, in yeast. Cell Metabolism, 2013, 18(2):279-286.
[22] XIANG F, MA S, LV Y L, ZHANG D X, SONG H P, HUANG Y S. Tumor necrosis factor receptor-associated protein 1 regulates hypoxia-induced apoptosis through a mitochondria-dependent pathway mediated by cytochrome c oxidase subunit II. Burns & Trauma, 2019, 7(1): 16.
[23] ZHANG M, ZHANG D, REN J J, PU S, WU H, MA Z Q. Target verification of allyl isothiocyanate on the core subunits of cytochrome c oxidase inby RNAi. Pest Management Science, 2021, 77(3): 1292-1302.
[24] ROSSMANITH W, FREILINGER M, ROKA J, RAFFELSBERGER T, MOSER-THEIR K, PRAYER D, BERNERT G, BITTNER R. Isolated cytochrome c oxidase deficiency as a cause of MELAS. BMJ Case Reports, 2009, 45(2):117-121.
[25] UUSIMAA J, FINNILÄ S, VAINIONPÄÄ L, KÄRPPÄ M, HERVA R, RANTALA H, HASSINEN I E, MAJAMAA K. A mutation in mitochondrial DNA-encoded cytochrome c oxidase II gene in a child with Alpers-Huttenlocher-like disease. Pediatrics, 2003, 111(3): e262-e268.
[26] REDDY P L, SHETTY V T, DUTT D, YORK A, DAR S, MUNDLE S D, ALLAMPALLAM K, ALVI S, GALILI N, SABERWAL G S, ANTHWAL S, SHAIKH M, SULEMAN S, KAMAL S Y, RAZA A. Increased incidence of mitochondrial cytochrome c-oxidase gene mutations in patients with myelodysplastic syndromes. British Journal of Haematology, 2002, 116(3): 564-575.
[27] WONG L J, DAI P, TAN D, LIPSON M, GRIX A, SIFRY-PLATT M, GROPMAN A, CHEN T J. Severe lactic acidosis caused by a novel frame-shift mutation in mitochondrial-encoded cytochrome c oxidase subunit II. American Journal of Medical Genetics, 2001, 102(1): 95-99.
[28] ARDAKANI Z S, HEIDARI M M, KHATAMI M, SANI M B. Association of pathogenic missense and nonsense mutations in mitochondrialgene with familial adenomatous polyposis (FAP). International Journal of Molecular and Cellular Medicine, 2020, 9(4): 255-265.
[29] 朱腾义, 范东东, 赵婷, 刘齐元, 王建革, 朱肖文, 程元强. 烟草线粒体基因的SNP检测及其与CMS的相关性分析. 核农学报, 2010, 24(4): 720-727.
ZHU T Y, FAN D D, ZHAO T, LIU Q Y, WANG J G, ZHU X W, CHENG Y Q. SNP detection in tobacco mitochondrial geneand its association with CMS. Journal of Nuclear Agricultural Sciences, 2010, 24(4): 720-727. (in Chinese)
[30] 张长静. 烟草胞质雄性不育系线粒体基因及小孢子发育期基因表达差异研究[D]. 北京: 中国农业科学院, 2012.
ZHANG C J. Studies on mitochondrial genes and differential gene expression in microspore development of tobacco cytoplasmic male sterile lines [D]. Beijing: Chinese Academy of Agricultural Sciences, 2012. (in Chinese)
[31] 郑业强. 烟草-CMS和1-CMS的鉴定和RNA编辑研究[D]. 北京: 中国农业科学院, 2019.
ZHENG Y Q. Identification and RNA editing studies of tobacco-CMS and1-CMS in[D]. Beijing: Chinese Academy of Agricultural Sciences, 2019. (in Chinese)
[32] LIU Z W, LIU Y F, SUN Y H, YANG A G, LI F X. Comparative transcriptome analysis reveals the potential mechanism of abortion in tobacco-cytoplasmic male sterility. International Journal of Molecular Sciences, 2020, 21(7): 2445.
[33] ZHENG Y Q, LIU Z W, SUN Y H, LIU G S, YANG A G, LI F X. Characterization of genes specific to-CMS in. Plant Cell Reports, 2018, 37(9): 1245-1255.
[34] MARIENFELD J R, NEWTON K J. The maize NCS2 abnormal growth mutant has a chimeric nad4-nad7 mitochondrial gene and is associated with reduced complex I function. Genetics, 1994, 138(3): 855-863.
[35] COVELLO P, GRAY M. On the evolution of RNA editing. Trends in Genetics, 1993, 9(8): 265-268.
[36] KORTH K L, KASPI C I, SIEDOW J N, LEVINGS C S. URF13, a maize mitochondrial pore-forming protein, is oligomeric and has a mixed orientation inplasma membranes. Proceedings of the National Academy of Sciences of the United States of America, 1991, 88(23): 10865-10869.
[37] JI J J, HUANG W, YIN C C, GONG Z H. Mitochondrial cytochrome c oxidase and F1Fo-ATPase dysfunction in peppers (L.) with cytoplasmic male sterility and its association with orf507 and Ψatp6-2 genes. International Journal of Molecular Sciences, 2013, 14(1): 1050-1068.
[38] YANG J H, LIU X Y, YANG X D, ZHANG M F. Mitochondrially- targeted expression of a cytoplasmic male sterility-associated orf220 gene causes male sterility in. BMC Plant Biology, 2010, 10: 231.
[39] BEGCY K, NOSENKO T, ZHOU L Z, FRAGNER L, WECKWERTH W, DRESSELHAUS T. Male sterility in maize after transient heat stress during the tetrad stage of pollen development. Plant Physiology, 2019, 181(2): 683-700.
functional analysis in tobacco-CMS line
WANG jin1,2, LIU yanfang1, LIU wenwen3, WANG yaqi1,2, SONG shiyang1,2, ZHANG xingzi1,2, LI fengxia1
1Institute of Tobbcco Research of Chinese Academy of Agricultural Sciences, Qingdao 266100, Shandong;2Graduate School of Chinese Academy of Agricultural Sciences, Beijing 100081;3Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266100, Shandong
【Objective】Cytoplasmic male sterility (CMS) is controlled by the cytoplasmic genome, mainly the mitochondrial genome, which plays an important role in breeding and production of hybrids. Sterile lines and hybrids are the main types of tobacco cultivation in China, accounting for more than 80% of the total tobacco cultivation area. The sterile type of tobacco in China is-CMS, which is also the only sterile type of tobacco production, but the control gene and sterility mechanism of-CMS are not clear. COXⅡ is the second subunit of cytochrome oxidase (COX), encoded by the mitochondrial genome. Nucleotide base variants occur at the terminal of thein-CMS lines, which resulted in the replacement of the C-terminal of COXⅡ Thr257by Ser. The function analysis ofin-CMS tobacco provides a foundation for the elucidation of the molecular mechanism of sterility in tobacco.【Method】In this study, four sets of-CMS lines and fertile controls were used as materials, and RNA blot hybridization and qRT-PCR methods were used to analyze the transcript and gene expression ofbetween-CMS lines and fertile controls, and western blot and COX enzyme activity experiments analyzed COX protein expression and COX enzyme activity, and ATP content were measured. Theof fertile tobacco was overexpressed in-CMS line, and the effects ofoverexpression onexpression, COX enzyme activity, ATP content and stamens development of tobacco were studied.【Result】multi-sequence alignment showed that Thr257at C-terminal was highly conserved between species. Expression analysis showed that thetranscript in-CMS line was significantly lower than that of the fertile control, and quantitative expression of four sets of-CMS lines and fertile controls showed that the expression amount ofin-CMS lines was only 0.3%-0.4% of the fertile controls, the COX protein abundances and enzyme activity were significantly lower than that of the fertile control, and the ATP content of-CMS line was 52% of that of the fertile control. Whenwas overexpressed in-CMS line, the expression levels ofin transgenic plants increased by up to 171 times, the COX enzyme activity increased by 70%, the ATP content increased by 90%. However, all indicators includingexpression levels, COX enzyme activity and ATP content in transgenic plants were lower than those of fertile tobacco. We also observed significant changes in anther morphology in transgenic plants, and the differentiation of the anther wall appeared, but there was no pollen grains in the anthers.【Conclusion】This study shows that the mutantof-CMS line affects COX function, which is a main reason of anther energy deficiency, and it is also an important factor affecting the development of anthers.
tobacco;cytoplasmic male sterility;; functional identification

10.3864/j.issn.0578-1752.2023.16.003
2023-02-16;
2023-05-26
烟草行业烟草基因资源利用重点实验室项目(110201603007)、农业科技创新项目(ASTIP-TRIC02)
望锦,E-mail:13137020357@163.com。通信作者李凤霞,E-mail:lifengxia@caas.cn
(责任编辑 李莉)
