基于单克隆抗体的非洲马瘟病毒间接ELISA抗体检测方法的建立与应用
2023-09-27郭奎张泽楠王垚鑫李帅杰初晓雨郭巍胡哲王晓钧
郭奎,张泽楠,王垚鑫,李帅杰,初晓雨,郭巍,胡哲,王晓钧
基于单克隆抗体的非洲马瘟病毒间接ELISA抗体检测方法的建立与应用
郭奎,张泽楠,王垚鑫,李帅杰,初晓雨,郭巍,胡哲,王晓钧
中国农业科学院哈尔滨兽医研究所动物疫病防控全国重点实验室/马传染病和慢病毒病研究创新团队,哈尔滨 150069
【目的】为有效应对非洲马瘟(African horse fever, AHS)传入我国的风险,研究建立一种基于单克隆抗体(Monoclonal antibody, Mab)的非洲马瘟病毒(African horse fever virus, AHSV)特异性的间接ELISA(indirect ELISA, iELISA)抗体检测方法,利用该方法对我国马匹进行非洲马瘟抗体监测。为有效诊断非洲马瘟提供血清学检测手段。【方法】首先利用AHSV VP7抗原免疫小鼠制备针对VP7抗原的单克隆抗体;其次通过对包被抗体浓度、蛋白浓度、血清稀释度、酶标二抗稀释度等反应条件的优化建立AHSV iELISA抗体检测方法。利用1 000份血清确定该方法的临界值,并评估该方法的敏感性和特异性。由3位试验操作者分别对AHSV 敏控阳性血清进行加速试验测定效价,评估该方法的稳定性。通过利用建立的方法对已知的10份AHSV阳性血清和400份阴性血清进行检测并与国外商品化试剂盒检测结果进行比较;最后用该方法对我国2021年18个省份或地区的947份临床样本进行检测来评估我国马匹中AHSV感染风险。【结果】获得了5株针对AHSV VP7抗原的单克隆抗体。通过对5株单克隆抗体筛选确定3G9单克隆抗体捕获抗原性能最佳。利用3G9抗体作为包被抗体,通过对不同反应条件优化建立了AHSV iELISA抗体检测方法。确定该方法的临界值为0.25;经比对试验证实本研究建立的AHSV iELISA方法的敏感性与商品化试剂盒相当。3位操作者分别对敏控血清进行检测,组内变异系数范围分别为3.19%—7.02%、0%—3.11%、0.27%—5.76%,组间变异系数为1.17%—5.03%。37 ℃加速试验表明AHSV阳性血清7 d内效价稳定,因此证明该方法具有良好的稳定性。该方法与商品化试剂盒进行比较两者总体符合率为100%。通过对我国18个省或地区的947份马血清进行检测,结果表明AHSV抗体阳性率为0%。【结论】成功筛选到了针对AHSV VP7的单克隆抗体,建立了一种基于单克隆抗体的AHSV iELISA抗体检测方法,该方法具有特异性强、敏感性高、稳定性好,可以实现临床样本中AHSV抗体的检测,因此可以作为AHS血清学监测的一种有效工具。
非洲马瘟病毒;单克隆抗体;间接ELISA;应用
0 引言
【研究意义】非洲马瘟(African horse sickness, AHS)被列为世界动物卫生组织(OIE)必须报告的动物疫病,我国将其列为一类动物疫病。我国是AHS历史无疫国,并已获得OIE认可。在2020年距离我国较近的泰国发生了AHS疫情[1],此外AHS最重要的传播媒介拟蚁库蠓在我国华南地区已有相关报道,因此AHS具有传入我国的潜在风险。基于非洲马瘟病毒(African horse sickness virus, AHSV)VP7抗原的ELISA方法可用于检测AHSV群特异性抗体并在2002年获得欧盟的认可,但目前我国仍没有自主研发相关商品化产品,其来源主要还是依靠进口。为及时有效应对AHS传入我国的风险,研发AHSV的ELISA抗体检测方法至关重要。【前人研究进展】AHS主要通过库蠓等吸血昆虫叮咬传播,主要症状为发热、皮下水肿和病毒血症,严重时伴有组织和脏器出血,马属动物中马最易感,病死率可高达95%,骡驴次之[2-3]。该病的临床症状可分为4种类型,即肺型、心型、混合型和发热型[4-5]。尽管AHS的一些临诊症状和病理变化很典型,例如,患亚急性AHS的马匹经常出现眶上水肿,结合相应病史足以做出初步诊断,但其他一些症状和病变的特异性较低,容易与其他疾病相混淆,如马器质性脑病、马传染性贫血、亨德拉病毒病、马病毒性动脉炎、马梨形虫病和紫癜性出血病,为进行鉴别诊断,实验室检测对疫病确诊至关重要。AHSV包含9个血清型,即AHSV1—9型[6],基因组由10个双链RAN片段组成,编码7种结构蛋白(VP1-VP7)和4种非结构蛋白(NS1, NS2, NS3 和 NS3a)[7]。VP2蛋白基因序列在不同血清型间变化范围是47.6% —71.4%,是最重要的血清型特异性抗原[8];而VP7基因是AHSV最重要的血清群特异性抗原基因,在各血清型间高度保守,不同血清型之间同源性为94.3%—99.5%,因此VP7基因及其编码蛋白也是核酸检测[9-14]及血清学[15-18]检测的重要靶标。目前AHSV的实验室血清学检测方法主要包括酶联免疫吸附试验(ELISA)、病毒中和试验、免疫印迹和微量补体结合实验进行抗体检测,其中ELISA是最主要的血清学检测方法[15-17, 19-26]。HAMBLIN等[15]利用AHSV作为包被抗原和全病毒制备的豚鼠多抗建立了竞争ELISA(Competitive ELISA, cELISA)检测方法,验证了利用AHSV-4获得的豚鼠血清能识别9个血清型抗原,并且相比AHSV-1 制备的血清特异性更好。此外基于VP7建立的ELISA方法更加广泛,Maree等[20]利用杆状病毒表达的VP7建立了iELISA检测方法并证明了此方法比病毒中和试验和补体结合试验具有更高的敏感性;Wade-Evans[16]以VP7建立了cELISA检测方法并证明包被VP7蛋白比包被全病毒时检测敏感性更好。KWEON等[17]以VP7建立了cELISA,通过对样品检测验证了其特异性比iELISA更好。但目前国内ELISA研究主要以集中在VP7建立iELISA方法[21, 23-24, 26],2008年高志强等[26]利用拼接表达的VP7建立了iELISA方法并初步验证了其具有良好的特异性;2012年曹琛福等[21]直接利用杆状病毒表达获得裂解液作为包被抗原建立了iELISA方法,稳定性及特异性仍需进一步评估;2013年潘佳亮等[23]基于原核表达获得的VP7蛋白建立了iELISA方法,并验证具有良好的敏感性和特异性。2014年郑小龙等[24]基于VP7蛋白建立了lgM捕获ELISA用于AHS的早期诊断但敏感性不及商品化试剂盒。【本研究切入点】尽管国内外有关AHSV ELISA抗体检测方法的研究较多,目前国际可以用的试剂盒仅有西班牙英吉纳公司的AHSV cELISA试剂盒,而国内市场仍没有自主研发的商品化的ELISA相关试剂盒,究其原因与试剂盒特异性和稳定性有很大关系。iELISA相比cELISA敏感性高但特异性不强,多假阳性,前期我们利用纯化后的VP7蛋白作为包被抗原建立了一种AHSV iELISA抗体检测方法,通过大量样品(>500)证实了该方法存在大量假阳性结果,为了克服iELISA假阳性的问题,本研究采用单克隆抗体包被后捕获VP7抗原的策略建立了AHSV iELISA方法,既保留常规iELISA的敏感性又增加了特异性。【拟解决的关键问题】本研究旨在建立一种特异性强、敏感性高、稳定性好的AHSV iELISA抗体检测方法,为国内AHS的诊断提供一种有效的血清学检测工具。
1 材料与方法
试验于2019年7月至2022年5月在中国农业科学院哈尔滨兽医研究所,动物疫病防控全国重点实验室,由马传染病与慢病毒病研究创新团队进行。
1.1 质粒和菌株及样品
大肠杆菌Rosetta(DE3)化学感受态细胞购自天根生化科技有限公司;根据非洲马瘟诊断技术(GB/T 21675-2008)提供的VP7基因序列(GenBank: KT030566.1)对VP7基因进行密码子优化,并将密码子优化后的VP7基因合成到pET32a载体上。
1.2 主要试剂
IPTG购自宝生物工程(大连)有限公司;DNA Marker DM 2000、T4 DNA连接酶购自上海生工生物工程有限公司;琼脂糖为Promega公司产品;HRP标记的抗马IgG二抗(KPL)。琼脂糖凝胶DNA回收试剂盒(Gel Extraction Kit)、高纯度质粒小提试剂盒(Pureplasmid Mini Kit)等均购自康为世纪有限公司;1640培养基购自Sigma公司;胎牛血清购自Ausbian公司;马传染性贫血病毒(equine infections anemin virus, EIAV)、马流感病毒(equine innuenza virus, EIV)、马疱疹病毒(equine herpes virus, EHV)、马动脉炎病毒(equine arteritis virus, EAV)、马泰勒虫()、驽巴贝斯虫(,)马链球菌()、马流产沙门氏菌(Abortus equiAbortus)、鼠伤寒沙门氏菌()、都柏林沙门氏菌(Dublin)、肠炎沙门氏菌()等标准阳性血清由中国农业科学院哈尔滨兽医研究所,动物疫病防控全国重点实验室保存。1 000份AHSV阴性血清;1份AHSV VP7特异性阳性参考血清(效价32×,由纯化的AHSV VP7抗原免疫马后获得),用来作为试剂盒敏感性控制血清(敏控血清):封闭液(I和II)、样品稀释液(I和II)和HRP偶联物稀释液(I、III和IV))等均保存于该实验室。10份AHSV阳性血清由香港渔护署赠送(AHSV减毒活疫苗免疫马血清或血浆);947份临床血清来自我国2021年18个省份或地区。
1.3 目的蛋白的诱导表达及鉴定
将合成的质粒转化入Rosetta,37 ℃培养12—14 h。将阳性菌落,接种于5 mL含有1 µg·mL-1的氨苄青霉素抗性的新鲜LB液体培养基中,在37 ℃下170 r/min震荡培养16 h,以1﹕100比例接种于Amp/LB液体培养基中,37 ℃ 170 r/min培养,等到菌液OD600nm为0.6—0.8时,加入终浓度为0.6 mmol·L-1的IPTG,24 ℃进行诱导表达。诱导6 h后,取4 mL菌液进行富集菌体并加入1.5 mL PBS进行超声破碎;破碎后,4 ℃、12 000 r/min离心5 min。沉淀同样用等量PBS冲洗两遍,再用等量PBS重悬。分别取40 µL上清样品和沉淀重悬样品,并各加入10 µL 5×SDS-PAGE Loading Buffer 混合均匀,95 ℃煮沸5min,取20 μL处理的样品进行SDS-PAGE,电泳结束后用于考马斯亮蓝染色。利用亲和层析分析方式纯化目的蛋白以及pET32a空载体蛋白[27],SDS-PAGE后以AHSV阳性血清为一抗(1﹕200稀释),抗马IgG抗体为二抗(1﹕5 000稀释)进行Western blot分析。
1.4 单克隆抗体制备及鉴定
利用常规方式对小鼠进行免疫及杂交瘤细胞株筛选[28]。利用SBA ClonotypingTM System/HRP试剂盒按照说明书对筛选出的单克隆抗体亚类进行鉴定。
1.5 AHSV iELISA反应策略及抗体的筛选
将5种不同的单克隆抗体进行包被后,按照顺序依次加入抗原、阳性血清及酶标二抗,对5株抗体的捕获抗原能力进行鉴定。具体步骤如下:(1)将5株纯化后单克隆抗体分别按照2 μg·mL-1浓度包被(100 μL/孔),4 ℃包被过夜(>12 h);(2)封闭后加入0.25 μg·mL-1(100 μL/孔)VP7抗原,37 ℃作用30 min;(3)PBST洗涤2次后,加入1﹕400稀释的AHSV阳性血清,37 ℃作用30 min;(4)PBST洗涤2次后,加入1﹕20 000稀释的酶标二抗,37 ℃作用30 min;(5)PBST洗涤2次后,加入底物(100微升/孔)37 ℃避光显色10 min;(6)加入2 mol·L-1H2SO4进行终止,在OD450nm读值。根据阳性血清OD450nm值的大小评估5株单克隆抗体捕获VP7抗原的能力。
1.6 反应条件的优化
分别对包被抗体浓度(200、 100和50 μg·mL-1)、抗原浓度(0.25、 0.125、0.06 μg·mL-1)、血清稀释度(1﹕100、 1﹕200和1﹕400)及酶标抗体工作浓度(1﹕10 000、1﹕20 000、1﹕30 000和1﹕40 000)进行反应条件优化和筛选,以P/N比值最大确定最佳反应条件。在最佳反应条件的基础上对封闭液(I和II)、样品稀释液(I和II)和HRP偶联物稀释液(I、III和IV)进行筛选。
1.7 AHSV iELISA抗体检测方法临界值的确定
应用优化的AHSV iELISA抗体检测方法对1 000份AHSV阴性血清进行检测,利用以下公式进行计算S/P值,计算全部阴性血清S/P值的平均值(X)和标准差(SD),并确定X+3SD作为该方法检测临床AHSV抗体阳性和阴性的临界值。当待检血清样品的S/P值大于临界值时判为阳性。

1.8 AHSV iELISA特异性、敏感性和稳定性
利用优化出的最佳反应条件对AHSV阳性血清、马传染性贫血病病毒(EIAV)、马动脉炎病毒(EAV)、马疱疹病毒(EHV)、马流感病毒(EIV)、马泰勒虫()、马巴贝斯虫()、马腺疫链球菌()、马流产沙门氏菌(Abortusequi)、鼠伤寒沙门氏菌(Typhimurium)、都柏林沙门氏菌(Dublin)、肠炎沙门氏菌(Enteritidis)大肠杆菌阳性血清等阳性血清进行检测,评估 AHSV iELISA抗体检测方法的特异性。采用本方法对AHSV阳性血清进行检测并与商品化的AHSV cELISA方法比较敏感性。将配制的AHSV iELISA试剂放置37 ℃进行加速试验验证其稳定性,由3位实验操作者分别对AHSV阳性敏控血清进行效价测定试验,每人做2个重复共6个重复,试验成立的条件为阳性对照血清OD450nm值>0.8,阴性对照血清OD450nm值<0.25。
1.9 AHSV iELISA与商品化试剂盒检测性能的评估
利用本研究建立的AHSV iELISA方法对10份AHSV阳性血清和400份阴性血清进行检测,并与商品化AHSV cELISA检测结果进行比较。计算AHSV iELISA 的检测敏感性和检测特异性。检测敏感性(%)= [检测出的阳性样品数量/已知阳性样品数量]×100;检测特异性(%)= [检测出的阴性样品数量/已知阴性样品数量]×100 。
1.10 AHSV iELISA方法的应用
利用AHSV iELISA对我国2021年18个省份或地区共947份临床血清进行检测,了解我国马匹AHSV感染情况。
2 结果
2.1 VP7蛋白的表达
通过SDS-PAGE分析显示,重组pET32a-VP7菌破碎后上清和沉淀中均出现一条相对分子质量约52 kDa的蛋白条带(图1),证明重组蛋白获得表达并主要以包涵体形式存在。Western blot 分析表明AHSV阳性血清与重组蛋白(图2)发生特异性反应,证实重组蛋白具有良好的反应原性。

M:蛋白marker;1:VP7蛋白诱导后上清;2:VP7蛋白诱导后沉淀
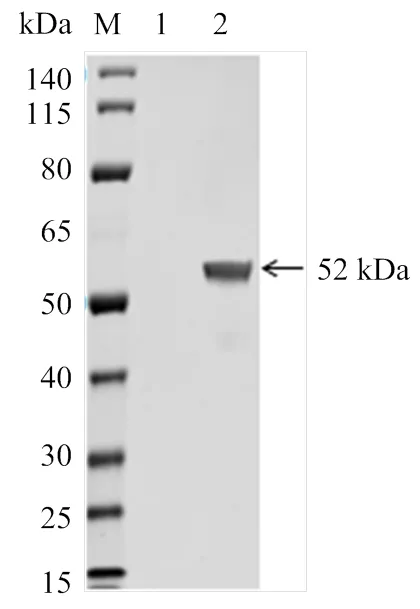
M:蛋白marker;1:pET32a载体;2:纯化的VP7蛋白
2.2 单克隆抗体的鉴定
通过3次亚克隆共筛到5株能识别VP7融合蛋白的单克隆抗体。按照SBA ClonotypingTMSystem/ HRP试剂盒说明书对筛选出的单克隆抗体亚类进行鉴定,结果表明3G9、6G4株单克隆抗体亚类IgG1,3E9株单克隆抗体亚类IgG2a,5E2株单克隆抗体亚类IgG2b,5株单克隆抗体轻链均为κ型。间接ELISA的方法测定5株杂交瘤细胞株纯化后抗体的效价: 3G9、3E9和6G4效价最高,达到8.2×105;其次是8B5,效价为4.1×105;5E2效价最低,效价为2.0×105。
2.3 包被抗体的筛选
ELISA结果表明仅3G9作为包被抗体时检测AHSV阳性血清OD450nm值最高(图略),所以3G9抗体作为包被抗体捕获VP7抗原的能力最强,因此后续AHSV iELISA方法反应条件的优化以3G9抗体作为包被抗体进行试验。
2.4 最佳反应条件的确定
通过对包被抗体浓度、抗原浓度、血清稀释度及酶标抗原工作浓度进行反应条件优化,确定反应策略的最佳反应体系。最终确定条件为:包被抗体浓度为2 μg·mL-1、抗原浓度为0.25 μg·mL-1、血清稀释度为1﹕400倍稀释、酶标二抗浓度为1﹕20 000倍稀释。在最佳反应体系的基础上,根据S/P值确定最佳封闭液为I号,最佳样品稀释液为II号,最佳酶标抗体稀释液为I号。
2.5 AHSV iELISA抗体检测方法临界值的确定
根据1 000份阴性血清的检测结果确定临界值。通过生物学统计分析方法计算出临床血清检测时阳性和阴性血清的临界值(X+3SD)为0.232,为了方便临床使用将临界值定为0.25,当临床样品S/P值高于0.25时判定为阳性。
2.6 AHSV iELISA抗体检测方法特异性鉴定
通过对不同阳性血清进行检测评估AHSV iELISA抗体检测方法的特异性,结果显示,该方法仅与AHSV阳性血清呈阳性反应,因此证明该方法具有良好的特异性。
2.7 AHSV iELISA敏感性
首先对AHSV阳性血清(香港渔护署赠送血清)进行2倍比稀释,然后将稀释后的血清分别采用本研究建立的基于单克隆抗体的AHSV iELISA和商品化的AHSV cELISA方法同时检测,比较两种方法检测阳性血清的最大稀释度。结果表明AHSV iELISA检测阳性血清最大稀释度为16倍(图3-A),与商品化cELISA(>50%判定阳性)检测阳性血清的最大稀释度一致(图3-B)。
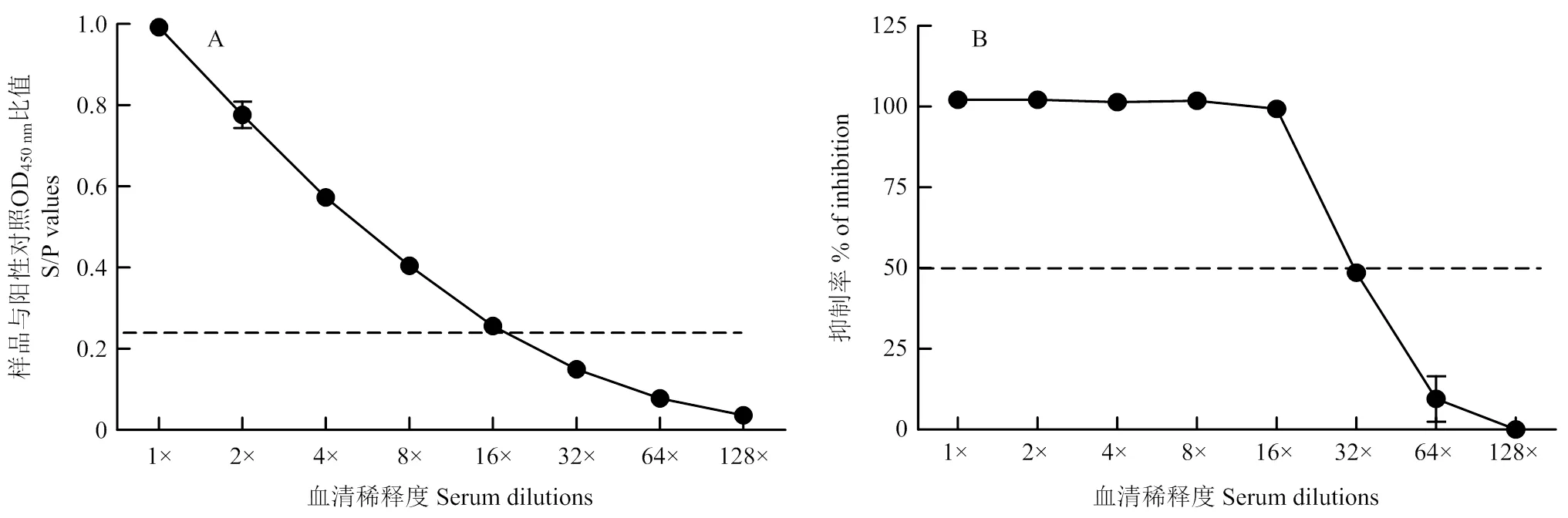
图3 AHSV iELISA和商品化cELISA的敏感性鉴定
2.8 AHSV iELISA抗体检测方法的稳定性
由3位试验操作者分别对AHSV阳性敏控血清2倍比稀释后进行效价测定,3位操作者检测结果的组内变异系数范围分别为3.19%—7.02%、0—3.11%、0.27%—5.76%,组间变异系数范围为1.17%—5.03%。组内、组间变异系数均<10%,因此证明该方法具有良好的稳定性(表1)。加速试验表明在加速第0—8天时不同血清稀释度下的S/P值均比较平缓,对AHSV iELISA试剂盒保存期加速试验结果进行统计,当加速第8天时,操作者1、操作者3检测出AHSV敏控血清OD450nm值均>0.8,AHSV敏控血清效价为32×,操作者2所做阳性血清OD450nm值=0.798略低于0.8,试验不成立但敏控血清效价仍满足32×。在加速第7天时,3位操作者的试验均成立,测定效价均为32×,试剂盒合格,因此证明该方法具有良好的稳定性(图4)。
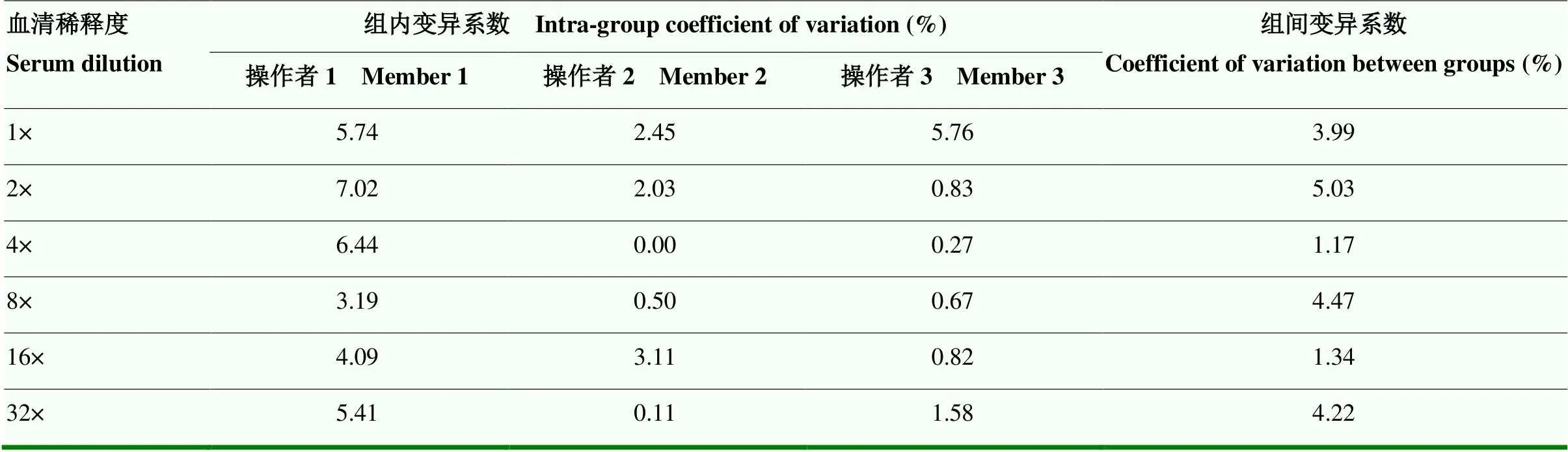
表1 AHSV iELISA组内、组间重复性结果
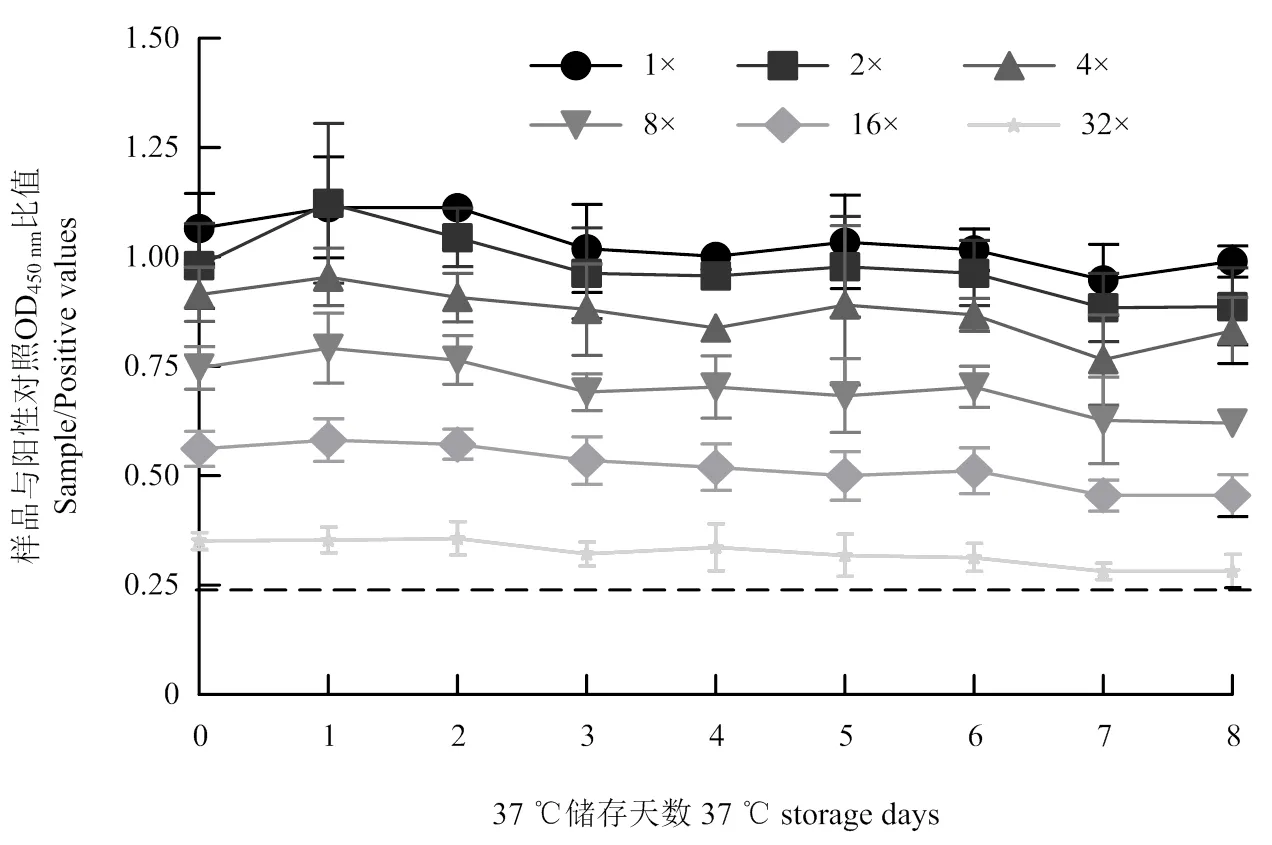
图4 不同天数下S/P值的结果
2.9 AHSV iELISA与商品化cELISA的比较
应用本研究建立的AHSV iELISA对10份AHSV阳性血清和400份AHSV阴性血清进行检测,结果表明AHSV iELISA的检测敏感性和检测特异性均为100%。将AHSV iELISA检测结果与商品化AHSV CELISA检测结果进行比较,结果表明AHSV iELISA和商品化AHSV C ELISA阳性符合率和阴性符合率均为100%(表2)。
2.10 AHSV iELISA检测临床样品
利用AHSV iELISA对我国18个省份或地区共947份临床血清进行检测,结果表明18个省的样品中AHSV抗体阳性率为0。
“+”代表阳性结果,“-”代表阴性结果
"+" positive result, "-" negative result
3 讨论
3.1 关于AHSV ELISA检测产品的现状和不足
目前关于AHS的血清学诊断,国内外学者做出了大量工作,国外研究多集中在以VP7蛋白建立的AHSV cELISA,而国内学者多以VP7建立的iELISA方法。我国学者虽然在早期建立了AHSV iELISA检测方法但均没有实现商品化[21, 23-24, 26],目前商品化的AHSV ELISA诊断产品以西班牙英吉纳公司的AHSV cELISA试剂盒为主。我国是AHS历史无疫国并已获得OIE认定,尽管目前我国没有AHS疫情,但随着邻近国家AHS 疫情的暴发AHS仍有传入我国的风险,因此研发相关诊断产品作为对AHS防范的战略储备具有重要意义。
3.2 AHSV iELISA方法与前人研究方法的对比
通常iELISA中包被蛋白通常来自原核表达系统,在纯化后目的蛋白中仍会有一定量大肠杆菌抗原残留,而大肠杆菌是一种自然界常在菌,部分动物血清中会有大肠杆菌抗体存在。当进行目的蛋白包被时残留的大肠杆菌也会吸附到板子上,如果待检血清中含有大肠杆菌抗体时则会导致检测结果出现假阳性。前期我们通过原核表达系统并利用亲和层析方式获得了较高纯度的VP7蛋白,将VP7蛋白直接作为包被抗原建立了常规iELISA方法,并验证该方法的敏感性比商品化试剂盒提高了4—8倍。但利用该方法对大肠杆菌阳性血清和临床样品(>500份)进行检测时却出现假阳性结果,并且不同批次蛋白包被检测结果差异大。为了提高iELISA检测的特异性,本研究建立了基于单克隆抗体的iELISA方法。该方法利用单克隆抗体特异性将VP7单克隆抗体先包被到ELISA板子中然后加入VP7蛋白孵育,此步骤VP7单克隆抗体可以特异性捕获VP7蛋白,减少了VP7蛋白中非特异性大肠杆菌蛋白的干扰,从而提高了检测的特异性。关于AHSV ELISA检测方法,我国学者先前也进行了研究。曹琛福等[21]以杆状病毒表达的裂解液作为包被抗原建立iELISA方法并对150多份血清进行了检测,抗体检测结果均为阴性,但该方法以裂解液直接作为包被抗原,其各个批次间稳定性及特异性需进一步评估;高志强等[26]和潘佳亮等[23]利用原核表达的VP7蛋白建立的iELISA方法,对少量马传染病病毒阳性血清进行了特异性验证,但均未对大肠杆菌阳性血清和其他细菌性和寄生虫性阳性血清验证,因此其特异性仍需进一步评估。郑小龙等[24]基于VP7蛋白建立了IgM捕获ELISA对180份血清进行检测与商品化试剂盒符合率为97.7%,敏感性不及商品化试剂盒。相比曹琛福的研究,本研究建立的AHSV iELISA方法中所涉及的单克隆抗体以及VP7蛋白均为纯化后获得,在批间重复性、特异性上更好;与高志强等和潘佳亮等研究相比本方法在特异性上评估上更全面,不仅对马传染性贫血病等病毒阳性血清进行了验证,还对寄生虫和细菌病的阳性血清进行了评估,因此特异性评估结果更加可靠;相比郑小龙的研究结果,本方法与商品化试剂盒的总体符合率更高,达到100%。本方法用于临界值确定的样品数量相比先前研究多20倍以上,因此临界值结果的确定可信度更高。
3.3 我国马匹AHSV感染状况监测及应对
目前尚无针对AHS的特异性治疗方法,检疫隔离、病媒控制、疫苗接种等支持性治疗仍是控制该病的有效方法。目前,在非洲流行地区,一价和多价减毒活疫苗均可用于预防AHS,多价减毒活疫苗对所有9种血清型的AHSV都提供广泛的保护[29-30]。然而,由于与减毒活疫苗相关的安全问题,如毒力返强、与流行AHSV毒株发生重组,多价LAV尚未在欧洲和其他国家注册使用[12],此外,近期Aksular等证实单剂量的AHSV VP2亚单位疫苗在小鼠模型中提供完全的临床保护[31]。目前我国没有AHS疫情,但常规检疫对了解我国马匹AHSV感染情况具有重要意义,此外在血清学检测是阳性结果时,应结合马匹是否进行减毒疫苗免疫方可对疾病进行确诊。本研究对我国18个省份947份马属动物血清进行了AHSV抗体监测,目前我国马匹还没有出现AHSV感染情况,但吸取非洲猪瘟传入我国的教训,对我国马群中AHSV的抗体监测是十分有必要的。随着我国亚运会召开、马属俱乐部等兴起和马属动物无疫区建设等,市场对该病的检测需求越来越大,但国内市场上AHS诊断产品实现商品化的较少,主要还是依靠进口,而进口试剂盒存在价格昂贵、货期长等因素,使我国马匹AHS的监测可能会处于被动状态,因此,面对市场需要增大以及进口试剂盒货期长等不利因素,应积极推动国内AHS诊断产品的上市。目前,本研究研发的AHSV iELISA试剂盒正在进行孵化,该产品可用于国内AHS疫病疫情快速检测,为我国AHS血清学监测提供了一种特异、稳定的检测工具。
4 结论
成功建立了一种基于单克隆抗体的非洲马瘟病毒iELISA抗体检测方法,该方法具有特异性强、敏感性高、稳定性好的特点,与商品化试剂盒符合率为100%,可以实现对临床样本中非洲马瘟病毒抗体的检测,因此可以作为我国马匹中非洲马瘟病毒抗体检测的一种有效工具。通过对我国马匹进行较大规模非洲马瘟病毒抗体监测,目前我国马匹尚无非洲马瘟病毒感染情况。
[1] TOH X, WANG Y F, RAJAPAKSE M P, LEE B, SONGKASUPA T, SUWANKITWAT N, KAMLANGDEE A, JUDITH FERNANDEZ C, HUANGFU T Q. Use of nanopore sequencing to characterize African horse sickness virus (AHSV) from the African horse sickness outbreak in Thailand in 2020. Transboundary and Emerging Diseases, 2022, 69(3): 1010-1019.
[2] KARAMALLA S T, GUBRAN A I, ADAM I A, ABDALLA T M, SINADA R O, HAROUN E M, ARADAIB I E. Sero-epidemioloical survey on African horse sickness virus among horses in Khartoum State, Central Sudan. BMC Veterinary Research, 2018, 14(1): 230.
[3] GORDON S J G, BOLWELL C, ROGERS C W, MUSUKA G, KELLY P, GUTHRIE A, MELLOR P S, HAMBLIN C. The sero-prevalence and sero-incidence of African horse sickness and equine encephalosis in selected horse and donkey populations in Zimbabwe. The Onderstepoort Journal of Veterinary Research, 2017, 84(1): e1-e5.
[4] ZIENTARA S, LECOLLINET S. African horse sickness. Revue Scientifique et Technique De L’OIE, 2015, 34(2): 315-327.
[5] BURRAGE T G, LAEGREID W W. African horsesickness: pathogenesis and immunity. Comparative Immunology, Microbiology and Infectious Diseases, 1994, 17(3/4): 275-285.
[6] VON TEICHMAN B F, DUNGU B, SMIT T K.cross- protection to African horse sickness Serotypes 5 and 9 after vaccination with Serotypes 8 and 6. Vaccine, 2010, 28(39): 6505-6517.
[7] ROY P, MERTENS P P C, CASAL I. African horse sickness virus structure. Comparative Immunology, Microbiology and Infectious Diseases, 1994, 17(3/4): 243-273.
[8] MARTÍNEZ-TORRECUADRADA J L, LANGEVELD J P M, MELOEN R H, CASAL J I. Definition of neutralizing sites on African horse sickness virus serotype 4 VP2 at the level of peptides. Journal of General Virology, 2001, 82(10): 2415-2424.
[9] AGÜERO M, GÓMEZ-TEJEDOR C, ANGELES CUBILLO M, RUBIO C, ROMERO E, JIMÉNEZ-CLAVERO A. Real-time fluorogenic reverse transcription polymerase chain reaction assay for detection of African horse sickness virus. Journal of Veterinary Diagnostic Investigation, 2008, 20(3): 325-328.
[10] FERNÁNDEZ-PINERO J, FERNÁNDEZ-PACHECO P, RODRÍGUEZB, SOTELO E, ROBLES A, ARIAS M, SÁNCHEZ-VIZCAÍNO J M. Rapid and sensitive detection of African horse sickness virus by real-time PCR. Research in Veterinary Science, 2009, 86(2): 353-358.
[11] QUAN M, LOURENS C W, MACLACHLAN N J, GARDNER I A, GUTHRIE A J. Development and optimisation of a duplex real-time reverse transcription quantitative PCR assay targeting the VP7 andgenes of African horse sickness virus. Journal of Virological Methods, 2010, 167(1): 45-52.
[12] WEYER C T, JOONE C, LOURENS C W, MONYAI M S, KOEKEMOER O, GREWAR J D, VAN SCHALKWYK A, MAJIWA P O A, MACLACHLAN N J, GUTHRIE A J. Development of three triplex real-time reverse transcription PCR assays for the qualitative molecular typing of the nine serotypes of African horse sickness virus. Journal of Virological Methods, 2015, 223: 69-74.
[13] ZIENTARA S, SAILLEAU C, MOULAY S, PLATEAU E, CRUCIÈRE C. Diagnosis and molecular epidemiology of the African horse sickness virus by the polymerase chain reaction and restriction patterns. Veterinary Research, 1993, 24(5): 385-395.
[14] ZIENTARA S, SAILLEAU C, MOULAY S, WADE-EVANS A, CRUCIERE C. Application of the polymerase chain reaction to the detection of African horse sickness viruses. Journal of Virological Methods, 1995, 53(1): 47-54.
[15] HAMBLIN C, GRAHAM S D, ANDERSON E C, CROWTHER J R. A competitive ELISA for the detection of group-specific antibodies to African horse sickness virus. Epidemiology and Infection, 1990, 104(2): 303-312.
[16] WADE-EVANS A M, WOOLHOUSE T, O'HARA R, HAMBLIN C. The use of African horse sickness virus VP7 antigen, synthesised in bacteria, and anti-VP7 monoclonal antibodies in a competitive ELISA. Journal of Virological Methods, 1993, 45(2): 179-188.
[17] KWEON C H, KWON B J, KO Y J, KENICHI S. Development of competitive ELISA for serodiagnosis on African horsesickness virus using baculovirus expressed VP7 and monoclonal antibody. Journal of Virological Methods, 2003, 113(1): 13-18.
[18] DURÁN-FERRER M, AGÜERO M, ZIENTARA S, BECK C, LECOLLINET S, SAILLEAU C, SMITH S, POTGIETER C, RUEDA P, SASTRE P, MONACO F, VILLALBA R, TENA-TOMÁS C, BATTEN C, FROST L, FLANNERY J, GUBBINS S, LUBISI B A, SÁNCHEZ-VIZCAÍNO J M, EMERY M, STURGILL T, OSTLUND E, CASTILLO-OLIVARES J. Assessment of reproducibility of a VP7 Blocking ELISA diagnostic test for African horse sickness. Transboundary and Emerging Diseases, 2019, 66(1): 83-90.
[19] CHUMA T, LE BLOIS H, SÁNCHEZ-VIZCAÍNO J M, DIAZ- LAVIADA M, ROY P. Expression of the major core antigen VP7 of African horsesickness virus by a recombinant baculovirus and its use as a group-specific diagnostic reagent. The Journal of General Virology, 1992, 73 ( Pt 4): 925-931.
[20] MAREE S, PAWESKA J T. Preparation of recombinant African horse sickness virus VP7 antigen via a simple method and validation of a VP7-based indirect ELISA for the detection of group-specific IgG antibodies in horse sera. Journal of Virological Methods, 2005, 125(1): 55-65.
[21] 曹琛福, 叶奕优, 宗卉, 张彩虹, 吕建强, 杨俊兴, 花群义. 非洲马瘟间接ELISA方法的建立及初步应用. 动物医学进展, 2012, 33(3): 6-9.
CAO C F, YE Y Y, ZONG H, ZHANG C H, LÜ J Q, YANG J X, HUA Q Y. Development and application of indirect enzyme-linked immunoadsorbent assay for detecting African horse sickness. Progress in Veterinary Medicine, 2012, 33(3): 6-9. (in Chinese)
[22] 李富祥, 杨仕标, 艾军, 周晓黎, 赵文华, 王金萍. 非洲马瘟病毒VP7基因的克隆及其在昆虫细胞中的表达. 中国畜牧兽医, 2012, 39(1): 28-31.
LI F X, YANG S B, AI J, ZHOU X L, ZHAO W H, WANG J P. Cloning and expression ofgene of African horse sickness virus in baculovirus infected insect cells. China Animal Husbandry & Veterinary Medicine, 2012, 39(1): 28-31. (in Chinese)
[23] 潘佳亮, 高利, 相文华, 戚亭, 郭巍. 非洲马瘟病毒VP7蛋白的原核表达及其间接ELISA方法的建立. 中国兽医科学, 2013, 43(3): 256-260.
PAN J L, GAO L, XIANG W H, QI T, GUO W. Development of an indirect ELISA based on the prokaryotic expression ofgene of African sickness virus. Chinese Veterinary Science, 2013, 43(3): 256-260. (in Chinese)
[24] 郑小龙, 朱来华, 王群, 艾军, 邓明俊, 肖西志, 梁成珠, 姜帆, 于业锋. 非洲马瘟VP7蛋白多克隆抗体的制备及IgM捕获ELISA检测方法的建立. 中国动物检疫, 2014, 31(5): 70-73.
ZHENG X L, ZHU L H, WANG Q, AI J, DENG M J, XIAO X Z, LIANG C Z, JIANG F, YU Y F. Preparation of polyclonal antibody against protein VP7 of African horse sickness virus and development of IgM capture enzyme-linked immunosorbent assay for detecting African horse sickness. China Animal Health Inspection, 2014, 31(5): 70-73. (in Chinese)
[25] 杜方原, 冯春燕, 王彩霞, 仇松寅, 张永宁, 林祥梅, 吴绍强. 抗非洲马瘟VP7蛋白的小鼠单克隆抗体制备及其鉴定. 细胞与分子免疫学杂志, 2018, 34(12): 1125-1129.
DU F Y, FENG C Y, WANG C X, QIU S Y, ZHANG Y N, LIN X M, WU S Q. Preparation and identification of monoclonal antibodies against African horse sickness virus VP7. Chinese Journal of Cellular and Molecular Immunology, 2018, 34(12): 1125-1129. (in Chinese)
[26] 高志强, 张鹤晓, 赖平安, 谷强, 蒲静, 汪琳, 乔彩霞, 吴丹, 柏亚铎, 张伟. 非洲马瘟病毒VP7基因拼接、表达及重组ELISA方法的建立与初步应用. 畜牧兽医学报, 2008, 39(11): 1548-1553.
GAO Z Q, ZHANG H X, LAI P A, GU Q, PU J, WANG L, QIAO C X, WU D, BAI Y D, ZHANG W. Development and application of the recombinant ELISA based on the assembling and expression ofgene of African sickness virus. Chinese Journal of Animal and Veterinary Sciences, 2008, 39(11): 1548-1553. (in Chinese)
[27] 张睿, 张学尧, 赵小明, 马恩波, 张建珍. 飞蝗表皮蛋白Lm Knk3-5’的抗体制备及组织定位. 中国农业科学, 2022, 55(2): 329-338.
ZHANG R, ZHANG X Y, ZHAO X M, MA E B, ZHANG J Z. Antibody preparation and subcellular localization of lm Knk3-5’ in. Scientia Agricultura Sinica, 2022, 55(2): 329-338. (in Chinese)
[28] 李敏雪, 李剑男, 周红, 肖宁, 蔺辉星, 马喆, 范红结. 基于Sod C单克隆抗体的胞内劳森菌IPMA抗原检测方法的建立及应用. 中国农业科学, 2021, 54(20): 4478-4486.
LI M X, LI J N, ZHOU H, XIAO N, LIN H X, MA Z, FAN H J. Establishment and preliminary application ofIPMA antigen detection method based on sod C monoclonal antibody. Scientia Agricultura Sinica, 2021, 54(20): 4478-4486. (in Chinese)
[29] CRAFFORD J E, LOURENS C W, SMIT T K, GARDNER I A, MACLACHLAN N J, GUTHRIE A J. Serological response of foals to polyvalent and monovalent live-attenuated African horse sickness virus vaccines. Vaccine, 2014, 32(29): 3611-3616.
[30] WEYER C T, GREWAR J D, BURGER P, ROSSOUW E, LOURENS C, JOONE C, LE GRANGE M, COETZEE P, VENTER E, MARTIN D P, MACLACHLAN N J, GUTHRIE A J. African horse sickness caused by genome reassortment and reversion to virulence of live, attenuated vaccine viruses, South Africa, 2004-2014. Emerging Infectious Diseases, 2016, 22(12): 2087-2096.
[31] AKSULAR M, CALVO-PINILLA E, MARÍN-LÓPEZ A, ORTEGO J, CHAMBERS A C, KING L A, CASTILLO-OLIVARES J. A single dose of African horse sickness virus (AHSV) VP2 based vaccines provides complete clinical protection in a mouse model. Vaccine, 2018, 36(46): 7003-7010.
Development and Application of a Mab-Based iELISA for the Detection of Antibodies Against African Horse Fever Virus
GUO Kui, ZHANG ZeNan, WANG YaoXin, LI ShuaiJie, CHU XiaoYu, GUO Wei, HU Zhe, WANG XiaoJun
State Key Laboratory for Animal Disease Control and Prevention, Harbin Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Harbin 150069
【Objective】In order to effectively address the risk of introduction of African horse fever into China, this study aimed to develop an indirect ELISA (iELISA) antibody test specific for African horse fever virus (AHSV) based on monoclonal antibodies, so as to monitor the antibody status of African horse fever in horses in China.【Method】Firstly, Mabs against VP7 antigen were prepared by immunizing mice with the VP7 antigen. Secondly, the ELISA method was developed by optimizing the amount of coating Mab, antigen and secondary antibody concentrations. Negative sera (n=1 000) were used to establish the baseline for a negative population, and then the specificity and sensitivity of it was estimated. The stability of the method was determined by an accelerated test using AHSV-positive reference sera by three independent operators. 10 known positive sera and 400 negative sera for African horse fever were tested using the established method and compared with the results of foreign commercial kits. Finally, the method was tested on 947 clinical samples from 18 provinces or regions in China in 2021 to assess the risk of African horse fever in horses in China.【Result】 Five Mabs were obtained against the VP7 antigen of AHSV, and the 3G9 Mab had the best antigen capture performance. Using the 3G9 Mab as the capture antibody, an ELISA method for the detection of AHSV was established by optimizing different reaction conditions. A cut-off value of 0.25 was selected in AHSV iELISA. The sensitivity of ELISA method was comparable with that of commercial kits and the sensitivity of both methods was consistent. The intra-group coefficients of variation from 3 operators ranged from 3.19% to 7.02%, 0% to 3.11%, and 0.27% to 5.76%, respectively, and the inter-group coefficients of variation for the three operators ranged from 1.17 to 5.03%. The accelerated test at 37 °C demonstrated that the components of the testing kit had good stability over 7 days, thus demonstrating the stability of the method. The results showed that the agreement between the AHSV iELISA and commercial AHSV C ELISA kits were 100%. In this study, a serological survey on AHSV was performed by using 947 serum samples collected from 18 provinces of China in 2021, and the results showed that the positive rates were 0%. 【Conclusion】 A Mab-based AHSV iELISA method was established for the detection of AHSV antibodies, which had the good specificity and sensitivity, and could be a promising candidate tools for use serological surveillance for AHS.
African horse fever virus; monoclonal antibody; indirect ELISA; application

10.3864/j.issn.0578-1752.2023.16.015
2022-5-25;
2022-10-23
十四五国家重点研发计划重点专项(2021YFD1800500)
郭奎,E-mail:guokuiking@163.com。通信作者王晓钧,E-mail:wangxiaojun@caas.cn。通信作者胡哲,E-mail:huzher@126.com
(责任编辑 林鉴非)
