1例上臂植入式静脉输液港港体外露行港体移位的护理体会
2023-09-27邓安梦焦莹莹谭佳丽
陈 垚, 邓安梦, 焦莹莹, 谭佳丽
(陆军军医大学第一附属医院 肿瘤科, 重庆, 400038)
恶性肿瘤是危害患者健康的重大疾病。近几十年来,恶性肿瘤发病率每年保持约3.9%的增幅,死亡率每年保持2.5%的增幅[1]。世界卫生组织国际癌症研究机构(IARC)发布的癌症负担数据显示[2],2020年全球新增1930 万癌症患者和近1000 万例死亡病例。目前,基于完全植入式静脉通路装置(TIVAP)的静脉化疗仍是治疗恶性肿瘤的主要方式之一,具有安全、快速的特点,最大限度地减少患者对频繁建立血管通路的需求[3],为恶性肿瘤患者提供了理想的静脉化疗途径。但留置输液港仍然存在血气胸、心律失常、感染、血栓、港体外露、导管异位等诸多潜在并发症。港体外露是指静脉港座裸露在皮肤外面[4],其发生率为0.55%~2%[5-6]。本文总结1 例上臂植入式静脉输液港港体外露行港体移位的护理体会,现报告如下。
1 临床资料
患者女性,59 岁,身高148 cm,体质量40 kg,BMI:18.26,文化程度:初中。诊断:卵巢(腹膜)高级别浆液性癌。2019年植入5 次CVC 导管,行“多柔比星脂质体+奈达铂+贝伐珠单抗”方案静脉化疗联合靶向治疗。因病情进展患者于2021年1月再次入院,更换治疗方案为“紫杉醇脂质体+奈达铂”,输液工具为24 G 浅静脉留置针,用药后外周血管出现浅静脉炎,为推进后续治疗,经评估及取得患者同意后,于2021年1月12日在超声引导下于右侧贵要静脉行“上臂型植入式输液港置入术”。装置产品为:ZS2系列植入式给药装置(型号:ZS2-II-J-1.8/1.2-750,北京悦通医疗器械有限责任公司)。术后行X 片定位输液港导管尖端位置位于上腔静脉,平第6胸椎。术后第3天,行常规换药观察输液港植入处无异常,患者无主诉症状,医嘱予出院。患者院外拆线7 天后,自诉输液港港体部位突出皮肤(见图1 a),周围皮肤发红伴轻度疼痛,患者自行涂抹百多邦、口服头孢等抗炎药物,具体用法不详,局部症状无好转。
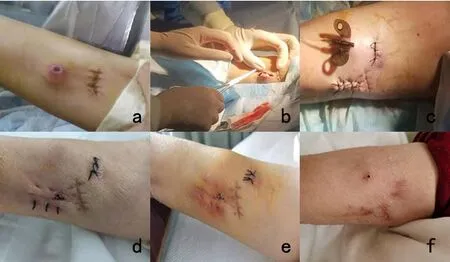
图1 输液港示图
2021年2月19日即术后第38天,患者再次入院治疗,查血常规示:白细胞2.87×1012/L,中性粒细胞1.30×1012/L。查体发现患者右上臂输液港港体部位出现约1 cm×1 cm 红肿,中间存在0.5 cm×0.5 cm 破溃,表面干燥,无分泌物,触摸皮温稍高,给予局部消毒,无菌敷料覆盖创面。入院第3 天行“原港体周围皮肤清创缝合+港体移位术”。
术前超声定位肱动脉、肱静脉及贵要静脉走形,避开走形血管。保证最大化无菌屏障,在原港体部位行纵行切口约3 cm(图1 b),取出港体及套管至无菌换药碗中,给予碘伏浸泡消毒,对原港体部位进行局部清创缝合。在原穿刺点下方约2 cm 行一长约2 cm 手术切口,避开血管,行皮下组织分离,见到静脉导管后从原隧道部位牵引出静脉导管,顿性分离切口下方的皮下组织,形成与输液港大小相当的新囊腔,填无菌纱布备用,测量穿刺点与囊腔之间的距离,在32.5 cm 处剪断导管,导管连接输液港,锁死卡扣固定输液港,并将输液港置入囊袋。无损伤针经皮穿刺输液港后,回抽回血良好,用肝素钠生理盐水封管,间断缝合皮下切口2 针及皮肤切口3 针,皮肤对合良好(图1 c),给予碘伏消毒后,无菌敷料固定、包扎。操作过程顺利,患者无不适,术后X片定位输液港导管尖端位置位于上腔静脉,约平第6胸椎处。
移位术后每日给予碘伏消毒行局部换药,无菌纱布覆盖,新港座部位切口及皮肤颜色正常,原港座部位皮肤仍发红,但切口伤口愈合好,于3月12日行拆线处理时发现1~2 个线眼处有少量淡黄色分泌物(图1 d),医嘱给予百多邦加碘伏加强换药,25日拆线后该处干燥,未见分泌物(图1 e)。1 个月后患者各切口全部基本愈合(图1 f),输液港保留成功,且未出现相关并发症。
2 处理措施
2.1 局部无感染
港体外露应及时处理,若输液港外露面积小于1/3 且不合并感染,首先应按照PICC 标准维护流程进行护理,按时换药,局部无菌敷料保护[5]。若港体外露位置为港座侧壁和注射座边缘,经换药后伤口仍未愈合,可行输液港囊袋修正术[7],即沿港座外露处切开皮肤,固定港座及导管连接处后,用血管钳沿原囊袋的内下侧进行钝性分离,扩大、扩深皮囊至合适大小,充分止血后将输液港座放入扩大的囊袋内,无张力缝合切口,无菌敷料包扎,并定期换药至切口愈合。若外露面积较大或港体外露部位位于港座正上方,考虑到种植囊袋伤口难以愈合,患者仍需继续使用输液港的情况下,可更换植入位置行港体移位术或转移皮瓣修复[8]等处理方式。港体移位术是在原穿刺点周围寻找合适位置,避开血管,制造新的囊腔。完全消毒术野后,切开原皮肤缝合处,取出港座,分离导管,分离过程中注意保护导管勿滑入体内,将港座浸泡消毒,使用皮下隧道工具在穿刺点与胸壁囊袋上方处制作皮下隧道,将导管远端连接皮下隧道工具沿隧道引出,选择合适的位置钝性分离制作新的囊腔,将输液港座与导管连接,充分消毒、止血后将原港座植入囊袋中,缝合切口。转移皮瓣修复术是根据港体外露处创面大小,严格按照“锐角60°,各边等长”的标准进行Limberg 皮瓣设计,常规消毒术野、局麻后,沿原设计切口切开皮肤达肌膜表面,切除缺血的皮肤组织,充分游离皮瓣,再次碘伏消毒及生理盐水冲洗伤口后用可吸收线间断全层缝合皮瓣。
2.2 局部存在感染
输液港外露合并感染,并且存在导管出口部位渗出物时,可使用拭子引流收集标本进行培养和革兰氏染色[9]。在明确患者感染来源之前,需尽可能地保留导管,根据2021 美国输液护理学会(INS)《输液治疗实践标准》[10],当患者除体温升高外,无其他与导管相关感染的确凿证据时,避免仅因怀疑感染而移除功能正常的中心血管通路装置(CVAD)。若病情恶化或脓毒血症持续存在或复发,应移除CVAD,避免给患者造成更严重的损害。
3 讨论
3.1 输液港港体外露的原因分析
3.1.1 血管生成受抑制:新生血管形是切口愈合的一个重要过程,新生血管可为损伤部位尤其受损的内皮细胞提供足够的氧气、营养物质等,并在生长因子的作用下生出毛细血管分支。血管内皮生长因子-A(VEGF-A)在血管生成中起关键作用,可调节正常及病理的血管生成。贝伐珠单抗通过中和 VEGF-A 阻断其与受体的结合,从而抑制新生血管形成[11]。相关研究[12-13]报道,贝伐珠单抗与伤口愈合延迟有关,但具体分子机制尚不完全清楚。国内学者张军军等[14]对21 例输液港植入术术后切口愈合不良的患者进行研究发现,贝伐珠单抗的使用是影响切口愈合不良的因素之一,可抑制血管内皮生长因子,延迟切口愈合,存在输液港放置切口裂开或无法愈合的风险。
3.1.2 皮下脂肪层薄弱:皮下脂肪层薄弱,肌肉张力小,港座处稍凸起于皮肤表面,若切口处缝合过紧,易造成输液港座上方皮肤张力过高。输液港注射座植入位置的囊袋若较为表浅,使用无菌纱布敷料固定后,在患者活动、用力、衣物摩擦等因素作用下,使皮肤表面张力持续增加,则易导致注射座皮肤缝合处裂开,甚至引发感染[15]。
3.1.3 患者机体免疫力下降:细胞毒性药物对增殖性、未成熟嗜中性粒细胞的干扰导致化疗后6~7 d 内(骨髓内嗜中性粒细胞成熟所需的时间)嗜中性粒细胞计数下降[16],引起患者免疫力下降,细胞修复能力降低,伤口愈合时间延长[17]。
3.1.4 潜在相关感染因素:置入静脉输液港后,操作人员会常规在港座上方置入无损伤针抽吸回血等操作以确定导管是否通畅、导管尖端是否在位,由于港座上部皮肤处为皮肤组织,穿刺操作会破坏港座上方皮肤的完整性;患者置入静脉输液港后伤口部位需要多次换药,如果在后期维护冲洗管道时,拔除静脉输液港针头后该处皮肤消毒不规范;或患者在输液港切口未彻底愈合期间沐浴、沾水等,均可能增加感染风险,造成港座上方皮肤从针眼处逐渐开始破溃。
3.2 输液港港体外露处理要点
本案例患者前期已使用5 周期的贝伐珠单抗,更换治疗方案后使用的细胞毒性药物导致骨髓抑制,增加了切口愈合延迟的风险;且患者体型消瘦,静脉化疗引起的恶心、呕吐、食欲下降导致营养不足,体质量进一步减轻,皮下脂肪层更加薄弱;院外管道维护时消毒不彻底、患者自我保护意识薄弱等因素,增加了感染的风险,最终导致了港体外露事件的发生。黎燕红等[18]报道的76 例恶性肿瘤患者经上臂静脉植入静脉输液港伤口均在术后10~12 d 拆线,无伤口裂开、愈合不良、伤口感染,无导管堵管、静脉炎、底座反转、导管分离、断裂等不良事件发生。该例患者虽然常规给予7 d 后拆线,但肿瘤细胞对机体长期消耗,患者代谢改变,存在个体差异,这也是导致港体外露发生的原因之一。
该例患者经过长时间常规换药,但港体外露处皮肤的自行愈合仍无明显进展,且港体外露部位位于港座正上方,面积较大,不适合通过囊袋修正术处理,而转移皮瓣修复术有可能会造成更大面积的皮肤损伤,延长愈合时间,引发更严重的并发症,故采取港体移位术进行修复。
港体外露作为输液港的并发症之一,不仅增加导管使用风险,还会影响患者的治疗,延长患者住院时间,给患者造成严重的心理负担及经济负担。恶性肿瘤患者在进行输液港植入前,应综合评估其基本情况、用药情况、营养状况、血流动力学指标、感染风险,加强预防,重点关注营养不良或合并慢性病的肿瘤晚期患者,出院后开展延续护理,定期随访。患者一旦发生港体外露,应及时处理,可根据港体外露面积和部位以及患者意愿采取针对性的处理措施。
患者知情同意:所有个体参与者或其监护人均签署知情同意书。
利益冲突声明:作者声明本文无利益冲突。
