≥80岁前列腺癌患者行腹腔镜前列腺癌根治术的临床疗效及安全性
2023-09-27张裕庆梁胜杰朱汝健
李 扬,张裕庆,方 恺,梁胜杰,刘 东,龚 旻,朱汝健
(复旦大学附属浦东医院泌尿外科,上海 201399)
在发达国家,前列腺癌已成为男性最常见的肿瘤之一[1]。随着寿命的延长,老年男性前列腺癌的发病率也在增加[2]。最新数据显示,前列腺癌患者中位发病年龄为66岁,大约20%的患者年龄>75岁[3]。然而,大多数前列腺癌的研究集中在年龄<75岁的患者中。
目前国内外前列腺癌诊疗指南虽未对前列腺癌根治术(radical prostatectomy,RP)的年龄作明确规定,但年龄是前列腺癌患者初始治疗方案的决定因素之一,对于预期寿命≥10年的患者建议施行手术。部分高龄(≥80岁)前列腺癌患者预期寿命可≥10年,同时高龄前列腺癌患者诊断为高危前列腺癌的可能性较大,其总体生存率(total survival,OS)及肿瘤特异性生存率(cancer specific survival,CSS)较低。目前国内外较少有对高龄前列腺癌患者接受腹腔镜下前列腺癌根治术(laparoscopic radical prostatectomy,LRP)的安全性、可行性及临床疗效等相关报道。本研究回顾性分析我院自2016年8月-2020年3月收治的≥80岁前列腺癌患者的围手术期参数及术后随访情况,探讨高龄前列腺癌患者接受LRP治疗的安全性和有效性。
1 资料与方法
1.1 一般资料选择2016年8月—2020年3月于复旦大学附属浦东医院因前列腺腺癌行LRP的18例≥80岁患者的临床资料进行回顾性分析。纳入标准为患者年龄≥80岁,确诊为前列腺腺癌,并且临床资料完整者。最终入组患者18例,临床资料包括患者年龄、前列腺癌特异性抗原(prostate cancer specific antigen,PSA)、总PSA(total PSA,tPSA)、穿刺Gleason评分、临床分期、术前国际前列腺症状评分(International Prostate Symptom Score,IPSS)、前列腺癌患者生存质量评分等(表1)。术前按照美国东部肿瘤协助组(eastern cooperative oncology group,ECOG)分级对患者一般情况分级,ECOG评分为0分者10例,1分者8例。所有患者穿刺前常规行前列腺增强核磁共振成像(magnetic resonance imaging,MRI)检查,对T2期及以上患者术前常规行全身核素骨显像检查,未见骨转移患者。
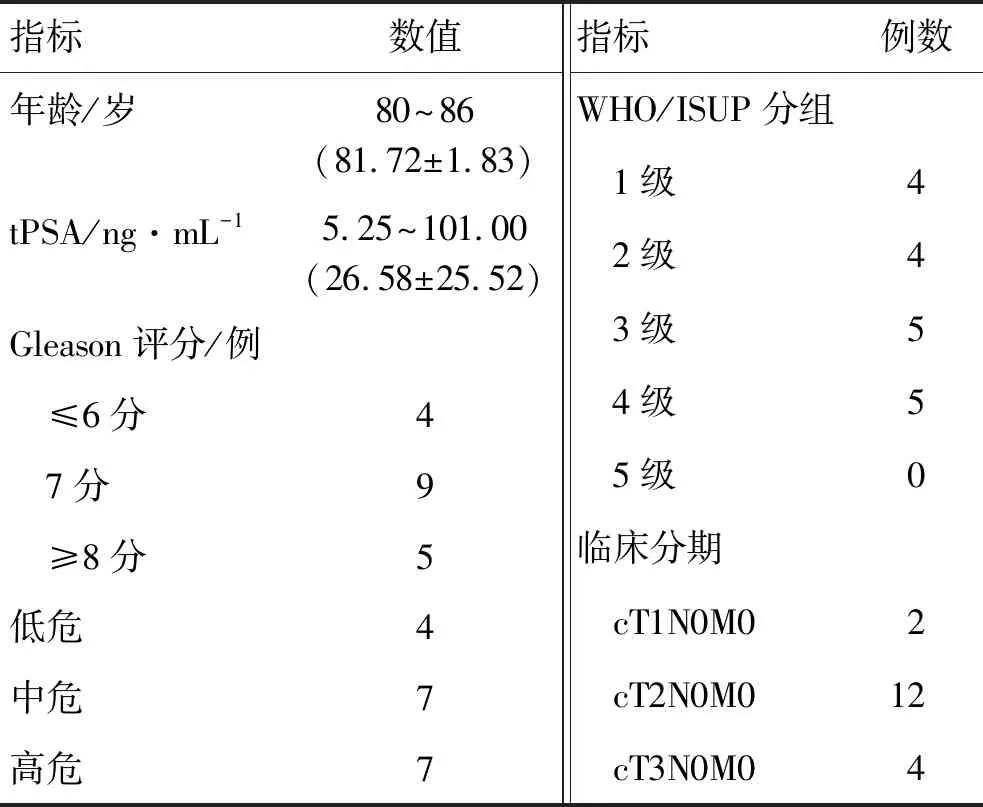
表1 18例≥80岁前列腺癌患者一般临床资料
1.2 手术方法所有患者术前均签署知情同意书,本次研究通过医院伦理审核。患者术前常规清洁灌肠,全麻后,取仰卧位,髋关节外展、膝关节屈曲、头低脚高位,首先于脐下缘皱襞处纵行切开约4 cm至腹膜外腔,使用手指对Retzius间隙进行扩张,手指引导下分别于右下腹和左下腹髂前上棘与脐连线腹直肌外缘作切口穿刺置入12 mm Trocar,脐下切口置入10 mm金属Trocar,缝合切口防止漏气。经脐下观察鞘置入30°腹腔镜,操作通道置入超声刀等器械,分离、扩大耻骨后间隙,切开盆内筋膜,待侧面可见肛提肌和前列腺尖部后,缝扎背深静脉丛(dorsal vasculature complex,DVC),辨认前列腺与膀胱颈分界,使用超声刀锐性分离,切开尿道,将尿管牵出,完全离断至两侧膀胱颈。切开膀胱前列腺肌后游离精囊及输精管,结扎双侧输精管,打开狄氏筋膜,游离至前列腺尖部,使用Hem-o-lok夹闭前列腺侧韧带,用超声刀离断,从前列腺两侧沿包膜游离至前列腺尖部,超声刀切开,游离出尿道,直视下用剪刀剪断尿道,完整切除前列腺,3-0可吸收倒刺线行膀胱及尿道全层连续吻合,留置F20三腔单气囊导尿管。术后常规置入耻骨后引流管,取出标本,缝合Trocar戳口,如术中发现肿瘤负荷较大,术野暴露不佳另于右侧髂前上棘内侧4 cm处置入5 mm Trocar协助手术。局限性低危前列腺癌患者(PSA<10 ng/mL,Gleason≤6分,临床分期T1~2a期)予以保留神经血管束(neurovascular bundle,NVB),根据术前病理及术中情况予以保留双侧或单侧NVB。根据《中国泌尿外科和男科疾病诊断治疗指南》决定是否行淋巴结清扫术。
1.3 观察指标
1.3.1患者手术情况、术后尿控及肿瘤学随访 记录患者手术及术后情况并对术后1、3、6个月和1年对患者控尿功能恢复情况进行随访。尿失禁分级:Ⅰ级为当咳嗽或突然增高腹压时,偶尔有尿液自尿道外口漏出现象;Ⅱ级为用力或咳嗽均有尿液自尿道外口漏出现象;Ⅲ级为站立、行走即出现尿液自尿道外口漏出现象;Ⅳ级为即使卧床时也出现尿液自尿道外口渗漏现象。术后定期检测血清PSA水平,每半年行胸片、全身骨扫描等检查;术后连续2次血清PSA水平超过0.2 ng/mL,提示前列腺癌生化复发,记录随访患者无生化复发生存率、肿瘤特异性生存率和总生存率。
1.3.2生活质量评估 前列腺癌治疗的功能评估(functional assessment of cancer therapy-prostate instrument,FACD-P)广泛用于前列腺癌患者生活质量评分,包括生理状况、社会/家庭状况、情感状况、功能状况、前列腺癌模块部分,共5个维度,每项1分,分数从高到低,得分越高,说明身体状态越好[4]。根据IPSS表记录患者治疗前后排尿情况变化。
2 结 果
2.1 患者手中及术后情况所有患者均顺利完成手术,无中转开放手术。各参数资料详见表2。

表2 18例≥80岁前列腺癌患者手中及术后术后参数资料
2.2 患者随访情况术后随访22~65个月,平均(46.27±14.34)个月。在随访过程中,3例出现生化复发,给予比卡鲁胺、诺雷得联合雄激素阻断治疗,随访过程中无患者死亡。
术后1、3、6个月及1年患者尿失禁率分别为50.00%(9/18)、33.33%(6/18)、16.67%(3/18)、5.56%(1/18)。术后尿控恢复时间1~220 d,平均(45.94±51.52)d。与患者术前IPSS评分(20.28±6.04)分相比,IPSS评分术后3个月(15.33±4.19)分(t=5.735,P=0.007)、6个月(12.67±3.24)分(t=4.714,P<0.001)、1年(10.94±3.35)分(t=4.714,P<0.001)均显著降低。
对比术前及术后6个月FACD-P测量评分显示:患者术后6个月总体健康评分较术前增高,其中情感状况、社会/家庭状况、前列腺癌模块部分3个维度评分高于术前,差异具有统计学意义(P<0.05,表3)。

表3 18例≥80岁前列腺癌患者手术前后FACD-P测量评分比较
3 讨 论
尽管目前大多数指南建议预期寿命>10年的前列腺癌患者可施行RP,但大多数≥80岁患者不管预期寿命达到多少很少施行RP。≥80岁前列腺癌患者诊断为高危前列腺癌的可能性较大,其OS及CSS较低,一些学者已经证实了高危前列腺癌患者接受观察等待具有更高的肿瘤相关死亡率[3],因此有学者认为RP适合于≥80岁前列腺癌患者。
一项国外的回顾性研究显示,>75岁的前列腺癌患者更可能接受内分泌治疗(45%)、外放射治疗(21%)、近距离照射治疗(14%),远远多于RP(3%)[5]。尽管单纯RP和外放射治疗联合内分泌治疗在高危前列腺癌患者具有相似的长期疗效(系统进展和肿瘤特异性死亡率),但是外放射治疗联合内分泌治疗的全因死亡率远远大于单纯RP[6]。因此,≥80岁前列腺癌患者如能耐受全身麻醉,没有必要杜绝RP。YAMADA等[7]评估了高龄(≥75岁)前列腺癌患者与较年轻前列腺癌患者接受根治术后生化无复发率、CSS、OS、住院时间比较差异均无统计学意义,且术后1年尿控恢复率高龄组与较年轻组分别为89.5%和86.5%,差异亦无统计学意义(P=0.790)。RYU等[8]通过比较男性前列腺癌患者(>75岁),在接受RP及内分泌治疗术后生存率、术后并发症差异,得出经过选择的前列腺癌患者在接受RP后,其术后CSS及OS与内分泌治疗组相比,无明显统计学差异,但内分泌治疗组严重并发症发生率较RP组增高。TOGASHI等[9]通过一项回顾性研究分析了752例前列腺癌患者行LRP的资料:其中<70岁者469例、70~74岁者216例、≥75岁者74例;平均随访47个月,各组术后无生化复发生存率、CSS、OS比较差异无统计学意义;术后1年总体满意率≥75岁者组(27%)显著高于<70岁者组(15%),差异有统计学意义(P=0.045)。
WANG等[10]通过评价≥75岁前列腺癌患者,在接受RP及外放射治疗术后生存率的差异,得出高危前列腺癌患者接受RP及外放射治疗术后10年OS分别为60.1%vs.40.9%,前列腺癌特异生存率(prostate cancer specific survival,PCSS)分别为90.6%vs.83.4%;极高危前列腺癌患者接受RP及外放射治疗术后10年OS分别为55.9%vs.33.3%,PCSS分别为82.4%vs.75.6%,提示高龄的高危或极高危前列腺癌患者接受RP比接受外放射治疗具有更好的生存受益。DELL’OGLIO等[11]回顾性分析了234例≥80岁接受RP的前列腺癌患者随访资料:80~81岁者125例(53.4%),>82岁者109例(其中14例>86岁);中位随访时间57(27~99)个月,80~81岁和>82岁者10年OS为62%vs.39.6%,进一步分层分析发现80~81岁且查尔森合并症指数(Charlson Comorbidity Index,CCI)为0,其10年OS为67.9%;认为LRP作为高龄前列腺癌患者的初始治疗仍具有重要意义,高龄并非施行LRP的绝对禁忌证。张帆等[12]回顾性分析了北京大学第三医院泌尿外科收治的≥80岁前列腺癌患者的围手术期参数、术后控尿功能恢复及肿瘤学预后,术后随访10~118个月,中位随访时间42个月,术后3、6个月及1年≥80岁前列腺癌患者行LRP术后的尿控率分别为64.7%(33/51)、82.4%(42/51)和92.2%(47/51),文献指出对选择恰当的≥80岁前列腺癌患者施行LRP是可行的,并且远期肿瘤控制情况良好。王可屹等[13]回顾性分析了40例≥80岁前列腺癌患者接受RP的相关资料,术后随访时间2~36个月,平均(11.03±3.61)个月,尿控恢复时间1~18个月,平均(4.26±1.65)个月,术后有5例接受雄激素剥夺治疗(androgen deprivation therapy,ADT)、7例接受ADT同时进行局部外放射疗,术后病理报告1例切缘阳性,尿道狭窄2例;该研究认为≥80岁且健康状况良好的前列腺癌患者接受RP是安全可行的,同时需要在手术获益和手术风险之间进行综合考虑。
但现有方法很难对个体患者预期寿命做出精确评估,本研究使用WHO’Life Tablesby Country量表对患者预期寿命做出评估。另外步速(测量方法为自站立状态开始以平时步幅行进6 m)是目前判断预期寿命较好的单一因素,对于75岁的老年人,步速<0.4 m/s者10年生存率为19%,步速≥1.4 m/s者10年生存率为87%[14]。本研究术前充分告知患者及家属病情及治疗方式,所有患者家属知情并签订知情协议书。其中T3期患者4例,患者术前下尿路刺激症状明显,患者术前无其他合并症,营养状态、体能状态均较好,且患者及家属有强烈手术意愿。
本研究所有患者均完成手术,无中转开放手术。2例发生围手术期并发症,术后尿瘘、淋巴瘘各1例,均为cT3bN0M0期患者,淋巴瘘可能与术中行扩大淋巴结清扫有关,尿瘘可能与术中膀胱尿道吻合欠佳有关,尿漏患者术后第15天改善,术后第16天予以拔除导尿管;淋巴瘘患者术后第13天改善,复查CT盆腔未见积液后,术后第14天予以拔除盆腔引流管。围手术期并发症发生率为11.11%(2/18),且均为Clavien分级Ⅰ~Ⅱ级并发症。术后切缘阳性3例,术前均为T3患者,可能与术前基线血清PSA水平(其中1例血PSA高达101.0 ng/mL)、Gleason评分、前列腺穿刺阳性针数、TNM分期有关。
尿失禁是LRP术后最主要的并发症之一,严重影响患者的生活质量。本研究术后1、3、6个月及1年尿失禁率分别为50.00%(9/18)、33.33%(6/18)、16.67%(3/18)、5.56%(1/18),与其他研究相比,本组高龄患者早期控尿功能恢复较差,可能与高龄患者身体机能恢复慢、术中仅4例患者行保留NVB治疗有关,但6个月以后尿控率与其他研究相当,控尿功能的恢复与术中注意保留功能尿道长度、保留膀胱颈口、尿道前后壁的重建[15-19]及术后早期行提肛锻炼有关[20]。
随着人口老龄化及前列腺癌发病率的逐渐升高,前列腺癌疾病负担日益增大,前列腺癌患者的生存质量日益受到关注,但国内外很少有文献对≥80岁接受RP术患者的生存质量进行研究。本研究通过对18例≥80岁前列腺癌患者使用FACD-P量表评价生存质量显示:患者术后6个月总体健康评分(包括情感状况、社会/家庭状况、前列腺癌模块部分)较术前明显增高,且差异具有统计学意义。本组研究显示,多数患者术前具有较高的IPSS评分,术后3月、6月、1年再次进行IPSS评分,较术前比较明显下降,且差异具有统计学意义,这也说明LRP术能使≥80岁前列腺癌患者生活质量得到改善。
尽管本研究证实了≥80岁且健康状况良好的前列腺癌患者接受LRP安全、可行、有效,但也存在不足之处,如属于单中心回顾性研究,病例数较少和随访时间较短,因此研究结论尚需进一步的长期随访及大样本量的前瞻性临床研究证实。