MRI-DWI联合血清PSA诊断前列腺癌的准确率研究
2023-09-27王帅徐光明许彬南京医科大学附属无锡人民医院江苏无锡214000
王帅,徐光明,许彬(南京医科大学附属无锡人民医院,江苏 无锡 214000)
前列腺癌是一种临床常见恶性肿瘤,在中老年人群中的发病率较高[1]。前列腺炎、前列腺增生、前列腺癌是目前临床公认的诱发男性排尿障碍的重要因素,患者普遍存在尿潴留、排尿困难等症状[2]。虽然良性前列腺病变与前列腺癌临床症状相似,但治疗方案及预后截然不同。因此,及早对前列腺病变良、恶性做出准确的诊断,对于临床展开针对性治疗具有重要的指导意义。磁共振弥散加权成像(MRI-DWI)是一种分子运动敏感成像技术,通过检测表观扩散系数(ADC)值可更加准确地反映病灶组织微血管灌注,在良、恶性病变鉴别诊断中具有重要参考价值[3-4]。前列腺特异性抗原(PSA)是一种存在于精液的激肽酶家族蛋白,它主要由前列腺上皮细胞合成、分泌,多被应用到前列腺癌诊断中[5]。但单一血清PSA检测受前列腺炎等因素的影响,诊断特异性较差,具有一定的局限性[6]。基于此,为探究MRI-DWI联合血清PSA诊断前列腺癌的准确率,本文选定无锡市人民医院2020年1月-2023年1月就诊的118例前列腺病变患者进行研究,具体报道如下。
1 资料与方法
1.1 一般资料 医院伦理委员会已审批此次研究,选定无锡市人民医院2020年1月-2023年1月就诊的118例前列腺病变患者,年龄在32-71岁,平均(51.62±5.04)岁;体重指数(BMI)在19-27kg/m2,平均(23.11±1.16)kg/m2。(1)纳入标准:①均伴有不同程度排尿困难、尿潴留等症状。②血清前列腺特异性抗原(PSA)异常增高,>4ng/mL。③年龄>18周岁。④视听、沟通能力正常,配合度良好。⑤重大脏器肾、肝等功能无异常。⑥既往无前列腺手术史。(2)排除标准:①近3个月接受过放化疗等对症治疗者。②合并全身严重感染性疾病者。③MRI检查成像质量不佳者。④合并免疫缺陷性疾病者。⑤存在MRI检查禁忌证者,例如植入心脏起搏器、心脏支架者。⑥留置尿管者。⑦存在药物依赖史、吸毒史、酒精成瘾史者。⑧同期参与其他研究或中途因病情变化退出者。⑨合并其他恶性肿瘤者。
1.2 方法 ①MRI-DWI检查:采用1.5T超导MRI检查仪(型号:Signa;生产企业:美国GE公司)检查,接收线圈为腹部相控阵16通道线圈,检查前6h告知患者保持空腹,指导患者采取仰卧位,对精囊、前列腺腺体进行矢状位、冠状位、轴位扫描,单次激发SE-EPI序列,参数设置:T1WI:TR是640ms,TE是11ms,层厚是8mm,激励次数是2次,层间距是2mm,FOV是28×28,矩阵是320×224;T2WI:TR是3600ms,TE是80ms,层厚是4mm,激励次数是4次,层间距是1mm,FOV是28×28,矩阵是320×224。DWI:TE是93ms,TR是4800ms,激励次数是4次,层间距是1mm,层厚是4mm,FOV是28×28,矩阵是96×128,扩散敏感系数(b值)取1000s/mm2、1200s/mm2、1500s/mm2,将所获得的图像传输至工作站,分析病灶位置,判断是否存在前列腺外侵,例如骨转移、淋巴结、膀胱受侵、精囊腺受侵、神经血管束、癌肿突破包膜等,选择感兴趣区域(ROI),面积在30-40mm2,避开尿道、精囊腺等囊变、坏死、出血区域及脂肪,测量ADC值,最终记录值是连续测量3次的均值。②血清PSA检测:抽取受检者5mL空腹静脉血,离心10min,离心速率3800r/min,离心半径10cm,将上层清液分离后保存在-80℃环境中待检,检测仪器选用全自动电化学发光免疫分析仪(型号:LC-2800;生产企业:南京岚煜生物科技有限公司),采用化学发光免疫分析法检测PSA表达量,试剂盒均由上海康朗生物科技有限公司提供。
1.3 观察指标 将手术病理诊断结果作为本次研究金标准,比较MRI-DWI、PSA、MRI-DWI+PSA诊断前列腺癌准确率、灵敏度、特异度。比较良、恶性病变组表观扩散系数(ADC)值、血清PSA水平。
1.4 统计学方法 数据处理选择SPSS26.0软件,计量资料采用t检验,以±s表示,计数资料用χ2检验,以[n(%)]表示,Kappa检验MRI-DWI、PSA、MRI-DWI+PSA与金标准的一致性,P<0.05表示对比存在差异。
2 结果
2.1 MRI-DWI、PSA、MRI-DWI+PSA诊断效能比较 手术病理诊断确诊72例恶性、46例良性。MRI-DWI+PSA诊断准确率(95.76%)、灵敏度(95.83%)、特异度(95.65%)均高于MRI-DWI(79.66%、83.33%、73.91%)、PSA(68.64%、72.22%、63.04%),P<0.05,Kappa检验MRI-DWI、PSA与金标准的一致性均一般(Kappa值=0.675、0.601),MRI-DWI+PSA与金标准的一致性较好(Kappa值=0.794),见表1、表2。
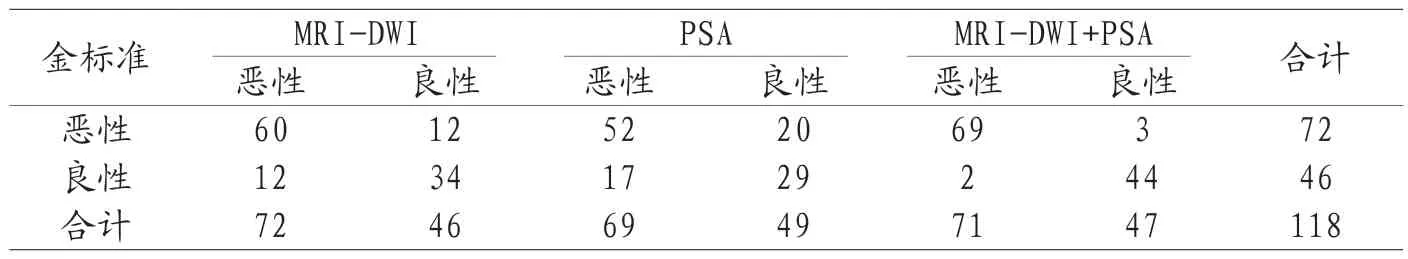
表1 MRI-DWI、PSA、MRI-DWI+PSA诊断结果
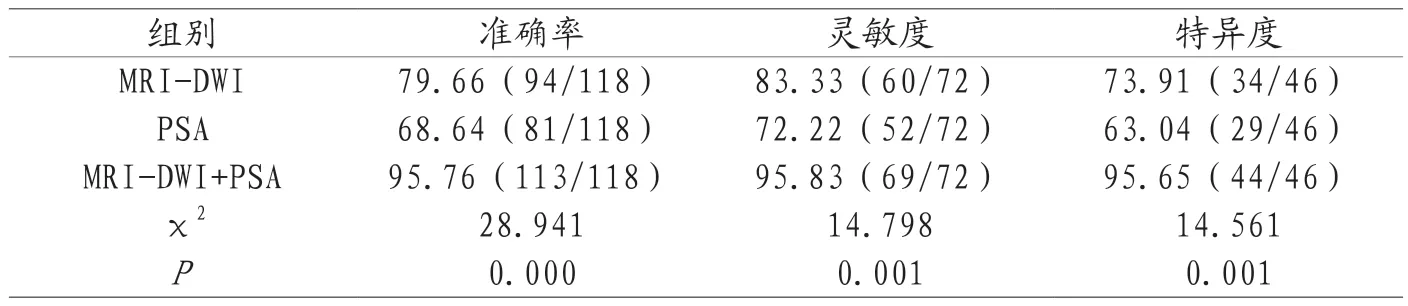
表2 MRI-DWI、PSA、MRI-DWI+PSA诊断效能比较[n(%)]
2.2 良、恶性病变组ADC值、血清PSA水平比较 恶性病变组ADC值低于良性病变组,P<0.05,恶性病变组血清PSA水平高于良性病变组,P<0.05,见表3。
表3 良、恶性病变组ADC值、血清PSA水平比较(±s)
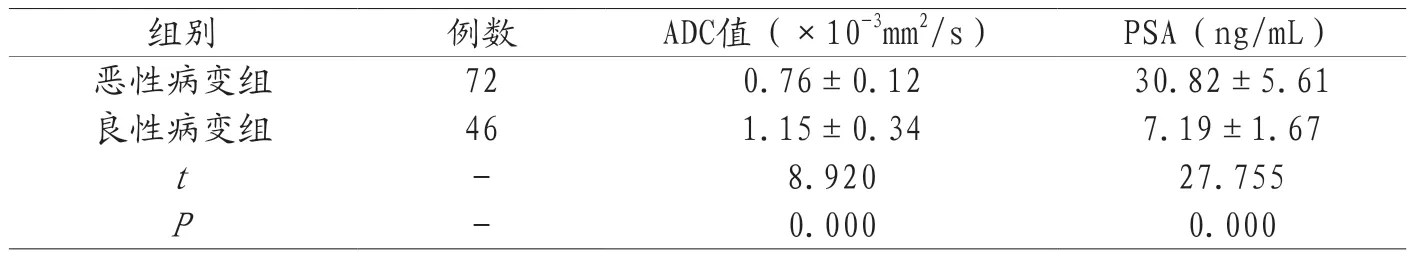
表3 良、恶性病变组ADC值、血清PSA水平比较(±s)
组别例数ADC值(×10-3mm2/s)PSA(ng/mL)恶性病变组720.76±0.1230.82±5.61良性病变组461.15±0.347.19±1.67 t-8.92027.755 P-0.0000.000
3 讨论
前列腺癌是指发生于前列腺上皮的恶性肿瘤,具有一定的家族遗传性,随着年龄的增长,前列腺癌的发病率会逐年增高[7]。缺乏锻炼、肥胖、高脂肪饮食等均为诱发前列腺癌的危险因素[8]。相关调查显示:在我国男性癌症的发病率中,前列腺癌居于第二位,仅次于膀胱癌[9]。前列腺癌的潜伏期较长,大部分患者发病初期临床症状缺乏特异性,当疾病确诊时,基本发展到了中晚期,错过了最佳手术治疗时机,预后普遍较差[10-11]。直肠指检、临床症状等检查存在一定的主观性,诊断结果容易受到医生工作经验、综合能力等因素的影响,具有一定的局限性[12]。手术病理诊断是临床鉴别诊断良、恶性肿瘤的金标准,但因存在创伤性大、费用昂贵、不可重复检查等不足而未被广泛应用到前列腺病变筛查诊断中[13]。因此,寻求一种操作方便、安全可靠、准确率高的诊断技术,提高前列腺癌诊断准确率成为目前临床高度关注的内容。
本研究显示:MRI-DWI+PSA诊断准确率(95.76%)、灵敏度(95.83%)、特异度(95.65%)均高于MRI-DWI(79.66%、83.33%、73.91%)、PSA(68.64%、72.22%、63.04%),P<0.05。提示MRI-DWI+PSA可提高前列腺病变鉴别诊断效能。分析如下:MRI-DWI是在传统MRI检查基础上发展而来的一种功能成像诊断技术,通过观察水分子扩散运动,分析病灶信号、组织形态等[14]。MRI-DWI与传统MRI相比,分辨率明显提高,可将前列腺包膜以及周边组织结构、形态等清晰地显示出来,在前列腺癌定位、定性诊断中具有重要参考价值[15]。健康男性机体大部分PSA会随着精液排出,只有少量会释放到血液中[16]。一旦前列腺发生癌变或受到增生、炎症等因素的影响,大量的PSA会释放到血液中,从而导致血清PSA表达量异常增高[17]。本研究将MRIDWI与PSA联合检查,结果发现联合检查可提高前列腺癌诊断效能,弥补了单一检测的不足,在前列腺癌诊断中具有广阔的应用前景。
本研究显示:恶性病变组ADC值低于良性病变组,恶性病变组血清PSA水平高于良性病变组,P<0.05。提示前列腺癌患者ADC值呈异常低表达,血清PSA水平呈异常高表达,临床可将其作为鉴别诊断病变良、恶性的参考依据。前列腺癌是一种恶性肿瘤,由于癌细胞活跃性强,密度较高,血管、组织间隙较小,生物膜结构对水分子扩散运动现象限制作用更为明显,从而导致ADC值降低[18]。前列腺癌患者由于癌细胞数目较多,机体会分泌大量的PSA,透过血脑屏障,进入到血液循环中,从而导致血清PSA表达量异常增高。在王环震[19]等学者的研究中,前列腺癌组血清PSA水平(30.45±3.18)ng/mL高于前列腺良性增生组(4.96±0.52)ng/mL,P<0.05,接近本研究结果,证实了前列腺癌患者血清PSA水平表达量较高。
综上所述,MRI-DWI+PSA可提高前列腺癌诊断准确率、灵敏度及特异度,定量检测ADC值有助于临床鉴别诊断前列腺病变的良、恶性,并能指导临床结合个体差异有针对性地制定治疗方案。
