伊利石对Sr的反应性吸附及机理表征
2023-09-27蔡伟海左锐刘月鹏王金生杜璨徐云翔武子一
蔡伟海, 左锐*, 刘月鹏, 王金生, 杜璨, 徐云翔, 武子一
(1.北京师范大学水科学研究院, 北京 100875; 2.地下水污染控制与修复教育部工程研究中心, 北京 100875; 3.河北省生态环境保护技术服务中心, 石家庄 050051; 4.中国地质调查局发展研究中心, 北京 100037)
核能开发利用所产生的放射性废物的妥善处置问题不容忽视[1]。90Sr是放射性核废物中的典型组分之一,具有半衰期长、迁移速率快等特点,且具有生物毒性和化学毒性,容易在环境介质中迁移并通过生物链累积[2],已被国际原子能机构认定为高风险放射性核素之一。目前,含Sr废物的处置方法有化学沉淀法、离子交换法、地质处置法和静电吸附法等,其中地质处置法是目前世界上公认的处理含90Sr等放射性核素的核废物最为安全有效的处置方法[3]。
地质体等天然屏障介质对放射性核素的吸附特性是评价处置库安全性的重要内容之一。目前,相关学者针对不同地质处置介质对Sr的吸附开展了大量研究,如徐东辉等[4]研究了Sr在花岗岩裂隙填充物中的吸附行为,结果表明Sr在该吸附体系中为单分子层吸附;Lihareva等[5]研究了Sr在沸石中的吸附动力学特征,发现颗粒内扩散作用和液膜扩散作用均可影响其吸附过程;Du等[6]研究表明离子交换作用和络合作用在黏土岩吸附Sr过程中起到重要作用。地质介质对放射性核素的吸附行为研究虽然已经取得一定的进展,但是不同类型的吸附介质对核素的吸附行为特征及机理仍有待进一步探索。黏土矿物具有吸附性强、比表面积大等特点,是一种良好的吸附材料,也是核废物处置库围岩中的常见矿物。前人对不同黏土矿物对Sr的吸附行为开展了相应研究,如高岭石、蒙脱石、膨润土和凹凸棒等,研究发现膨润土和高岭石对Sr的吸附行为符合准二级动力学模型[7-8],可自发进行;蒙脱石对Sr的吸附作用以表面络合和离子交换反应为主[9];方沸石对Sr的吸附过程为单分子层吸附,以化学吸附为主[10]。但是,目前国内有关伊利石对Sr的吸附研究较少,关于伊利石对Sr的吸附研究仍不全面[11],对吸附机理的表征刻画研究仍不够深入。
现以伊利石为吸附介质,通过静态吸附实验探究伊利石对Sr的吸附行为,结合吸附动力学模型分析其吸附过程特征,借助扫描电子显微镜(scanning electron microscope,SEM)、X射线衍射(X-ray diffraction,XRD)、傅里叶变换红外光谱仪(Fourier transform infrared spectrometer,FTIR)和X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)等多种表征分析方法探究和刻画伊利石对Sr的吸附机理。
1 材料与方法
1.1 实验材料
苏宏图地处内蒙古高原西部,行政区划属内蒙古自治区阿拉善盟阿拉善左旗管辖,是中国高放废物备选场址之一[12]。该地区黏土岩分布广泛,对其间的黏土岩X射线衍射分析(表1),可知黏土岩样品中的主要黏土矿物为伊利石[13],因此选取伊利石为吸附介质。

表1 黏土岩样品中黏土类矿物XRD结果分析表Table 1 Analysis of XRD results of clay minerals in clay rock samples
1.2 实验方法
依据参照废物处置场中的含Sr废水浓度和已有实验研究[6,14],静态吸附实验中Sr的浓度设定为20 mg/L。此外,由于苏宏图处置场所在区域地下水的pH为6~9,且在温度10~40 ℃时,地下水中成分的变化不大。因此,实验初始条件设置为pH=7,温度为25 ℃。
采用恒温震荡批处理方法进行吸附实验:向锥形瓶(250 mL)中加入反应介质(2.50 g)、250 mL Sr储备液(20 mg/L),摇匀后待用。用忽略体积的NaOH溶液(0.1 mol/L)和HCl溶液(0.1 mol/L)调节pH为7左右。将锥形瓶放置于恒温摇床内,相关参数设置为25 ℃、200 r/min。根据预实验结果将吸附时间设置为4 320 min。吸附结束后取上清液离心,收集样品,采用电感耦合等离子体发射光谱法(inductively coupled plasma atomic emission spectrometry,ICP-AES)检测Sr的吸附溶液浓度。
1.3 数据分析方法
1.3.1 数据计算分析方法
借助于吸附质的质量浓度随时间的变化关系分析吸附发生的过程,主要采用的吸附动力学模型主要为:准一级动力学模型[15]、准二级动力学模型[16]、Elovich模型[17]和颗粒内扩散模型[18]。
单位吸附量公式为
(1)
式(1)中:Qt为吸附量,mg/g;C0为含Sr溶液的初始浓度,mg/L;Ct为吸附后含Sr溶液的浓度,mg/L;V为吸附溶液的体积,L;m为吸附介质的质量,g。
吸附率公式为
(2)
式(2)中:R为吸附率,%。
Pseudo-first-order (PFO)公式为
qt=qe(1-e-kft)
(3)
式(3)中:qt为t时刻的吸附量,mg/g;qe为平衡时的吸附量,mg/g;kf为速率常数,min-1。
Pseudo-second-order (PSO)公式为
(4)
式(4)中:ks为速率常数,g/(mg·min)。
Elovich公式为
(5)
式(5)中:α为初始阶段的吸附率,mg/(g·min);β为与化学吸附活化能和表面覆盖度均相关的系数,g/mg。
Intra-particle Diffusion公式为
(6)
式(6)中:Kp为速率常数,mg/(g·min1/2);C为常数,mg/g,由边界层厚度控制。
1.3.2 微观表征分析方法
使用扫描电子显微镜(SEM,Hitachi SU8010)观察伊利石样品在吸附前后的表面形态结构变化;利用多功能X射线衍射仪(TTR Ⅲ,日本理学)测定吸附前后样品在矿物组成上的变化;使用傅里叶红外光谱仪(IRAffinity-1)测定吸附前后样品在官能团方面的变化;通过光电子能谱仪(Thermo Scientific K-Alpha)测定实验前后元素种类及化学价态的变化。
2 结果与讨论
2.1 吸附动力学过程分析
根据伊利石对Sr的吸附率和单位吸附量随时间的变化(图1)可知,伊利石对Sr的吸附性较强,在实验初始阶段,吸附率迅速增加,当吸附时间为1 h时达到最大值为77.15%,此时单位吸附量为1.543 mg/g;随后,吸附率和单位吸附量略有下降后逐渐趋于稳定,于240 min时达到吸附平衡状态,吸附率为76.65%。
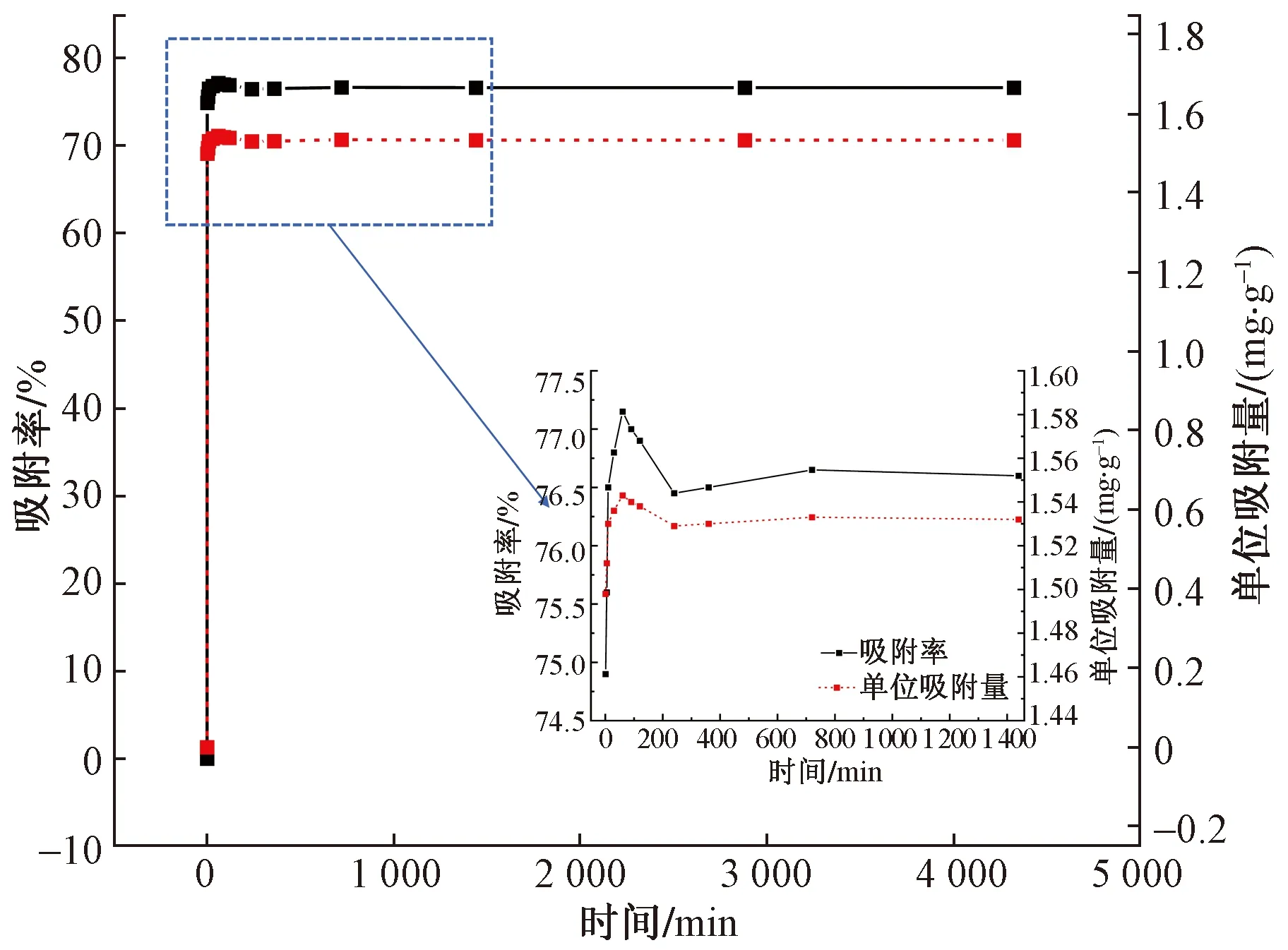
图1 伊利石对Sr的吸附率和单位吸附量随时间的变化Fig.1 Adsorption percentage and unit adsorption amount of Sr on illite changes over time
为进一步探究伊利石对Sr的吸附行为与吸附机制,用准一级动力学模型、准二级动力学模型、Elovich模型、颗粒内扩散模型4种模型对实验数据进行拟合,拟合结果如表2所示。

表2 伊利石对Sr的吸附动力学拟合结果表Table 2 Table of fitting results of adsorption kinetics of Sr on illite
分析可知,准一级(PFO)、准二级(PFO)和双曲正切模型对伊利石吸附Sr的数据拟合效果最好,相关系数R2>0.998,且根据这3个模型求得的qe与实验所得的平衡吸附容量误差最小,残差平方和为0.003 9。据此推测,伊利石对Sr的吸附行为受到扩散作用控制,且物理吸附作用和化学吸附作用并存,这一过程与Sr在凹凸棒土、膨润土和蒙脱土中的吸附行为类似[19]。结合伊利石对Sr的吸附百分数随时间的变化,可知伊利石对Sr的吸附可分为两个阶段:在实验初期(≤ 60 min)黏土岩表面有大量的吸附位点,因而吸附速率较快,在短时间内大量Sr被吸附到黏土岩表面,这一阶段的主要的驱动力为液膜扩散作用,以物理吸附作用为主[20];随吸附时间的增加,伊利石表面的吸附位点减少,因而吸附速率降低,Sr与黏土岩表面发生离子交换、络合反应等,这一阶段主要以化学吸附为主[21]。此外,由拟合结果可知颗粒内扩散模型并不能将实验数据很好地拟合,因此伊利石对Sr的吸附行为不遵循颗粒内扩散模型,即黏土岩中对Sr的吸附限速步骤并非颗粒内扩散作用。
2.2 微观表征分析
2.2.1 微观结构分析
利用扫描电子显微镜观察伊利石在吸附前后的微观结构变化如图2所示。吸附开始前,伊利石微观形貌是由粒径较小的颗粒物质、粒度较大的块状构造和不规则的片层结构组合而成的复杂结构,表面松散,为典型的微孔材料,有孔隙发育且数量较多,其粗糙多孔的结构为吸附Sr提供了大量的吸附点位。

图2 伊利石吸附Sr前后的SEM图谱特征Fig.2 SEM characteristics of illite before and after adsorption of Sr
对比伊利石吸附Sr前后的样品微观形态可知,吸附作用使伊利石表面发生显著变化。吸附反应结束后,伊利石仍以块状构造和片层结构为主但表面的粗糙多孔结构明显减少,小颗粒构造减少或消失,表面更加光滑。究其原因,主要为伊利石在与Sr溶液反应过程中发生了溶解和沉淀作用,吸附的Sr占据了其表面的吸附点位,使得伊利石表面的小颗粒物质减少,结构更为光滑。
2.2.2 矿物种类变化分析
利用X射线衍射仪测定伊利石的矿物组成,并将得到的相关数据通过MDI Jade9处理,所得吸附前后伊利石的XRD图谱如图3所示。XRD图谱表明伊利石中的主要矿物种类为石英(SiO2)、伊利石[KAl(Mg0.2Al0.8)(Al0.42Si3.28)O10(OH)2]和斜长石[Na0.98Ca0.02(Al1.02Si2.98O8)]。其中石英特征衍射峰2θ分别为20.86°、26.64°、36.544°、39.465°、45.793°、59.960°、68.318°,对应的晶面分别为(100)、(101)、(110)、(102)、(201)、(211)、(301);伊利石对应的衍射峰位置为21.771°(021面)、24.479°(112面)、29.379°(112面);斜长石含量较少,对应的特征衍射峰2θ为27.912°和42.463°,晶面分为(040)和(060)。
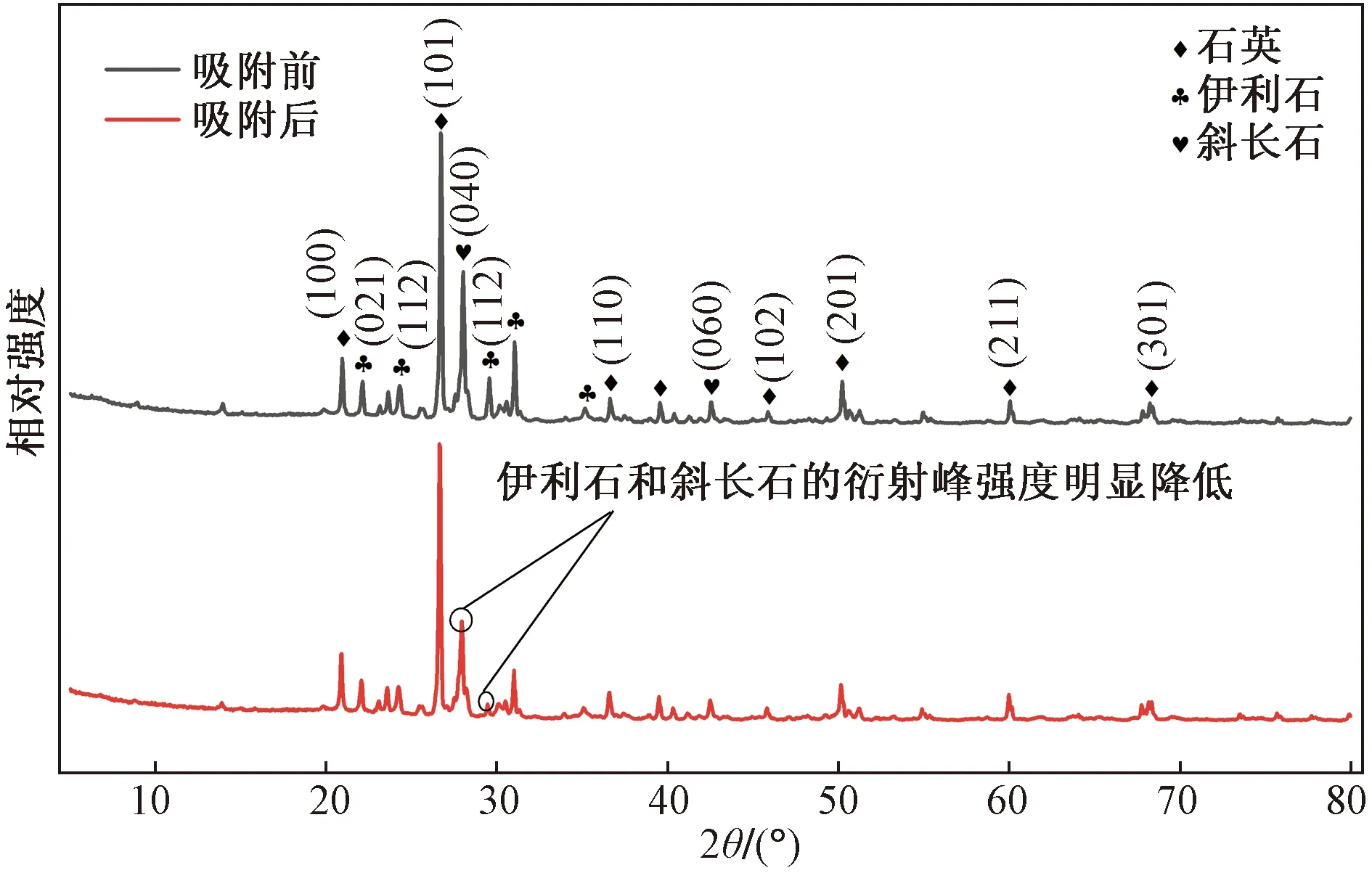
图3 伊利石吸附Sr前后的XRD图谱特征Fig.3 XRD patterns of illite before and after adsorption of Sr
对比吸附前后的XRD图谱可知伊利石吸附Sr后,主衍射峰的位置向高衍射角方向移动,且强度均有不同程度的减弱,其中晶面结构为(040)的斜长石和晶面结构为(112)的伊利石衍射峰强度减弱明显。据此推测,伊利石吸附Sr后,其矿物中的Ca2+、Mg2+等离子会与Sr发生阳离子交换反应[22-23],致使矿物的晶胞中掺入离子半径较小的Sr,晶格常数减小,晶胞结构发生改变,主衍射峰强度下降并向高角度方向移动。
2.2.3 官能团变化分析
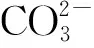

图4 伊利石吸附Sr前后的FTIR图谱特征Fig.4 FTIR spectra of illite before and after adsorption of Sr

2.2.4 化学键变化分析
伊利石吸附Sr前后的XPS全谱特征如图5所示,可以看出,伊利石中主要的元素有O、C、Ca、Mg、Na、Si、Al等,吸附Sr后全谱中有Sr出现,表明Sr已吸附在伊利石表面,并改变了其化学环境。为进一步探究伊利石吸附Sr过程发生的作用,对元素C和O图谱进行分峰拟合,如图6和图7所示。

图5 伊利石吸附Sr前后的XPS全谱特征Fig.5 XPS spectrum characteristics of illite before and after Sr adsorption
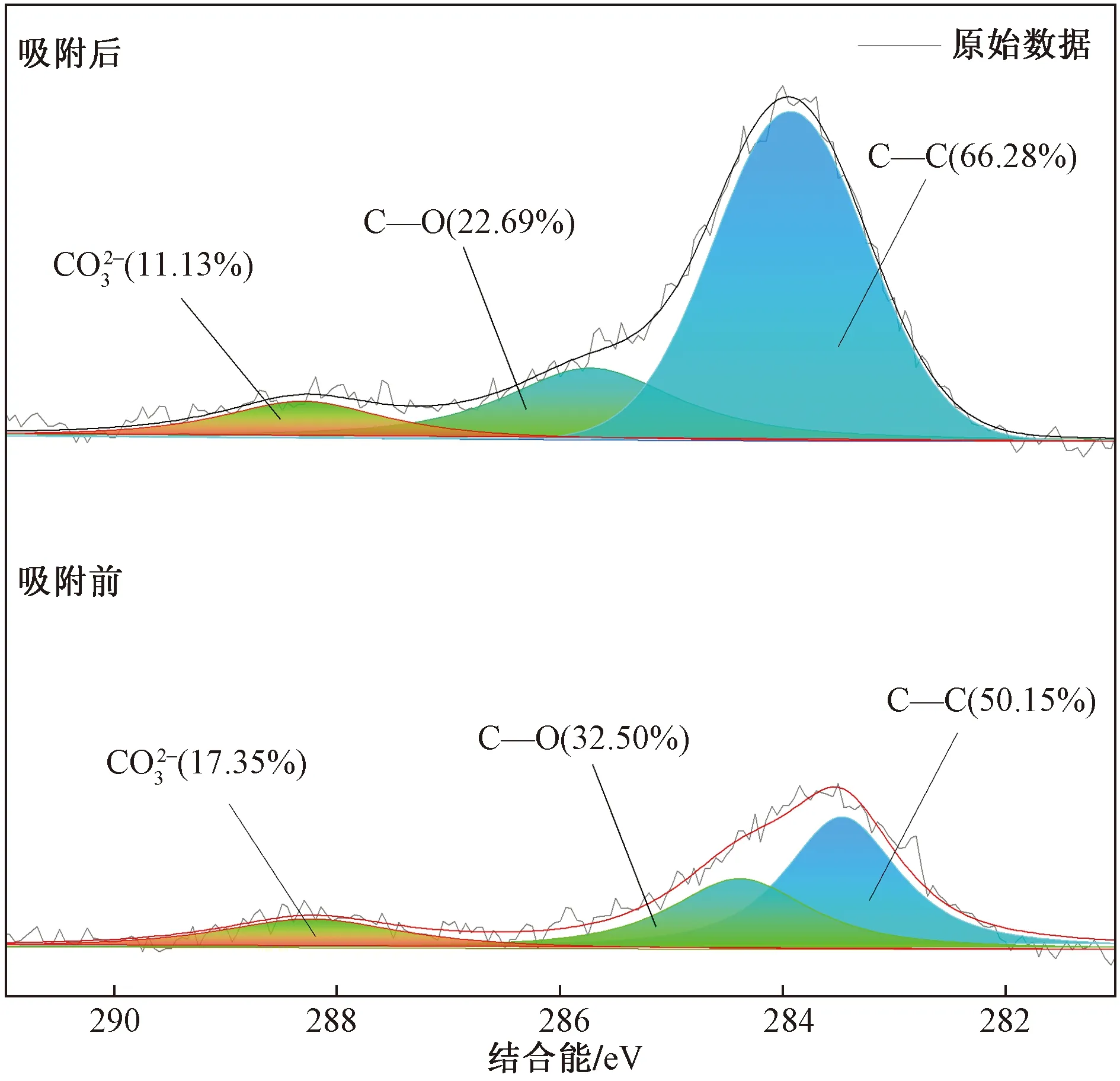
图6 伊利石吸附Sr前后C 1s XPS图谱Fig.6 C 1s XPS spectra of illite before and after Sr adsorption

图7 伊利石吸附Sr前后O 1s XPS图谱Fig.7 XPS spectra of O 1s before and after adsorption of Sr by illite
2.3 基于表征的吸附反应机理分析





3 结论

