血清TWEAK和IL-17与老年肌少症的相关性研究
2023-09-26苏莉张兆岩崔娟孙晓平于新宇
苏莉,张兆岩,崔娟,孙晓平,于新宇
肌少症是一种进行性、全身性骨骼肌疾病,伴有肌肉质量加速丧失和功能退化,多见于老年人,据统计60岁以上老年人群中肌少症的患病率约为10%[1]。肌少症的发生增加老年人摔倒、骨折、身体残疾和死亡的风险[2]。研究显示炎性细胞因子能刺激蛋白质分解代谢并抑制肌肉合成,促进肌肉萎缩,与肌少症的发生存在密切的关系[3]。肿瘤坏死因子样凋亡微弱诱导剂(TWEAK)是肿瘤坏死因子(TNF)超家族成员之一,主要通过与其受体—成纤维细胞生长因子诱导14(Fn14)结合调控细胞增殖、分化、凋亡以及炎性反应等多种病理生理过程[4]。白介素(IL)-17是辅助性T细胞17的主要效应因子,可促进T细胞的增殖分化和IL-6、IL-8及细胞黏附分子等产生,导致炎性反应[5]。本研究检测肌少症患者血清TWEAK、IL-17水平,探讨其与老年肌少症的关系,报道如下。
1 资料与方法
1.1 临床资料 选择2021年10月—2023年3月中国人民解放军联勤保障部队第九六〇医院干部病房一科收治的老年肌少症患者93例为肌少症组;同时,选择医院体检非肌少症老年志愿者60例为健康对照组。2组性别、年龄及合并高血压、高脂血症比较差异无统计学意义(P>0.05),肌少症组体质量指数(BMI)、运动频率≥5次/周比例低于健康对照组(P<0.05),糖尿病、骨质疏松比例高于健康对照组(P<0.05),见表1。本研究经医院伦理委员会批准(RIYY-2021-017),受试者或家属知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:①骨骼肌质量指数(SMI)降低(男性<7.0 kg/m2,女性<5.4 kg/m2),握力降低(男性<26 kg,女性<18 kg),步速减少(<0.8 m/s),符合2014年亚洲肌肉减少症工作小组制定的肌少症诊断标准[6];②年龄≥60岁;③能独立站立和行走。(2)排除标准:①恶性肿瘤、免疫疾病、感染性疾病;②因严重脑卒中、心力衰竭、肾脏疾病、骨折和其他疾病而卧床;③严重内分泌疾病;④传染病、精神疾病。
1.3 观测指标与方法
1.3.1 血清TWEAK和IL-17水平检测:肌少症组入组次日治疗前(健康对照组体检当日晨)采集空腹肘静脉血3 ml注入干燥试管中,室温下静置30 min,待血液凝固后取上层液离心留取血清,-80℃保存待检。采用SpectraMax®iD5多功能酶标仪(上海美谷分子仪器有限公司)应用酶联免疫吸附试验检测血清TWEAK、IL-17水平, 试剂盒购自上海臻科生物科技有限公司。
1.3.2 骨骼肌质量、握力和步速测定:Medix DR数字化二维扇束双能X线骨密度仪(法国MEDILINK公司)评估肌肉质量,手臂和腿部骨骼肌质量相加为全身骨骼肌质量(ASM),SMI=ASM(kg)/身高(m)2;WCS-100型电子握力计(无锡市怡和医疗器械有限公司)测定肌肉力量:受试者每只手尽最大努力做3次,取平均值;6 m步行速度,受试者被要求以正常速度行走6 m,计算步速(m/s),取2次测试结果的平均值。根据SMI、握力和步速将肌少症组患者分为前期亚组(SMI≤7.0 kg/m2,握力、步速尚可,29例)、 中期亚组(SMI≤7.0 kg/m2,握力或步速明显降低,39例)、 严重期亚组(SMI≤7.0 kg/m2,握力和步速均明显降低,25例)。

2 结 果
2.1 2组血清TWEAK、IL-17水平和SMI、握力、步速比较 肌少症组血清TWEAK、IL-17水平高于健康对照组(P<0.01),SMI、握力和步速低于健康对照组(P<0.01),见表2。

表2 健康对照组和肌少症组血清TWEAK、IL-17水平和SMI、握力、步速比较Tab.2 Comparison of serum TWEAK, IL-17 levels, SMI, grip strength, and gait speed between healthy control group and sarcopenia group
2.2 不同分期肌少症患者血清TWEAK、IL-17水平和SMI、握力、步速比较 血清TWEAK、IL-17水平比较,严重期亚组>中期亚组>前期亚组(P均<0.01),SMI、握力和步速比较,严重期亚组<中期亚组<前期亚组(P均<0.01),见表3。

表3 不同分期肌少症患者血清TWEAK、IL-17水平和SMI、握力和步速比较Tab.3 Comparison of serum TWEAK, IL-17 levels, SMI, grip strength, and gait speed in patients with different stages of sarcopenia
2.3 肌少症患者血清TWEAK、IL-17与SMI、握力、步速的相关性分析 肌少症患者血清TWEAK、IL-17水平与SMI、握力、步速均呈负相关(P<0.01),见表4。

表4 肌少症患者血清TWEAK、IL-17与SMI、握力、步速的相关性分析Tab.4 Correlation analysis of TWEAK, IL-17 with SMI, grip strength, and gait speed in patients with sarcopenia
2.4 影响老年肌少症的多因素Logistic回归分析 以是否患有肌肉减少症为因变量(0=否,1=是),以上述结果中P<0.05项目为自变量,进行多因素Logistic回归分析,结果显示,骨质疏松、高TWEAK、高IL-17是老年肌少症发病的危险因素(P<0.01),高SMI是其保护因素(P<0.01),见表5。
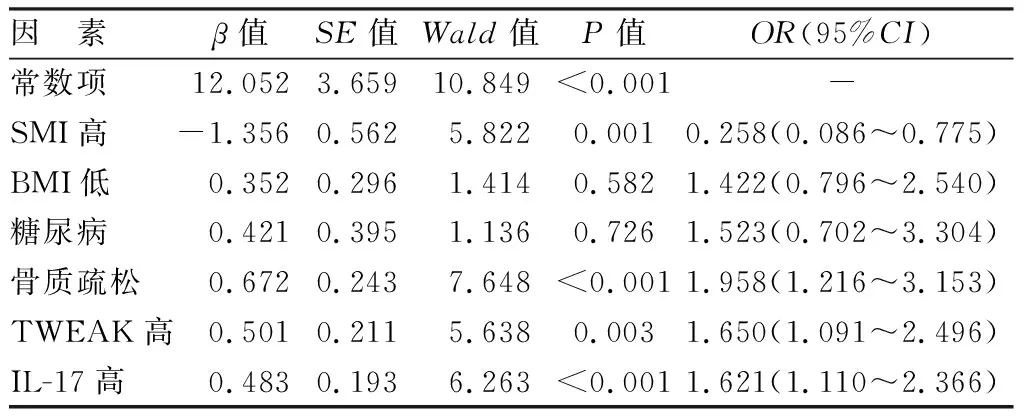
表5 影响老年肌少症的Logistic回归分析结果Tab.5 Logistic regression analysis results affecting elderly sarcopenia
2.5 血清TWEAK、IL-17诊断老年肌少症的价值 绘制TWEAK、IL-17诊断老年肌少症价值的ROC曲线,并计算曲线下面积(AUC),结果显示,血清TWEAK、IL-17及二者联合诊断老年肌少症的曲线下面积分别为0.734、0.790、0.898,二者联合诊断老年肌少症的AUC大于TWEAK、IL-17单独诊断(Z/P=4.210/<0.001、2.865/0.016),见表6、图1。
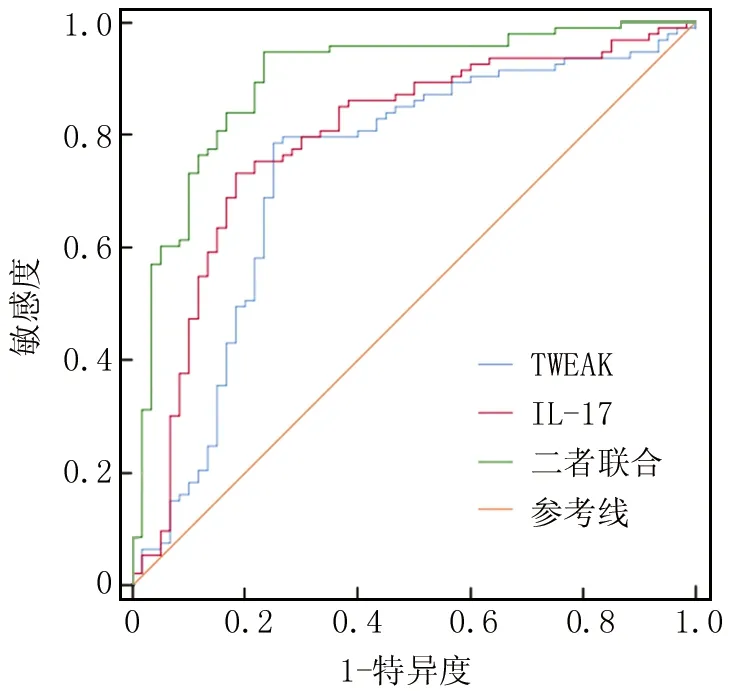
图1 血清TWEAK、IL-17诊断老年肌少症的ROC图Fig.1 ROC diagram of TWEAK and IL-17 in diagnosing sarcopenia in the elderly

表6 血清TWEAK、IL-17诊断老年肌少症的价值比较Tab.6 Comparison of the diagnostic value of TWEAK and IL-17 in elderly sarcopenia
3 讨 论
肌少症是一种多因素疾病,其特征是肌肉质量和功能的大幅下降,其发病危险因素包括年龄大、癌症、肥胖、风湿病、营养不良、缺乏体育活动或久坐、肌肉蛋白质稳态变化、合成代谢障碍、神经肌肉功能障碍等[7-8]。炎性反应与肌少症的发生密切相关,炎性细胞因子、肿瘤坏死因子-α、白介素-6、白介素-1和趋化因子等通过核因子-κB信号通路促进NOD样受体热蛋白结构域相关蛋白3(NLRP3)炎性小体的激活,促使炎性细胞在肌肉组织浸润,进而使肌蛋白分解和肌细胞凋亡,导致肌肉质量下降和肌功能障碍[9]。
本研究发现,肌少症组血清TWEAK水平显著高于健康对照组,TWEAK与SMI、握力和步速呈负相关,高水平TWEAK是老年人肌少症的危险因素。TWEAK是广泛分布于多种细胞(上皮细胞、间充质细胞、内皮细胞、骨骼肌细胞等)和组织(胰腺、肠道、心脏、肌肉等)中的多功能细胞因子,以膜结合或可溶性两种形式存在,可溶性TWEAK主要由细胞外结构域裂解而产生并进入外周血循环,TWEAK受体Fn14是一种Ⅰ型跨膜蛋白,含有半胱氨酸的结构域与TWEAK结合,通过激活转录因子核因子κB(NF-κB)、丝裂原活化蛋白激酶和磷脂酰肌醇3-激酶/蛋白激酶B信号通路调控细胞死亡或增殖、炎性反应和纤维化过程[10]。TWEAK和Fn14在骨骼肌中也有表达,并参与肌肉组织分解和合成代谢调控过程,在慢性肌肉损伤和肌肉疾病中起关键作用[11]。正常情况下,肌肉组织中TWEAK呈低表达,通过激活非典型NF-κB通路,促进成肌细胞融合和肌生成,Fn14在正常健康肌肉中处于休眠状态或低表达[12]。在去神经诱导骨骼肌萎缩的小鼠模型中Fn14表达上调,继而激活TWEAK/Fn14通路,导致肌肉萎缩、纤维化和肌肉蛋白降解[13]。同样在肌萎缩性侧索硬化症小鼠模型中,可观察到TWEAK、Fn14在脊髓星形胶质细胞和骨骼肌中异常表达,TWEAK过表达可刺激星形胶质细胞中白介素-6释放,诱导运动神经元死亡[14]。分析TWEAK可能通过以下途径参与肌少症的发病机制:TWEAK可激活NF-κB信号通路,增强肌肉特异性E3泛素连接酶—肌肉环状指蛋白1的表达,肌肉环状指蛋白1再靶向骨骼肌中肌球蛋白重链促使其水解[15],TWEAK还可诱导自噬—溶酶体系统,激活肌管中半胱氨酸天冬氨酸蛋白酶3,有助于肌原纤维蛋白水解,导致骨骼肌质量和功能的损失[16]。
本研究发现,IL-17与老年肌少症也存在密切关系,肌少症组血清IL-17水平高于健康对照组,IL-17与SMI、握力及步速呈负相关。IL-17是T细胞介导炎性反应的早期启动因子,通过与其受体结合激活促分裂素原活化蛋白激酶途径和NF-κB途径,诱导CXCL1、CXCL2和CXCL8等趋化因子表达,活化和驱使中性粒细胞迁移至感染或损伤组织,引起致病性炎性反应,诱导组织损伤[17]。IL-17还可通过促使干细胞增殖,促进损伤骨骼肌组织再生和修复[18]。白介素-17通过激活p38信号通路,抑制尿激酶型纤溶酶原激活物表达和成肌细胞迁移,还可促使细胞骨架重组和极性丧失抑制成肌细胞的成肌分化,参与炎性肌肉疾病发病过程[19]。分析原因,首先,IL-17可单独或与肿瘤坏死因子-α或IL-1联合刺激骨骼肌细胞释放IL-6和CC-趋化因子配体20,促进炎性细胞浸润于成肌细胞,影响肌肉组织碳水化合物和脂类代谢,抑制肌肉卫星细胞(肌肉卫星细胞是组织特异性干细胞,负责骨骼肌的生长和再生)的增殖以及肌源性分化和肌细胞迁移,导致肌肉萎缩[20]。其次,生长激素/胰岛素样生长因子Ⅰ(GH/IGF-Ⅰ)轴激活可使肌肉和肌腱中胶原蛋白的表达和合成增加,增加肌肉中卫星细胞数量,GH/IGF-Ⅰ轴活性降低与肌少症发生有关[21],IL-17诱导IL-6的过度表达可干扰GH/IGF-Ⅰ轴活性,进而导致骨骼肌萎缩[20]。最后,NLRP3炎性小体激活有助于启动和激活促炎环境,影响正常肌群合成代谢功能,导致肌肉萎缩[22],IL-17过表达可促进NLRP3炎性小体激活,上调NLRP3、半胱天冬氨酸酶-1、IL-1β基因表达[23],因此推测IL-17可能通过促使NLRP3炎性小体激活参与肌少症发病过程。
ROC分析结果表明,联合检测血清TWEAK、IL-17水平在老年肌少症诊断中具有较高的价值,提示血清TWEAK、IL-17有望成为老年肌少症潜在的生物学标志物。骨质疏松与肌少症均好发于老年人,且两者往往同时存在,肌肉与骨骼往往相互作用,加重骨骼肌质量降低和功能障碍[24]。
综上,老年肌少症患者血清TWEAK、IL-17水平均显著增高,高水平TWEAK、IL-17与骨骼肌质量减少、握力及步速降低有关,是老年肌少症的高危因素,联合检测血清TWEAK、IL-17有助于评估老年人肌少症潜在风险。
利益冲突:所有作者声明无利益冲突
作者贡献声明
苏莉:设计研究方案,实施研究过程,论文撰写;张兆岩:提出研究思路,分析试验数据,论文审核;崔娟:实施研究过程,资料搜集整理,论文修改;孙晓平:进行统计学分析;于新宇:课题设计,论文撰写
