基于网络药理学和实验验证探讨大蒜抗幽门螺杆菌感染的作用机制
2023-09-26何银陈红梅陈晨潘艳丽米雪胡志林
何银,陈红梅,陈晨,潘艳丽,米雪,胡志林*
1.石河子大学 药学院,新疆植物药资源利用教育部重点实验室,新疆 石河子 832003
2.新疆华世丹药业有限公司,新疆 乌鲁木齐 830001
幽门螺杆菌(Hp)是一种微需氧革兰阴性杆菌,主要定植于胃和十二指肠。Hp 在人群中主要通过口-口途径传播,目前全球Hp 感染率已超过50%,我国自然人群Hp 感染率在59%[1-2]。Hp 感染与多种人类上消化道疾病有关,感染的患者一般患有慢性活动性胃炎,其中10%~20%可发展为消化性溃疡,50%可发展为胃黏膜萎缩,1%~3%甚至可发展为胃癌或胃黏膜相关淋巴组织淋巴瘤[3-4]。随着Hp治疗的广泛开展,根除率逐渐降低,有效治疗Hp 感染面临着挑战,Hp 耐药性是导致幽门螺杆菌根除率越来越低的主要原因[5]。根除Hp 是消除慢性胃炎、预防和治愈消化性溃疡、有效治疗MALT 淋巴瘤、降低胃癌发病率最经济、有效的方法[6]。
大蒜是亚洲种植最广泛的蔬菜作物之一,也是世界闻名的药用植物。大蒜中至少含有33 种硫化物,硫化物是使大蒜产生刺激性气味、发挥药理作用的主要成分[7-9]。大蒜素是大蒜中的主要生物活性成分,具有抗癌、抗炎、抗氧化、免疫调节、抗血小板聚集、心肌保护、心血管保护、消化系统保护等生物学功能[10-13]。大蒜素具有较强的抗菌活性,抑制Hp 的生长,有效预防和减少Hp 的感染,还在临床上对系统性真菌和细菌感染有良好的治疗效果[14-16]。本研究将基于网络药理学、分子对接和体外抑菌试验研究大蒜治疗Hp 感染可能的活性成分、靶点和通路,探讨其作用机制,为后续研究提供参考。
1 资料与方法
1.1 网络药理学方法
1.1.1 药物活性成分靶点的收集 在HERB数据库检索“大蒜”并下载相关成分表,并通过相对分子质量(MW)≤500,脂水分配系数(xlogp)≤5,氢键给体数目(H-bond donors)≤5,氢键受体数目(Hbond acceptors)≤10 筛选其活性成分,再通过PharmMapper、Swiss Target Prediction、BATMANTCM 数据库(Score cutoff≥20,P<0.05)收集大蒜活性成分相关靶点。利用Cytoscape 3.9.1 软件制作“药物-成分-潜在靶点”网络图。
1.1.2 疾病靶点收集 以“Helicobacterpyloriinfection”作为关键词,在GeneCards(Relevance score≥5)、OMIM、DRUGBANK、DisGeNET 数据库进行检索,将结果合并去重后得到Hp 感染相关靶点。将活性成分靶点与疾病靶点导入Venny 2.1 在线工具,获取大蒜治疗Hp 感染的潜在作用靶点。
1.1.3 构建蛋白相互作用(PPI)网络 将1.1.2 项下得到的潜在作用靶点导入STRING 数据库,设置物种为“Homo sapiens”,最小相互作用阈值设定为“highest confidence(0.900)”,即可得到PPI 网络。将分析结果的tsv 文件导入Cytoscape 3.9.1 软件进行可视化,得到最终的PPI 网络图,并筛选出degree值最大的前5 个节点,作为核心靶点。
1.1.4 基因本体论(GO)生物分析与京都基因与基因组百科全书(KEGG)通路分析 将交集靶点导入DAVID 数据库进行GO 功能富集分析及KEGG信号通路分析,将所得结果按P值升序排列(P<0.05),然后通过微生信在线绘制工具,分别取生物功能(BP)、细胞成分(CC)、分子功能(MF)的前15 位绘制GO 功能富集柱状图,KEGG 信号通路富集结果取前30 位绘制KEGG 通路气泡图。
1.1.5 活性成分与核心靶点的分子对接 在TCMSP 数据库中获取大蒜有效成分的MOL2 结构文件,在Autodock Tools 1.5.7 软件中加氢后导出为“pdbqt 文件”。然后在PDB 数据库中根据物种、方法、分辨率、Macromolecule 筛选核心靶点蛋白结构,保存其“pdb 格式文件”,并通过Pymol 软件进行去水分子、去配体,Autodock Tools 中加氢后导出“pdbqt 文件”。最后,将配体小分子和受体大分子一起导入Autodock Tools 软件中,计算得到相应的结合能数据。
1.2 体外抑菌实验
1.2.1 实验菌株 Hp 标准菌株ATCC 700392(北京北纳创联生物技术研究院);Hp 标准菌株ATCC 43504(新疆华世丹药业有限公司);Hp 临床菌株SS1(北京北纳创联生物技术研究院)
1.2.2 试剂与耗材 大蒜素(质量分数95.22%,批号210517,江苏正大清江制药有限公司);哥伦比亚琼脂培养基(批号Cat.No.10106,青岛日水生物技术有限公司);布氏肉汤(批号Cat.No.10705,青岛日水生物技术有限公司);脱纤维山羊血(无菌)(批号TX0020,北京索莱宝科技有限公司);胎牛血清(批号21100702,浙江天杭生物科技股份有限公司);HP 尿素酶快速检测试剂盒(干化学法)(批号20142400023,本溪泰斯特捷生物科技有限公司);HP 试纸(化学反应法)(批号20192400204,珠海市克迪科技开发有限公司);日本三菱MGC 产气袋(批号1198LJ-1,北京缘生化科技有限公司)。
1.2.3 仪器 BSC-1300II A/B3 生物安全柜(上海博讯实业有限公司);SPX-250B-Z 生化培养箱(上海博讯实业有限公司);KXQ.SG46.280 高压灭菌锅(上海佳腾实验设备有限公司);JM300/0.1 电子天平(余姚纪铭称重校验设备有限公司)。
1.2.4 菌株的培养及鉴定 取100 μL 菌液涂布于含有10%无菌脱纤维山羊血的哥伦比亚琼脂平板上,倒置于厌氧菌培养盒内(培养条件:5% O2、10% CO2、85% N2),将培养盒放入37 ℃细菌培养箱培养3 d,经革兰氏染色和尿素酶实验证实为Hp。取鉴定后菌株,采用接种环挑取1 CFU Hp 菌落接种于100 mL 含10%胎牛血清布氏肉汤培养基中,微需氧环境中培养3 d,取100 μL 细菌悬液重悬于10 mL 无菌水中,进行麦氏比浊,稀释菌液浓度为1.0×108CFU/mL,用于药敏实验。
1.2.5 最小抑菌浓度(MIC)的测定 采用液体倍比稀释法测定大蒜素对Hp 的MIC 值,用布氏肉汤培养基配制成512 μg/mL 的大蒜素母液,取13 根10 mL 无菌试管,依次编号1~13。实验组1~11 号管分别配制成浓度为0、1、2、4、8、16、32、64、128、256、512 μg/mL 的系列药液,然后分别加入0.1 mL 1×108CFU/mL 菌悬液(试管中最终菌悬液浓度为1×106CFU/mL)。12 号管作为阳性对照管不加药液,13 号管作为阴性对照管不加菌液,混匀后置于37 ℃细菌培养箱中培养3 d。没有细菌生长的最小药物浓度为该药的MIC 值。
2 结果
2.1 大蒜活性成分收集
共得到大蒜活性成分共36 个,见表1。在PharmMapper、Swiss Target Prediction、BATMANTCM 数据库共获取大蒜活性成分潜在靶点1 170个,将大蒜对应的活性成分以及潜在靶点、药物构建“药物-成分-潜在靶点”网络,见图1。网络中共含有节点1 207 个,边线6 833 条。所有活性成分节点中degree 值最大的前10 位是二烯丙基二硫醚、对羟基苯甲酸乙酯、山柰酚、芹菜素、二烯丙基四硫醚、烯丙基甲基四硫醚、香叶醇、大蒜素、香橙醛、二烯丙基三硫醚,是大蒜治疗Hp 感染主要活性成分,其中二烯丙基二硫醚、二烯丙基四硫醚、二烯丙基三硫醚是大蒜素中的活性成分。

图1 “药物-成分-潜在靶点”网络Fig.1 Network of “drugs-components-potential targets”

表1 大蒜活性成分基本信息Table 1 Basic information of Allium sativum active ingredients
2.2 大蒜治疗Hp 感染的潜在靶点
Genecards、OMIM、DRUGBANK、DisGeNET数据库筛选获得1 584 个疾病靶点,将这些疾病靶点与药物活性成分靶点取交集,共获得291 个大蒜治疗Hp 感染的潜在作用靶点,见图2。
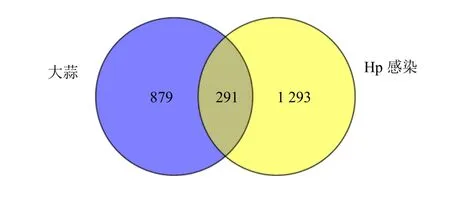
图2 药物靶点与疾病靶点韦恩图Fig.2 Venn diagram of drug target and disease target
2.3 潜在靶点PPI 网络图
PPI 网络见图3。网络中共含有节点246 个,节点面积越大,颜色越深,代表该节点的degree 值越大;1 416 边线条,代表靶点蛋白之间的相互关联。根据degree 值筛选前5 个节点为肿瘤蛋白p53(TP53)、酪氨酸蛋白激酶(SRC)、信号传导和转录激活蛋白3(STAT3)、热休克蛋白90α 家族A 类成员 1(HSP90AA1)、丝裂原激活的蛋白激酶(MAPK3),这5 个靶点被认为是大蒜治疗Hp 感染的核心靶点,见图4。

图3 PPI 网络Fig.3 Network interaction map of PPI
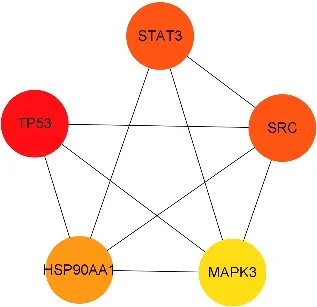
图4 核心靶点相互作用网络Fig.4 Network interaction map of core targets
2.4 GO 和KEGG 通路富集结果
GO 富集分析结果表明,BP 分析富集影响较显著的有对药物的反应、凋亡过程的负调控、基因表达的正调控、对外源化合物刺激的反应、蛋白质磷酸化等;CC 分析富集影响较显著的有细胞溶质、细胞外间隙、细胞质、大分子复合物、胞外区等;MF分析富集影响较显著的是相同的蛋白质结合、酶结合、蛋白激酶活性、蛋白质结合、蛋白丝氨酸/苏氨酸激酶活性等,见图5。KEGG 通路分析结果表明,大蒜治疗Hp 感染与磷脂酰肌醇3-激酶(PI3K)-蛋白激酶B(Akt)、叉头框蛋白O(FoxO)、MAPK、低氧诱导因子-1(HIF-1)等多条信号通路密切相关,揭示大蒜可能通过靶向作用于这些通路介导Hp 感染过程,见图6。

图5 GO 富集分析Fig.5 GO enrichment analysis
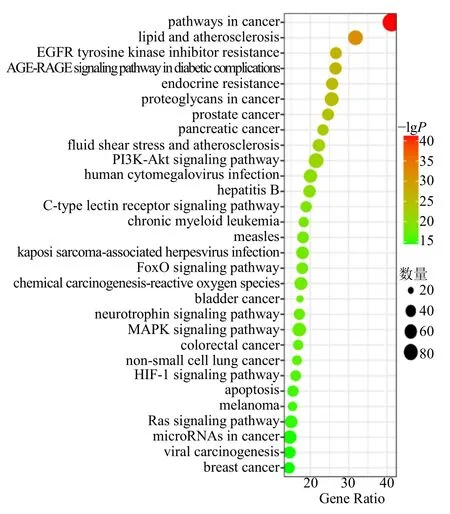
图6 KEGG 通路分析Fig.6 KEGG pathway analysis
2.5 分子对接分析结果
将大蒜的活性成分分别与核心靶点进行分子对接,对接结果见表2。分子对接的结合能越小,提示活性物质与蛋白质之间结合越牢固,其数值小于-1.2 kcal/mol(1 kcal=4.184 kJ)时表示活性物质与蛋白质之间有较好的结合活性[17]。结果表明,大蒜degree 值前10 位的活性成分与核心靶点的结合能均具有较好的结合活性,而且结合体构象稳定。

表2 分子对接结果Table 2 Molecular docking results
2.6 体外抑菌实验结果
对大蒜素进行体外抗Hp 活性检测,大蒜素对3 株Hp 菌等抑制能力不同,对Hp ATCC 43504 的MIC 值为2.0 mg/mL,对Hp SS1 和Hp ATCC 700392的MIC 值均为4.0 mg/mL,表明大蒜素对Hp 菌株具有抑制作用,其MIC 值越小说明抗菌活性越强。
3 讨论
本研究利用网络药理学和分子对接,对大蒜治疗Hp 感染的机制进行分析。“药物-成分-潜在靶点”网络分析得到,degree 值前10 位的大蒜活性成分为二烯丙基二硫醚、对羟基苯甲酸乙酯、山柰酚、芹菜素、二烯丙基四硫醚、烯丙基甲基四硫醚、香叶醇、蒜辣素、香橙醛、二烯丙基三硫醚。其中二烯丙基二硫醚、二烯丙基四硫醚、二烯丙基三硫醚是大蒜素中的活性成分,二烯丙基三硫醚为大蒜素的主要活性成分。二烯丙基二硫醚是大蒜中degree值最高的一种活性成分,可以同时抑制敏感和耐药的Hp[18]。二烯丙基三硫醚可以破坏Hp 生物膜结构,起到杀菌作用,且随着药物浓度的提高,杀菌效果逐渐增强,而且二烯丙基三硫醚比二烯丙基二硫具有更高的抗Hp 活性[19-20]。因此,对大蒜素进行了体外抑菌试验,发现大蒜素对三株幽门螺杆菌均具有抑菌作用,最小抑菌浓度为2.0 mg/mL。
通过PPI 网络分析可知,TP53、SRC、STAT3、HSP90AA1、MAPK3 是大蒜对抗Hp 感染的核心靶点。TP53 是一种与肿瘤的增殖、分化等过程密切相关的抑癌基因,TP53 突变可引起p53 核蓄积,与Hp 感染诱发的胃黏膜AID 异常表达密切相关,且TP53 基因Pro/Pro 基因型可增加Hp 感染者胃癌发生的风险[21-22]。STAT3 是许多细胞因子和生长因子的关键转录因子,可诱导HIF-1α 表达,进而促进细胞迁移、侵袭和肿瘤形成[23-24]。
KEGG 通路富集分析表明,大蒜抗Hp 感染与PI3K-Akt、FoxO、MAPK、HIF-1 等信号通路密切相关。Hp 可以通过激活PI3K-Akt 信号通路来调节Hp 诱发的细胞迁移,与宿主细胞cag 分泌系统和肽聚糖以及表皮生长因子受体(EGFR)反式激活和SRC 活化有关[25]。FoxO 与细胞凋亡、细胞周期阻滞、氧化应激等密切相关,FoxO3a 可通过调控其下游物靶基因参与Hp 所致胃黏膜相关疾病的发生发展过程,且FoxO1/3a 是Hp 诱导的PI3K/Akt 细胞生存信号通路的新型核底物,该信号通路可控制白细胞介素-8(IL-8)的产生[26-27]。MAPK 通路在炎症、氧化应激、细胞增殖等生理病理过程和应激反应中起到重要作用,Hp 感染后引起的胃黏膜炎性损伤可通过MAPKs 信号转导通路完成[28-29]。HIF-1 是一种缺氧诱导因子,Hp 可通过上调HIF-1α 和STAT3 的表达可促进胃上皮细胞GES-1 的增殖、侵袭和迁移[30]。
通过分子对接发现,大蒜degree 值前10 位的活性成分与核心靶点的结合能均具有较好的结合活性,而且结合体构象稳定。提示大蒜中的这些成分可能通过调控核心靶点参与Hp 感染相关过程。
综上所述,大蒜治疗Hp 感染的机制可能是通过二烯丙基二硫、二烯丙基三硫醚等烯丙基硫醚类化合物作用于TP53、SRC、STAT3、HSP90AA1、MAPK3 等核心靶点,与PI3K-Akt、FoxO、MAPK、HIF-1 等信号通路有关。通过初步抑菌试验,验证了大蒜素抗Hp 的活性,为后续研究提供理论依据。
利益冲突所有作者均声明不存在利益冲突
