芒果苷单钠盐对高胆固醇血症大鼠肝脂质代谢及PCSK9/LDLR 途径的影响
2023-09-26宋红岩王树根李梦冉杨晓晖李然马晓迎
宋红岩,王树根*,李梦冉,杨晓晖,李然,马晓迎
1.沧州市中心医院 药学部,河北 沧州 061000
2.沧州师范学院 生命科学学院,河北 沧州 061000
3.沧州医学高等专科学校 实验中心,河北 沧州 061000
4.沧州市中心医院 伦理委员会办公室,河北 沧州 061000
5.沧州市中心医院 肾内科,河北 沧州 061000
高胆固醇血症是指血浆胆固醇及低密度脂蛋白(LDL)水平升高,引发脂质代谢异常和内皮细胞损失的一种常见代谢性疾病,是动脉粥样硬化性心血管疾病等诸多心脑血管疾病主要危险因素[1]。流行病学研究证实,高胆固醇是动脉粥样硬化性心血管疾病的关键病理基础,也是引起动脉粥样硬化性心血管疾病发病率上升的关键原因[2]。降低脂质水平、改善脂质堆积情况对动脉粥样硬化性心血管疾病的发生发展具有一定的延缓作用[3]。胆固醇不溶于水,在血液中的运输主要以脂蛋白颗粒介导,LDL 是运载胆固醇的主要载体,其在血管组织中过度积累,可造成一系列心脑血管问题[4]。研究证实,增加低密度脂蛋白受体(LDLR)的活性可降低LDL浓度,从而降低动脉粥样硬化性心血管疾病患病风险[5]。前蛋白转化酶枯草溶菌素9(PCSK9)与LDLR亲和力较强,可与肝脏LDLR 结合,并诱导LDLR在溶酶体中降解,减少LDLR 的再循环,通过靶向调节PCSK9/LDLR 通路可有效改善胆固醇代谢和血脂异常[6]。
芒果苷是知母根茎中提取的活性成分,具有较强的抗炎、抗氧化活性和降糖、调脂功能,然而由于芒果苷水溶性差,生物利用度低,难以制备稳定药液,使其临床应用受限[7-8]。本研究前期参考邓家刚等[9]方法合成芒果苷单钠盐,提高了其溶解性。在此基础上,本实验通过建立高胆固醇血症大鼠模型,观察芒果苷单钠盐对大鼠脂代谢和胆固醇代谢的调节作用,并探讨其调控PCSK9/LDLR 信号通路发挥作用的分子机制。
1 材料与方法
1.1 实验动物
SPF 级SD 大鼠50 只,雄性,4 周龄,体质量180~220 g,由河北省实验动物中心提供[生产许可证号SCXK(冀)2021-002],实验开始前1 周于温度(25±2)℃、相对湿度(45±5)%的SPF 级动物房中适应性喂养,保持12 h 光照与黑暗各半。动物实验经沧州市中心医院实验动物伦理委员会审核通过,伦理审批号2022-102-01。
1.2 实验仪器
AU480 全自动生化分析仪(美国Beckman Coulter 公司),GENIOSPLOS 酶标仪(瑞士Tecan公司),RM 2235 石蜡切片机(德国Leica 公司),DM750 光学显微镜(德国Leica 公司),DYY-Ⅲ-8B电泳仪(上海纳识生物科技有限公司),Bio-Profil GDS 凝胶成像系统(法国URMAT 公司),ABI750荧光定量PCR 仪(美国ABI 公司)。
1.3 药品和试剂
阿托伐他汀钙片(规格20 mg/片,批号220221)购自齐鲁制药有限公司;芒果苷单钠盐为实验室自制,质量分数95%;大鼠基础饲料、高脂饲料(猪油4.5%、胆固醇2%,胆酸盐0.3%)购自北京科澳协力饲料有限公司;苏木精-伊红染色(HE)试剂盒(批号228107)购自上海生工生物工程有限公司;PCSK9、LDLR、β-actin 鼠单克隆抗体(批号058107、059653、052041)购自美国Santa Cruz 公司,;RNA提取、反转录试剂盒(批号DR061A、D531A)购自日本TaKaRa 公司;基因上下游引物(货号S0618)由上海捷瑞生物工程有限公司提供。
1.4 模型建立和分组治疗
SD 大鼠适应性喂养1 周后称体质量标记,按体质量随机分为对照组、模型组、阿托伐他汀钙片组、芒果苷单钠盐组,每组各10 只。对照组给予普通饲料喂养,其余各组给予高脂饲料连续喂养4 周以复制高胆固醇血症模型,以血清总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)水平显著升高为模型成功标准。模型制备成功后,阿托伐他汀钙片组参照文献报道[10]ig 给予阿托伐他汀钙片生理盐水混悬液5 mg/kg 干预,芒果苷单钠盐组根据前期实验结果ig 给予80 mg/kg,1 次/d,给药8 周;对照组、模型组ig 等体积生理盐水。ig 期间,对照组给予普通饲料喂养,其余大鼠继续给予高脂饲料。
1.5 体质量和肝脏指数观察
各组于末次给药后称量大鼠体质量,处死后称取肝组织,去除包膜,称取肝脏湿质量,计算肝脏指数:肝脏指数=肝湿质量/体质量。
1.6 血脂及血清酶水平检测
末次给药后,各组大鼠禁食不禁水12 h,麻醉后经腹主动脉采血并处死,血液样本置于无菌试管,3 000 r/min(离心半径4 cm)离心15 min 后取血清,分装放置于-20 ℃保存待测。临测前于室温下平衡1 h,3 000 r/min 离心15 min,采用自动生化分析仪检测血清中三酰甘油(TG)、TC、高密度脂蛋白胆固醇(HDL-C)、LDL-C 以及肌酐(CRE)、血清尿素(UREA)、肌酸激酶(CK)、乳酸脱氢酶(LDH)的水平。
1.7 肝组织游离胆固醇(FC)、总胆汁酸(TBA)检测
末次给药后,各组大鼠禁食不禁水12 h,麻醉取血后处死,取部分肝组织,加入预冷生理盐水后,匀浆机制成10%肝组织匀浆,3 000 r/min 离心15 min 去除杂质,取组织上清冻存于-20 ℃备用。组织上清于室温下平衡1 h,3 000 r/min 离心15 min,采用自动生化分析仪检测FC 和TBA 的含量。
1.8 肝组织病理学观察
大鼠麻醉处死后取肝组织,切取部分边缘齐整的组织置于10%福尔马林溶液中浸泡,固定48 h 后经各级乙醇脱水,二甲苯透明,于液体石蜡中包埋,切片机作5 μm 厚切片,经苏木精染色,1%盐酸乙醇分化,伊红染色后,再进行脱水及封片,于正置光学显微镜下观察肝组织病理形态改变并摄像。
1.9 肝组织PCSK9、LDLR 蛋白表达检测
大鼠麻醉处死后取肝组织100~200 mg 分装保存于-80 ℃待测,检测前将组织解冻,无菌剪剪碎成若干碎块,加入RIPA 裂解液于冰上裂解,采用BCA 法测定裂解上清蛋白浓度,根据蛋白浓度加入RIPA 和Loading Buffer 稀释。制胶后上样10 μL 蛋白样品,电泳分离,转膜后加入5%封闭液封闭,滴加一抗(PCSK9、LDLR、β-actin 鼠单克隆抗体,1∶1 000 稀释)于4 ℃过夜,滴加二抗(HRP 标记的山羊抗兔IgG 抗体,1∶5 000 稀释)于室温孵育2 h,加入显影剂后,凝胶成像系统曝光拍照,Image J 软件分析各蛋白条带灰度值,以β-actin 为内参,计算PCSK9、LDLR 的蛋白相对表达量。
1.10 肝组织白细胞介素-1β(IL-1β)、CD68、PCSK9、LDLR mRNA 表达检测
大鼠麻醉处死后取肝组织50 mg 分装保存于-80 ℃待测,检测前将组织解冻,无菌剪剪碎成若干碎块,Trizol 一步法提取肝组织总RNA,紫外分光光度法检测总RNA 浓度,取2 μg 组织RNA 逆转录提取cDNA,以cDNA 为模板,检测IL-1β、CD68、PCSK9、LDLRmRNA 表达。IL-1β 上游引物:5’-TGGCAACTGTCCCTGAACTC-3’,下游引物:5’-GTCGAGATGCTGCTGTGAGA-3’;CD68 上游引物:5’-AATGTGTCCTTCCCACAAGC-3’,下游引 物:5’-GGCAGCAAGAGAGATTGGTC-3’ ;PCSK9 上游引物:5’-GGAACCTGGAGCGGATTA CC-3’,下游引物:5’-GTCACACTTGCTGGCCTGT C-3’;LDLR 上游引物:5’-ACGGCGTCTCTTCCTA TGAGA-3’,下游引物:5’-CCCTTGGTATCCGCAA CAGA-3’;β-actin 上游引物:5’-CACGATGGAGG GGCCGACCATC-3’,下游引物:5’-TAAAGACCTC TATGCCAACCAGT-3’。反应条件为:95 ℃、2 min,变性、退火、延伸各为95 ℃、5 s,60 ℃、30 s,72 ℃、15 s,交替重复40 个循环,以β-actin 为内参,目的基因mRNA 相对表达量用2-ΔΔCt法分析。
1.11 统计学分析
实验数据采用SPSS 20.0 软件分析,两组间比较采用两独立样本t检验,组内比较采用配对t检验,数据以表示。
2 结果
2.1 体质量和肝脏指数变化
与对照组相比,模型组大鼠体质量、肝脏指数增加明显(P<0.05);与模型组相比,阿托伐他汀钙片组、芒果苷单钠盐组体质量、肝脏指数均明显下降(P<0.05),见表1。
表1 各组体质量、肝脏指数比较(,n=10)Table 1 Comparison of weight and liver index in each group (,n=10)

表1 各组体质量、肝脏指数比较(,n=10)Table 1 Comparison of weight and liver index in each group (,n=10)
与对照组比较:*P<0.05;与模型组比较:#P<0.05*P <0.05 vs control group;#P <0.05 vs model group
2.2 血清TC、TG、HDL-C、LDL-C 水平
与对照组相比,模型组血清中的TC、LDL-C 水平明显升高,HDL-C 水平明显降低(P<0.05);与模型组大鼠相比,阿托伐他汀钙片组、芒果苷单钠盐组的血清TC、LDL-C 的水平明显下降,HDL-C水平明显升高(P<0.05),见表2。
表2 各组血清TC、TG、HDL-C、LDL-C 水平比较(,n=10)Table 2 Comparison of serum levels of TC,TG,HDL-C,and LDL-C in each group (,n=10)

表2 各组血清TC、TG、HDL-C、LDL-C 水平比较(,n=10)Table 2 Comparison of serum levels of TC,TG,HDL-C,and LDL-C in each group (,n=10)
与对照组比较:*P<0.05;与模型组比较:#P<0.05*P <0.05 vs control group;#P <0.05 vs model group
2.3 肝脏FC、TBA 含量
与对照组相比,模型组肝组织中FC 含量明显升高,TBA 含量明显降低(P<0.05);与模型组大鼠相比,阿托伐他汀钙片组、芒果苷单钠盐组肝组织中FC 含量明显下降,TBA 含量升高(P<0.05),见表3。
表3 各组肝组织FC、TBA 含量比较(,n=10)Table 3 Comparison of FC and TBA contents in liver tissues of each group (,n=10)

表3 各组肝组织FC、TBA 含量比较(,n=10)Table 3 Comparison of FC and TBA contents in liver tissues of each group (,n=10)
与对照组比较:*P<0.05;与模型组比较:#P<0.05*P <0.05 vs control group;#P <0.05 vs model group
2.4 血清CRE、UREA、CK、LDH 水平
与对照组相比,模型组大鼠血清中CRE、UREA、CK、LDH 水平明显升高(P<0.05);与模型组相比,阿托伐他汀钙片组、芒果苷单钠盐组血清CRE、UREA、CK、LDH 的水平明显下降(P<0.05),见表4。
表4 各组血清CRE、UREA、CK、LDH 水平比较(,n=10)Table 4 Comparison of serum levels of CRE,UREA,CK,and LDH in each groups (,n=10)

表4 各组血清CRE、UREA、CK、LDH 水平比较(,n=10)Table 4 Comparison of serum levels of CRE,UREA,CK,and LDH in each groups (,n=10)
与对照组比较:*P<0.05;与模型组比较:#P<0.05*P <0.05 vs control group;#P <0.05 vs model group
2.5 肝组织病理形态学变化
HE 染色显示,对照组大鼠肝脏结构良好,肝小叶完整,轮廓清晰,肝细胞排列规整,未见脂肪变性;模型组大鼠肝细胞索紊乱,可见中性粒细胞浸润及肝细胞肿胀,伴空泡样脂肪变性;与模型组相比,阿托伐他汀钙片组、芒果苷单钠盐组干预后均缓解了大鼠肝脏损伤,肝细胞索排列较模型组整齐,脂肪变性减轻,见图1。
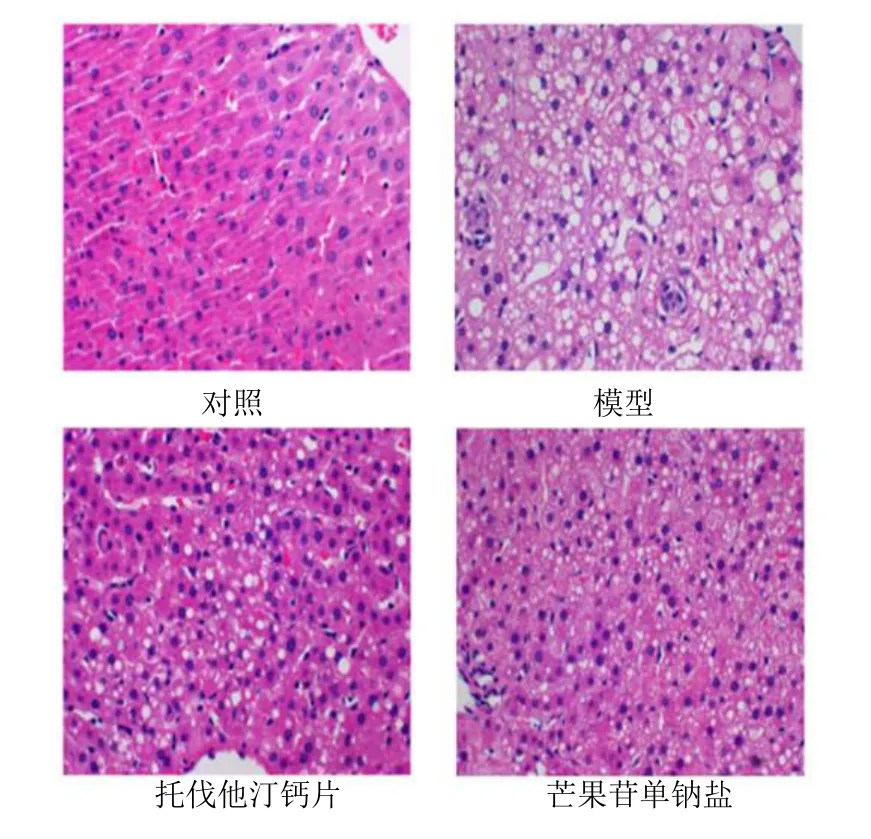
图1 各组肝组织病理形态学变化(HE,×200)Fig.1 Histopathologic changes of liver tissue in each group(HE,×200)
2.6 肝组织IL-1β、CD68 mRNA 表达
与对照组相比,模型组大鼠肝组织中IL-1β、CD68mRNA 表达显著增加(P<0.05);与模型组相比,阿托伐他汀钙片组、芒果苷单钠盐组肝组织中IL-1β、CD68mRNA 表达明显减少(P<0.05),见图2。

图2 各组肝组织IL-1β、CD68 的mRNA 表达(,n=5)Fig.2 mRNA Expression of IL-1β and CD68 in liver tissues of each group (,n=5)
2.7 各组肝组织PCSK9、LDLR 的蛋白及mRNA表达
与对照组相比,模型组肝组织中PCSK9 的蛋白和mRNA 水平均显著升高,LDLR 的蛋白和mRNA 水平显著降低(P<0.05);与模型组相比,阿托伐他汀钙片组、芒果苷单钠盐组肝组织中PCSK9 的蛋白和mRNA 水平明显降低,LDLR 的蛋白和mRNA 水平明显升高(P<0.05),见图3。

图3 各组肝组织PCSK9、LDLR 的蛋白及mRNA 表达(,n=5)Fig.3 Protein and mRNA expressions of PCSK9 and LDLR in liver tissues of each group (,n=5)
3 讨论
长期高胆固醇可引起脂质代谢紊乱,导致LDL、极低密度脂蛋白(VLDL)过度积累,损伤内皮细胞并刺激炎性细胞因子释放,促使单核细胞分化形成巨噬细胞,巨噬细胞将过度积累的脂质吞噬,最终形成泡沫细胞,在动脉粥样硬化性心血管疾病病变的发展中起到重要作用[11]。因此,降低LDL-C 水平,减少脂质积累已成为降低动脉粥样硬化性心血管疾病发病风险的中心目标[12]。
LDLR 是分布于内皮细胞、巨噬细胞、平滑肌细胞及肝脏中的一种膜镶嵌式糖蛋白,主要通过对LDL、VLDL 等脂蛋白的内吞作用将血液中的LDLC 摄取入细胞,并直接分解代谢[13]。有报道表明,血液中约有70%的LDL-C 通过LDLR 介导的内吞作用清除[14]。在机体LDLR 数量或功能出现异常时,可造成胆固醇水平异常,引发动脉粥样硬化性心血管疾病等心血管疾病[15]。PCSK9 是一种具有脂质代谢调节作用的基因,通过与细胞表面的LDLR结合形成PCSK9/LDLR 复合物,PCSK9/LDLR 随后转运至溶酶体隔室,诱导LDLR 降解,减少LDLR再循环,从而降低血清LDL 的清除率,导致LDLC 水平升高[16]。目前PCSK9 已作为动脉粥样硬化性心血管疾病的新兴治疗靶点成为研究热点。在高胆固醇血症模型中,通过抑制PCSK9,上调LDLR的表达水平可达到降低血脂水平,改善胆固醇代谢的作用[17]。
芒果苷又名知母宁,是由知母根茎中提取分离的双苯吡酮类黄酮类活性成分,现代药理研究表明,其具有抗炎、抗病毒、抗氧化活性及降糖、保肝、调节血脂等功能,在心血管、呼吸及中枢神经系统疾病中可发挥作用[18]。有研究将芒果苷进行结果修饰转化成钠盐,得到芒果苷单钠盐,改善了其溶解性[9]。在链脲佐菌素诱导的糖尿病小鼠模型中,芒果苷单钠盐可有效改善小鼠糖脂代谢,减轻胰岛素抵抗[19]。本实验采用SD 大鼠制备高胆固醇血症模型,连续ig 芒果苷单钠盐,结果显示,芒果苷单钠盐能够有效改善大鼠脂代谢异常,降低血液中TC、LDL-C 水平及肝组织中FC 含量,提升肝组织TBA 的含量;HE 染色结果可见,经治疗后大鼠肝脏脂肪变性明显改善,证实了其调脂、改善肝脏脂质堆积作用。同时,大鼠血清相关酶类CRE、UREA、CK、LDH 的水平均有较为显著地降低,提示芒果苷单钠盐可改善高脂引起的肾脏功能和心肌血氧功能损害。
巨噬细胞激活后可分泌IL-1β 等炎性因子,造成肝脏炎性浸润[20]。本研究中,经芒果苷单钠盐干预后大鼠肝组织中IL-1β和巨噬细胞标记物CD68的mRNA 水平均明显降低,提示芒果苷单钠盐可通过抑制巨噬细胞活化减轻肝脏炎症反应,发挥调脂和保肝的双重作用。进一步探究其对PCSK9/LDLR途径的作用发现,模型组肝组织中PCSK9 的蛋白和mRNA 表达较对照组显著增多,LDLR 的蛋白和mRNA 表达明显减少,芒果苷单钠盐干预后,明显下调了PCSK9 表达水平的升高,同时上调了LDLR的水平。
综上所述,芒果苷单钠盐可有效降低高脂饲料引起的脂质代谢紊乱,改善肝脏脂质堆积和炎症,减轻心肾功能损害,其作用机制可能与调控肝脏PCSK9/LDLR 信号通路相关。
利益冲突所有作者均声明不存在利益冲突
