电针预处理对脑缺血再灌注损伤大鼠神经功能及缺血半暗带区VEGF、CD31 表达的影响
2023-09-25谭佳佳唐丽亚孙晓莹易细芹瞿启睿
谭佳佳,唐丽亚,孙晓莹,易细芹,瞿启睿,艾 坤*,周 璐*
1.湖南中医药大学针灸推拿与康复学院,湖南 长沙 410208;2.郴州市第一人民医院康复医学科,湖南 郴州 423000
缺血性脑卒中是指由于脑的供血动脉狭窄或闭塞、脑供血不足导致的脑组织坏死的总称[1-3]。 目前认为,再灌注损伤是脑缺血的重要病理过程,其中梗死病灶主要由中心坏死区及其周围的缺血半暗带组成,该区血管新生以及微血管重建可迅速改善局部血流,是减轻再灌注损伤的关键[4]。 血管内皮生长因子(vascular endothelial growth factor, VEGF)是最重要的血管生成因子,在胚胎血管发育和成人生理及病理条件下的血管生成过程中起关键作用[4]。 血小板-内皮细胞黏附分子(platelet endothelial cell adhesion molecule-1, CD31)在发育中和成熟个体的所有血管内皮细胞均有高度表达,CD31 表达越高,提示微血管数量越多,是一种重要的微血管标志物[5]。
预处理的思想与中医学“治未病”相互对应,古往今来就有针灸防病的先例。临床研究表明,电针可以有效减轻缺血性脑卒中神经功能障碍、改善脑组织血液循环、改善患者患病后日常生活质量[6-7]。 近年来,关于电针预处理的研究越来越多:李雪静等[8-9]研究证实,电针预处理可以改善急性脑缺血再灌注损伤大鼠神经功能缺损、增强脑组织保护作用,其机制可能与细胞自噬及凋亡调控有关;程爱芳[10]研究表明,电针预处理可诱导脑内缺血耐受、增加缺血组织VEGF、CD34 表达、改善缺血区血供、减少梗死面积及降低脑损伤程度。
本研究拟采用于造模前电针百会、水沟、大椎对大鼠进行预处理后,再行大脑动脉栓塞(medial cerebral artery occlusion, MCAO)造模后再灌注,通过观察电针预处理对缺血再灌注损伤大鼠神经功能、脑梗死体积及半暗带区脑组织VEGF、CD31 表达的影响,判断电针预处理与半暗带区血管新生的关系,从而探索电针预处理改善脑缺血再灌注损伤的可能作用机制。
1 材料与方法
1.1 实验动物与分组
健康雄性SD 大鼠36 只,由湖南斯莱克景达实验动物有限公司提供(许可证号:430727211101797368),体质量(190±10) g。36 只大鼠以3 只一笼饲养于湖南中医药大学动物实验中心,实验室温度(25.0±1) ℃,湿度60%±10%。适应性喂养7 d 后,根据随机数字表法将其分为假手术组、模型组、电针预处理组,每组12 只。实验全程均遵从《关于善待实验动物的指导性意见》(2006 年版)中的动物伦理学相关规定(伦理审批号:LL2021072802)。
1.2 主要试剂与仪器
TTC 染液(批号:G1017)、HE 染液(批号:G1005)、分化液(批号:G1005-3)、返蓝液(批号:G1005-4)、EDTA(pH 8.0)抗原修复液(批号:G1206)、EDTA(pH 9.0)抗原修复液(批号:G1203)、柠檬酸(pH6.0)抗原修复液(批号:G1202)、PBS 缓冲液(批号:G0002)、正常兔血清(批号:G1209)、组化试剂盒DAB 显色剂(批号:G1211)、BSA(批号:G5001)、一抗CD31(批号:GB113151)、二抗HRP 标记山羊抗兔(批号:GB23303)、脱色摇床(型号:TSY-B)、涡旋混合器(型号:MX-F)、掌上离心机(型号:D1008E)均来自武汉赛维尔生物科技有限公司;鼠抗VEGF(武汉三鹰生物技术有限公司,货号:66828-1-lg);水合氯醛、中性树胶(国药集团化学试剂有限公司,批号:30037516、10004160)。 MCAO 线栓(北京西浓科技有限公司,货号:A4-263450);电子针疗仪(华佗牌,型号:SDZII);超净工作台(苏州安泰空气技术有限公司,型号SWCJ-1FD);加热台灯(佛山市顺德区欧雅仕照明电器有限公司,型号:GD-2071);脱水机、包埋机(武汉俊杰电子有限公司,型号:JJ-12J、JB-P5);病理切片机(上海徕卡仪器有限公司,型号:RM2016);组织摊片机(浙江省金华市科迪仪器设备有限公司,型号:KD-P);正置光学显微镜、成像系统(日本尼康,型号:Nikon Eclipse E100、Nikon DS-U3);恒温水浴锅(姜堰市无力医疗器械厂有限公司,型号:TL-42OD);刀片(上海徕卡仪器有限公司,型号:LEICA819)。
1.3 干预方法
假手术组、模型组大鼠常规饲养,均以俯卧位固定于自制的大鼠固定器上30 min。 电针预处理组大鼠俯卧位固定于自制的大鼠固定器上,进针点为动物纹身仪标记处,选用30 号1寸针进行针刺,百会平刺2 mm、水沟直刺2 mm、大椎斜刺3 mm,进针后接电子针疗仪,一组电极连于百会和水沟,另一组电极连大椎和尾尖,疏密波(20/100 Hz),每次留针30 min。于适应性喂养7 d 后分组并开始干预,每天1 次,共干预7 次。
1.4 模型制备
干预7 d 后,模型组、电针预处理组第8 天参照Zen Longa 方法进行造模[11]。 大鼠麻醉消毒后,从颈部正中切开皮肤,钝性分离皮下组织,随后分离颈总、颈外、颈内动脉,并结扎颈总动脉近心端和颈外动脉,使用动脉夹夹闭颈内动脉,并在颈总动脉处用眼科剪剪一小口;插入预先准备好的栓线,插入深度为18~20 mm(栓线黑色标记处大约在分叉处),用4.0 细线结扎好线栓并缝合肌肉和皮肤,缝好后的大鼠放入笼中,缺血2 h 后向外抽出栓线约10 mm,从而形成脑缺血再灌注模型。 待造模大鼠清醒后行神经功能缺损评分(neurological severity scores, NSS)法评估神经功能:无神经功能缺损症状为0 分;提尾时栓塞动脉对侧前肢不能伸直为1 分;行走时向栓塞动脉对侧旋转为2 分;行走时向栓塞动脉对侧倾倒为3 分;无法自由活动,无自主意识为4 分[12]。评分在l~3 分者纳入实验。 由于脑缺血再灌注造模实验较易引起动物死亡,故按照随机分组原则对各组死亡样本进行补充,保障每组完整实验结果。假手术组大鼠仅切开皮肤。
1.5 取材方法
各组大鼠行NSS 法评估神经功能缺损后,用10%水合氯醛(3.5 mL/kg)腹腔注射麻醉,左心室灌注固定,迅速断头取脑,用冰生理盐水冲洗,用4%多聚甲醛固定24 h 后进行石蜡包埋、切片。 在确定取样具体部位时,通过对文献检索,选择最为广泛使用的Ashwal 法[13]将大鼠脑组织切成3片。从额叶的前尖端开始2 mm 处向后测量4 mm,冠状切片,取4 mm 的切片用于检测,确定4 mm 的切片的两个半球之间中心线,也就是大鼠脑组织的纵向中线,然后从中线向梗死侧测量2 mm,进行纵向切割,排除由大脑前动脉供血的中脑半球结构,然后将切片的断面看成一个钟面,从大约2 点和8 点之间连线与中线旁开2 mm 的平行线呈夹角,夹角内的部分就是缺血半暗带取样区。
1.6 指标检测
1.6.1 NSS 法评估神经功能 大鼠于手术结束后放回笼中进行观察,自由饮食。于灌注后24 h,进行神经功能评分,采用NSS 法分别进行运动试验、感觉实验、平衡木试验、反射丧失和不正常运动试验评分并记录,总分为18 分,分数越低表示功能越健全,0分表示功能完全健全。
1.6.2 TTC 染色检测脑梗死面积 断头法处死大鼠后迅速取脑(10 min 内),置于0~4 ℃磷酸盐缓冲液(phosphate buffered saline, PBS)溶液中转移,-20 ℃冰箱冷冻30 min。 切取脑片厚度为2 mm,将切片放入2%红四氮唑溶液中,37 ℃避光水浴30 min,每5 min 轻微晃动容器,使充分染色。 取出脑片用PBS溶液洗涤3~5 min,拍照记录,用10% 中性甲醛固定脑片6 h。 用病理图文分析系统进行图像分析,测量每片的梗死面积和总面积。 梗死体积=各层梗死面积之和×层间隔;相对梗死面积=(对侧区域面积-同侧非梗死面积)/对侧区域面积。
1.6.3 HE 染色观察脑组织形态变化 制作石蜡切片(同TTC 染色切片方法,便于后期宏观和微观的对比);依次将切片放入二甲苯Ⅰ20 min、二甲苯Ⅱ20 min、无水乙醇Ⅰ5 min、无水乙醇Ⅱ5 min、75%乙醇5 min,自来水洗;将切片置入苏木素染液染3~5 min,自来水洗,分化液分化,自来水洗,返蓝液返蓝,流水冲洗;再进入85%、95%的梯度乙醇脱水各5 min,入伊红染液中染色5 min;染色后依次放入无水乙醇Ⅰ5 min、无水乙醇Ⅱ5 min、无水乙醇Ⅲ5 min、二甲苯Ⅰ5 min、二甲苯Ⅱ5 min 脱水透明,中性树胶封片;显微镜镜检,图像采集分析。
1.6.4 免疫组织化学测定缺血半暗带区脑组织中VEGF、CD31 的相对表达量 冰冻脑组织切片室温晾干,置于4%多聚甲醛固定10 min,组织切片置于盛满乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)抗原修复缓冲液(pH 9.0)的修复盒中,于微波炉内进行抗原修复。 洗涤3 次后放入3%过氧化氢溶液水溶液,室温避光孵育25 min,洗涤3 次甩干后用组化笔在组织周围画圈(防止抗体流走),在圈内滴加用3%牛血清白蛋白(bovine serum albumin,BSA)均匀覆盖组织,室温封闭30 min。弃封闭液,在切片上滴加PBS 按1∶1 000 比例稀释好的一抗,4 ℃孵育过夜。 洗涤3 次后在圈内滴加组化试剂盒内与一抗相应种属的二抗(HRP 标记,稀释比例1∶500)覆盖组织,室温孵育50 min。 洗涤3 次后在圈内滴加新鲜配制的双抗体(double antibody, DAB)显色液,显色后用自来水冲洗切片终止显色。 苏木素复染3 min 左右,自来水洗。 最后将切片依次放入75%乙醇5 min、85%乙醇5 min、无水乙醇Ⅰ5 min、无水乙醇Ⅱ5 min、二甲苯Ⅰ5 min 脱水透明,将切片从二甲苯拿出来稍晾干,中性树胶封片。 显微镜镜检,图像采集分析。
1.7 统计学方法
2 结果
2.1 各组大鼠NSS 法评分结果
与假手术组相比,模型组、电针预处理组NSS法评分均显著增高(P<0.01);与模型组比较,电针预处理组NSS 法评分降低(P<0.05)。 详见表1。
表1 各组大鼠NSS 法评分结果(±s,分)

表1 各组大鼠NSS 法评分结果(±s,分)
注:与假手术组相比,**P<0.01;与模型组相比,#P<0.05。
组别假手术组模型组电针预处理组n 12 12 12分数0 13.750±0.250**8.750±0.250**#
2.2 各组大鼠脑梗死体积结果
造模24 h 后,各组大鼠取完整脑组织行TTC染色并分析脑梗死体积,白色区域为梗死部分,详见图1。除假手术组无脑梗死外,模型组和电针预处理组均有不同程度的脑梗死,与假手术组比较,差异有统计学意义(P<0.01);与模型组相比,电针预处理组脑梗死体积明显减少,差异有统计学意义(P<0.01)。详见表2。

图1 各组大鼠脑梗死情况
表2 各组大鼠脑梗死体积结果(±s,cm3)
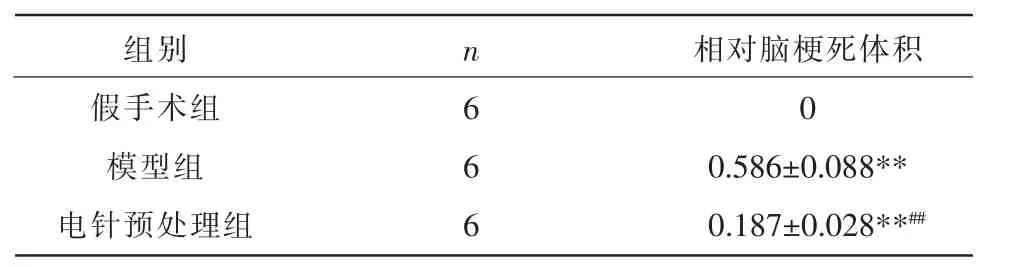
表2 各组大鼠脑梗死体积结果(±s,cm3)
注:与假手术组相比,**P<0.01;与模型组相比,##P<0.01。
组别假手术组模型组电针预处理组n6 66相对脑梗死体积0 0.586±0.088**0.187±0.028**##
2.3 各组大鼠缺血半暗带区脑组织HE 染色结果
脑组织病变在海马区及大脑皮质区域较为显著,本实验结果主要截取海马区及大脑皮质区作为展示。 假手术组大鼠右侧大脑海马区及皮质区域细胞排列有序,无肿胀变形,细胞壁连续,核仁居中,细胞与细胞之间紧密排列,未见炎性细胞浸润,偶见破损细胞;模型组大鼠海马区及皮质区域细胞排列紊乱,呈肿胀状,核仁偏居于细胞一侧或深染固缩或呈嗜酸性样改变,细胞与细胞之间间隙增大,间质水肿明显,毛细血管管腔塌陷,细胞损伤显著增加;电针预处理组大鼠海马区及皮质区域细胞较模型组损伤程度减轻,排列轻度紊乱,细胞肿胀不明显。详见图2—3。

图2 各组大鼠海马区HE 染色结果(×100)

图3 各组大鼠缺血区大脑皮质染色结果(×100)
2.4 各组大鼠缺血半暗带区脑组织VEGF、CD31免疫组化结果
与假手术组相比,模型组半暗带区脑组织中CD31表达明显增加(P<0.01);与模型组相比,电针预处理组CD31 表达明显增加(P<0.01)。 详见图4、表3。

图4 各组大鼠缺血半暗带区CD31 表达结果(×400)
表3 各组大鼠缺血半暗带区脑组织CD31 表达结果(±s)

表3 各组大鼠缺血半暗带区脑组织CD31 表达结果(±s)
注:与假手术组相比,**P<0.01;与模型组相比,##P<0.01。
组别假手术组模型组电针预处理组n 6 6 6 CD31 8.483±0.220 12.816±0.697**17.676±0.315**##
与假手术组相比,模型组半暗带区脑组织VEGF阳性表达率明显增多(P<0.01);与模型组相比,电针预处理组半暗带区脑组织VEGF 阳性表达率明显增多(P<0.01)。 详见图5、表4。
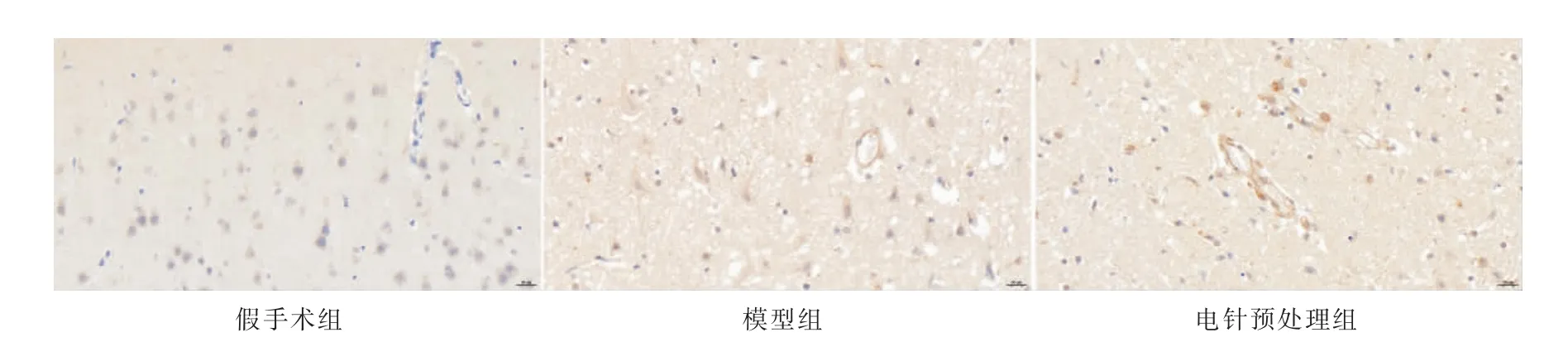
图5 各组大鼠缺血半暗带区VEGF 表达结果(×400)
表4 各组大鼠缺血半暗带区脑组织VEGF 表达结果(±s)

表4 各组大鼠缺血半暗带区脑组织VEGF 表达结果(±s)
注:与假手术组相比,**P<0.01;与模型组相比,##P<0.01。
组别假手术组模型组电针预处理组n6 66 VEGF 10.767±0.573 13.610±0.243**15.177±0.439**##
3 讨论
缺血性脑卒中属于中医学“中风病”范畴,是医学临床常见病症之一[1]。 该病起病急、变化快,具有极高的死亡率和致残率,大部分患者在发病前会出现明显的前驱症状,因此,如何预防脑卒中疾病的发生是降低患者临床安全风险的重要举措[1-3]。 “中医治未病理论”是当前医学临床预防疾病发生和预防病变的重要措施[14-15]。 本研究亦从中医治未病角度出发,造模前采取电针干预的方式,观察大鼠发生脑缺血再灌注后的症状以及脑组织梗死的情况,从而判断电针预处理的预防效果及可能机制。 本研究结果显示,相比于假手术组,模型组大鼠NSS 评分明显增高、脑梗死体积增大;电针预处理组神经功能损伤情况、脑梗死体积均低于模型组。 从组织形态学上来看,模型组大鼠右侧海马区及皮质区域在造模后出现了明显的细胞排列紊乱、细胞与细胞之间间隙增大、间质水肿明显、毛细血管管腔場陷;相比于模型组,电针预处理组在以上方面均有所改善。 此外,电针预处理组半暗带区VEGF、CD31 表达明显高于模型组。
中医学认为,中风病多由脉络空虚、卫外不固、风寒等邪乘虚侵袭而滞留闭塞于经络所致[1]。 临床治疗该病重在开窍,辨证灵活运用滋阴潜阳、平肝熄风、通腑化痰、健脾利湿、益气养血等治则。 针刺具有醒脑开窍、调节气血等功效。 本研究所选百会可开窍醒脑、振奋阳气,水沟可解痉熄风、调和阴阳,大椎可开通督脉、活血行气[16-18]。 本实验中,电针预处理组大鼠脑梗死体积、神经损伤情况较模型组均改善,这与许秀洪等[19-20]研究结果一致。
脑缺血再灌注损伤是导致缺血性卒中患者神经功能损害的主要原因[2],早期脑梗死患者的缺血半暗带区神经元保留了部分蛋白合成和基因表达的能力,及时恢复其血流则能恢复其功能[3]。 VEGF 作为一种高度特异性血管生长因子,参与多个血管新生过程,其含量与血管新生程度呈正相关;CD31 常见于血小板、内皮细胞等细胞表面,是一种细胞黏附分子,作为血管内皮特异性标志物,其增加将提示血管丰度的提高,从而改善脑血流的循环代谢[21-22]。 本实验结果显示,电针预处理后大鼠脑组织中的VEGF、CD31 表达较模型组明显增加,提示电针预处理组大鼠缺血半暗带区血管新生程度明显高于模型组。
综上所述,经电针预处理后,脑缺血再灌注损伤大鼠神经功能损伤降低、脑梗死体积减少,缺血半暗带区VEGF、CD31 表达增多,这可能与电针预处理促进缺血半暗带区血管新生有关。 通过电针提前干预提高血管新生能力,一定程度上为缺血性脑卒中的预防提供了新思路,本课题组将围绕该方向开展更加深入的研究。
