牛膝总皂苷对IL-1β 诱导髓核细胞的凋亡及炎性损伤的影响
2023-09-25李硕夫刘宏哲张嘉麟郭彦涛刘笑蓉
李硕夫,刘宏哲,张嘉麟,杨 雷,陈 龙,郭彦涛,刘笑蓉*
1.湖南中医药大学第一附属医院,湖南 长沙 410007;2.湖南省人民医院,湖南 长沙 410002;3.中南大学,湖南 长沙 410083;4.湖南中医药大学,湖南 长沙 410208
腰痛是临床上最为常见的症状之一[1],流行病学显示,全球约有80%的人会在一生中经历一次腰痛[2],其中24%~80%的人在一年内会再次发作[3];而在我国, 腰痛已经成为45 岁以下人群丧失劳动能力的首要原因[4]。 椎间盘退行性变性(intervertebral disc degeneration, IDD)被认为是引起腰痛的主要原因[5-6],其病变本质可能是免疫炎症反应及氧化应激损伤等引起的髓核细胞(nucleus pulposus cell,NPC)数量减少和功能下降,以及细胞外基质(extracellular matrix, ECM)代谢的异常[7]。白细胞介素-1β(interleukin-1β, IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-6(interleukin-6,IL-6)及环氧合酶-2(cyclooxygenase-2, COX-2)等炎症因子被认为是引起IDD 和腰痛的关键介质,在IDD 中显著上调,并且参与NPC 凋亡以及ECM 的降解,是引起IDD 的重要原因之一[8-10]。因此,抑制炎症因子的表达,减少细胞凋亡和ECM 降解是改善IDD的主要方法。 此外,积极寻找抑制NPC 炎性损伤,减少NPC 凋亡的药物,对于延缓IDD 也至关重要。
IDD 属于中医学“痹病”“腰痛”范畴,中医病机主要是肝肾亏虚,腰府失养,瘀血阻络,治疗以补肾活血为主。牛膝具有补肾、健骨、强脊等功效,是临床上治疗腰痛病的常用中药之一,其有效成分牛膝总皂苷(achyranthes bidentata saponins, ABS)被证实具有抑制软骨细胞炎症反应[11]、促进软骨细胞增殖[12]、抑制软骨细胞凋亡[13]等作用,并可抑制COX-2 的产生[14]。NPC 被称为“类软骨细胞”,其与关节软骨细胞的结构和生存环境十分相似。 ABS 是否能抑制NPC的炎性损伤,减少凋亡,抑制ECM 降解,促进NPC数量及功能恢复等,还未见相关报道。 本实验以人源NPC 为研究对象,通过IL-1β 诱导建立NPC 退变模型,观察ABS 对NPC 的凋亡、炎症及ECM 代谢的影响,并初步探究ABS 对NPC 损伤的保护作用及机制,以期为延缓IDD 和临床应用ABS 提供科学依据。
1 材料与方法
1.1 细胞
退行性NPC(批号:LY0104)购自赛百慷(上海)生物技术股份有限公司。
1.2 主要试剂
牛膝(批号:A220113)、胰酶消化液(批号:01A220418)、双抗青/链霉素(货号:SV30010)均购自上海碧云天生物技术有限公司;胎牛血清(批号:8122618,美国Grand Island Biological Company 公司);细胞冻存液(批号:20220809)、磷酸盐缓冲液(phosphate buffer saline, PBS)(批号:08A230615)、RIPA 裂解液(批号:04B230707)、蛋白磷酸酶抑制剂(批号:01B230713)、SuperECL Plus 超敏发光液(批号:06C230629)、10%过硫酸铵(ammonium persulfate, APS)(批号:02C230726)、10%十二烷基硫酸钠(sodium dodecylsulfate, SDS)(批号:01D230727)、四甲基乙二胺(批号:03D230615)均购自长沙艾碧维生物科技有限公司;CCK-8 试剂盒(批号:PN659,日本同仁化学研究所);凋亡试剂盒(批号:20220731,江苏凯基生物技术股份有限公司);B 细胞淋巴瘤-2相 关X 蛋 白(B-cell lymphoma-2-associated X pro tein, Bax)抗体(批号:GR3275117-9)、B 细胞淋巴瘤-xl(B-cell lymphoma-xl, Bcl-xl)抗体(货号:ab32370)、血小板结合蛋白基序的解聚蛋白样金属蛋白酶-5(recombinant a disintegrin and metalloproteinase with thrombospondin-5, ADAMTS-5)抗体(批号:GR116650-1)、COX-2 抗体(货号:ab179800)、β-actin(货号:66009-1-Ig)均购自英国艾博抗(上海)贸易有限公司;天冬氨酸蛋白水解酶3(cysteinyl aspartate specific proteinase, Caspase-3)抗体(货号:19677-1-AP)、基质金属蛋白酶-3(matrix metalloproteinase-3, MMP-3)抗体(货号:17873-1-AP)、HRP 山羊抗小鼠IgG 抗体(货号:SA00001-1)、HRP山羊抗兔IgG 抗体(货号:SA00001-2)均购自美国Proteintech 公司。
1.3 主要仪器
超净工作台(北京亚泰科隆仪器技术有限公司,型号:YT-CJ-2NB);倒置生物显微镜(北京中显恒业仪器仪表有限公司,型号:DSZ2000X);电泳仪、电泳槽、转膜仪(北京六一仪器厂,型号:DYY-6C、DYCZ-24DN、DYCZ-40D);多功能酶标分析仪(深圳市汇松科技发展有限公司,型号:MB-530);低速离心机(上海知信仪器公司,型号:SL02)。
1.4 实验方法
1.4.1 ABS 制取与定量测定 按照标准的川牛膝总皂苷提取流程提取ABS[15]:称取川牛膝100 g,放入圆底烧瓶(2 L),加入95%乙醇1 L,加热回流提取3 次,1 h/次,合并提取液,70 ℃水浴旋蒸浓缩至无醇味,剩余提取液加入纯水定容至1 L,超声10 min,抽滤后量取150 mL 抽滤液,经大孔吸附树脂柱,然后使用600 mL 的纯水将其中水溶性成分洗脱并丢弃,接着再用70%乙醇500 mL 继续洗脱,并收集此洗脱液干燥,直至重量不再变化。 以齐墩果酸对照品为参照,最后使用紫外可见分光光度法分析。
1.4.2 NPC 退变模型的建立及实验分组 将对数生长期的NPC,按照1×105个/孔接种于96 孔板中,IL-1β 和ABS 浓度参考相关文献[16-17]设定,设置5 个组,每组5 个复孔:正常组、模型组(10 ng/mL 的IL-1β)、ABS 低剂量组(10 ng/mL 的IL-1β+3 μg/mL ABS)、ABS 中剂量组(10 ng/mL 的IL-1β+10 μg/mL ABS)和ABS 高剂量组(10 ng/mL 的IL-1β+30 μg/mL ABS)。 按照分组建立细胞培养体系后,将各处理组细胞置于37 ℃,5%CO2培养箱中培养24 h,结束后收集细胞,进行后续实验研究。
1.4.3 Tunel 法及流式细胞术检测NPC 凋亡 (1)Tunel染色观察NPC 凋亡。 收集各组处理后的NPC,制作爬片,固定,按照Tunel 凋亡试剂盒说明书步骤操作。显微镜下计数凋亡细胞数及总细胞数,计算凋亡指数。(2)流式细胞术检测细胞凋亡。收集各组处理后的NPC,使用PBS 将收集到的细胞洗涤2 次,再2 000 r/min,离心5 min,离心半径为9 cm。 然后按照说明书,将500 μL 的结合缓冲液悬浮细胞加入试管,先加入5 μL Annexin V-APC 混匀,再加入5 μL 碘化丙锭溶液混匀,最后在室温、避光条件下使其充分反应10 min,并在1 h 内使用流式细胞仪观察、检测。
1.4.4 CCK-8 实验检测细胞活力 收集各组处理后的NPC,调整细胞浓度,按照5×105个细胞/孔密度接种于96 孔板内,每个孔加10 μL CCK-8 标准液,先使用完全培养基将CCK-8 配制浓度为10%的溶液,去除含药培养基后,再每孔加入100 μL 的上述配制含CCK-8 溶液的培养基。在37 ℃,5%CO2环境下孵育4 h,使用多功能酶标仪分析NPC 在450 nm 处的吸光度(optical density, OD)值,计算细胞存活率,对照组细胞相对存活率设定为100%,其余各组细胞相对存活率计算如下:存活率=(实验组OD 值-正常组OD 值)/正常组OD 值×100%。
1.4.5 Western blot 检 测Bax、Bcl-xl、Caspase-3、ADAMTS-5、MMP-3 及COX-2 蛋白表达情况 收集各组处理后的NPC,采用含有PMSF 的RIPA 裂解液提取细胞中的总蛋白,测量样品蛋白浓度后,上样电泳。 冰浴中给予250 mA 电流转膜。 洗涤PVDF膜,5%脱脂奶粉室温封闭90 min 后,将PVDF 膜与稀释的一抗Bax(1∶2 000)、Caspase-3(1∶1 000)、Bclxl(1 ∶1 000)、ADAMTS-5(1 ∶250)、MMP-3(1 ∶1 000)、COX-2(1∶2 000)、β-actin(1∶5 000)在4 ℃过夜温育,TBST 洗涤3 次,每次10 min,加入二抗HRP 山羊抗小鼠IgG(1∶5 000)或HRP 山羊抗兔IgG(1∶6 000),室温下孵育2 h。 膜上滴加ECL 发光显色液后,于化学发光成像系统下进行检测,使用Image Pro Plus 6.0 软件对蛋白条带进行灰度扫描,分析蛋白相对表达量。
1.5 统计学方法
使用SPSS 22.0 软件进行统计学分析,计量资料以“±s”表示,符合正态分布者采用方差分析,不符合正态分布的采用Wilcoxon 检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 ABS 对IL-1β 诱导的NPC 细胞活力的影响
与正常组比较,模型组NPC 细胞活力显著下降(P<0.01);与模型组比较,ABS 低、中、高剂量组NPC 中细胞活力明显增加(P<0.05);与ABS 低剂量组比较,ABS 中、高剂量组细胞活力明显增加(P<0.05)。 详见图1。
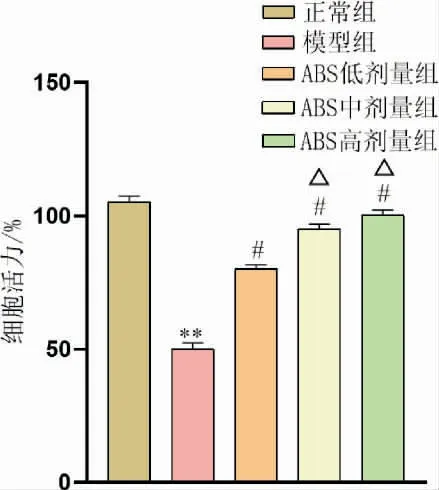
图1 不同浓度ABS 对NPC 活力的影响(n=5)
2.2 ABS 对IL-1β 诱导的NPC 阳性率及凋亡的影响
正常NPC 核呈蓝紫色,凋亡细胞核为绿色荧光。与正常组比较,模型组NPC 阳性率显著上升(P<0.01);与模型组比较,ABS 低、中、高剂量组NPC 阳性率降低(P<0.05);与ABS 低剂量组比较,ABS 中、高剂量组NPC 阳性率明显降低(P<0.05)。 详见图2。
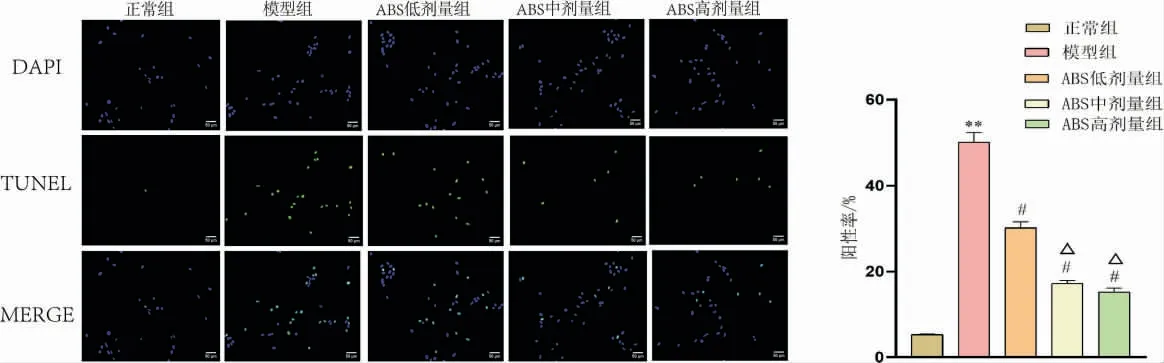
图2 不同浓度ABS 对NPC 阳性率的影响(×200)(n=5)
与正常组比较,模型组细胞凋亡率增加(P<0.01);与模型组比较,ABS 低、中、高剂量组细胞凋亡率降低(P<0.05);与ABS 低剂量组比较,ABS 中、高剂量组细胞凋亡率明显降低(P<0.05)。 详见图3。
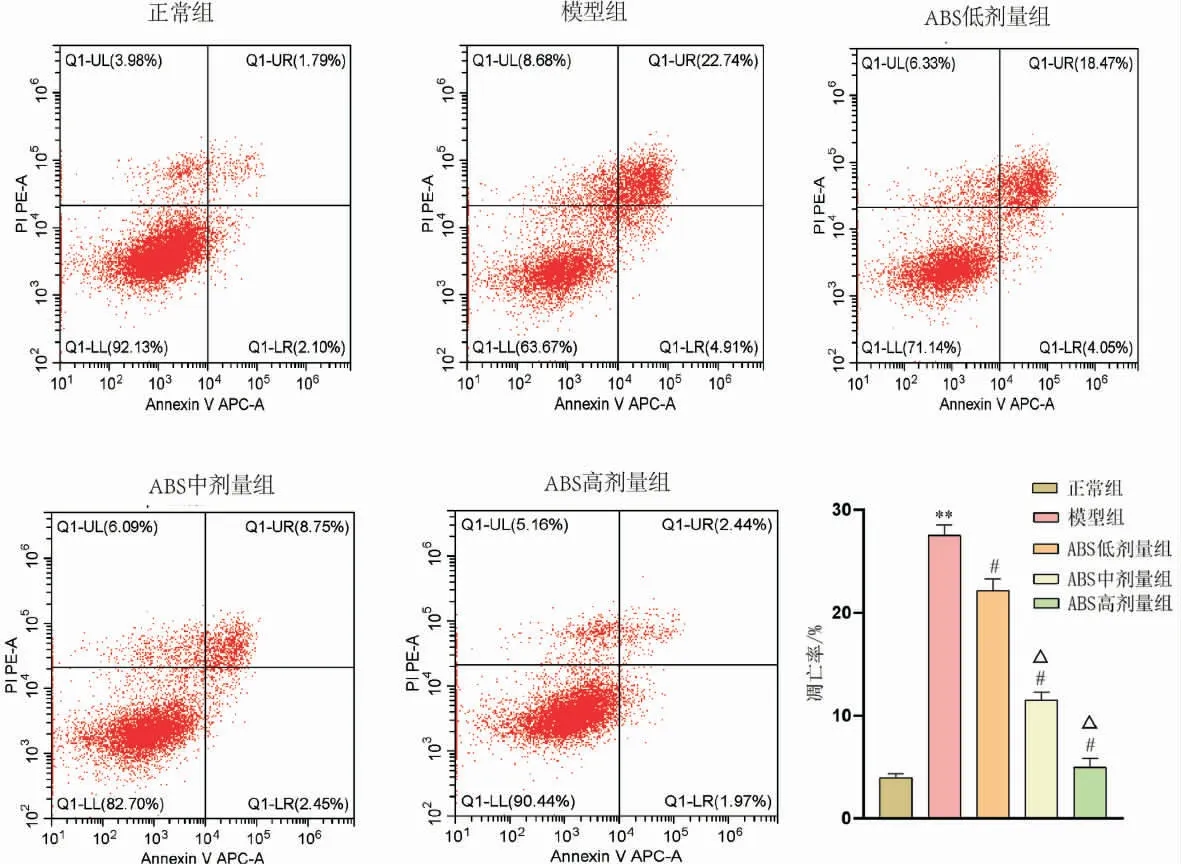
图3 不同浓度ABS 对NPCs 凋亡率的影响(n=5)
2.3 ABS 对IL-1β 诱导的NPC 的ECM 代谢相关蛋白ADAMTS-5、MMP-3 表达的影响
与正常组相比,模型组NPC 中ADAMTS-5、MMP-3 蛋白表达显著上调(P<0.05);与模型组相比,ABS 低、中、高剂量组NPC 中ADAMTS-5、MMP-3蛋白表达均显著降低(P<0.05);与ABS 低剂量组比较,ABS 中、高剂量组NPC 中ADAMTS-5、MMP-3蛋白表达降低(P<0.05)。 详见图4。

图4 不同浓度ABS 对ADAMTS-5、MMP-3 蛋白表达的影响(n=5)
2.4 ABS 对IL-1β 诱导的NPC 凋亡相关蛋白Bax、Bcl-xl 及Caspase-3 表达的影响
与正常组相比,模型组NPC 中Bax、Caspase-3蛋白表达显著上调(P<0.05),Bcl-xl 蛋白表达显著下调(P<0.05);与模型组相比,ABS 低、中、高剂量组NPC中Bax、Caspase-3 蛋白表达均显著下调(P<0.05),Bcl-xl 蛋白表达显著上调(P<0.05);与ABS 低 剂 量组比较,ABS 中、高剂量组NPC 中Bax、Caspase-3 蛋白表达降低(P<0.05),Bcl-xl 蛋白表达升高(P<0.05)。 详见图5。
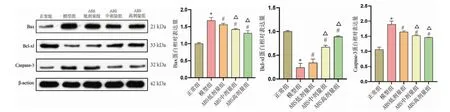
图5 不同浓度ABS 对Bax、Bcl-xl 及Caspase-3 蛋白表达影响(n=5)
2.5 ABS 对IL-1β 诱 导的NPC 炎症蛋白COX-2表达的影响
与正常组比较,模型组NPC 中COX-2 蛋白的表达显著增加(P<0.05);与模型组比较,ABS 低、中、高剂量组NPC 中COX-2 蛋白的表达显著下降(P<0.05);与ABS 低剂量组比较,ABS 中、高剂量组NPC中COX-2 蛋白表达降低(P<0.05)。 详见图6。

图6 ABS 对COX-2 蛋白表达影响(n=5)
3 讨论
腰痛属于复杂难治性疾病,中医学认为其病机主要是本虚标实,以肝肾亏虚为本,瘀血阻络为标,正如《医林绳墨·卷五》言:“故大抵腰痛之证,因于劳损而肾虚者甚多。 ”现代医学认为,腰痛与IDD 的关系密切,而IDD 的致病因素较多,与衰老、机械压力、炎症、肥胖、高血糖等因素均相关[18-19]。 椎间盘主要由ECM 和少量细胞构成,其中NPC 是主要细胞成分,也是合成ECM 的主要细胞。 IDD 表现为细胞数量下降以及ECM 合成不足、分解增多[20]。 现代研究表明,炎症反应是引起椎间盘内细胞数量下降和ECM代谢障碍的主要原因之一[5],尤其以IL-1β、TNF-α、IL-6 等为代表的炎症因子增加[21-22],不仅会刺激细胞,引发细胞凋亡,还会通过促进MMP-3、ADAMTS-5 等降解酶的增加引起ECM 中的蛋白聚糖、纤维蛋白、层粘连蛋白、弹性蛋白及胶原蛋白Ⅱ、Ⅸ、Ⅹ等物质的降解,导致椎间盘结构和功能的改变,加速IDD的病理过程[23]。 此外,COX-2 也是触发炎症反应的关键环节,过量的炎症因子累积会引起COX-2 水平快速升高至正常水平的10~80 倍[24],引起炎症部位前列腺素E2(prostaglandin-e-2, PGE2)、前列环素I2(prostaglandin-i-2, PGI2)和前列腺素E1(prostaglandin-e-1, PGE1)含量的增加,导致炎性损伤进一步加重,还会引发炎性疼痛[25]。 可见,减少炎症反应对椎间盘的损伤是延缓IDD 的重要途径。
细胞凋亡是受基因调控的程序性死亡,主要受Bcl-2 家族、Caspase 家族、癌基因、抑癌基因p53 等调控,其中Bax、Bcl-xl 及Caspase-3 等是最具有代表性的调控基因,Bax 属于促凋亡类,也是人体最主要的凋亡基因,被激活时能够形成寡聚体从细胞浆内转到线粒体膜上,与相应孔蛋白结合,改变线粒体膜的通透性,使蛋白水解酶以及细胞色素C(cytochrome C release, CytC)等激活,最后导致细胞凋亡[26]。通常情况下,当Bax 含量增多时,Bax/Bax 同源二聚体形成,使得细胞对死亡信号更敏感,启动凋亡过程[27]。Bcl-xl 属于抗凋亡蛋白,可以通过与Bax 结合形成Bax/Bcl-xl 二聚体,阻止Bax/Bax 二聚体形成,从而竞争性抑制细胞凋亡[28]。Caspase-3 则是凋亡过程中关键的执行酶,在细胞中通常以酶原的形式存在,在被激活后,被切割成小分子片段,降解各种蛋白,其凋亡的作用可被Bcl-xl 阻断[29]。
目前常用于治疗IDD 引起的腰痛的经典方法是手术切除椎间盘以减轻疼痛[30]。 但手术并不能修复或减缓潜在的退行性病变,同时还存在加重临椎IDD 的风险。相比于纯粹地机械性切除椎间盘,中医药具有多靶点、多途径、多效应的特点,具有恢复退变椎间盘生物功能、缓解病变、降低并发症等优点,已在防治腰痛及IDD 中发挥作用[31]。 牛膝是临床上防治腰痛的常用药物,中医学认为其具有补肝肾、强筋骨、逐瘀通经、引血下行的功效。 ABS 是牛膝的主要活性成分,具有抗炎、抗氧化、抗凋亡等作用[32],但其在IDD 中的研究相对较少,因此,深入研究ABS 对IDD 的治疗作用对于防治腰痛意义重大。
本研究结果显示,IL-1β 处理后的NPC,细胞凋亡及细胞阳性率显著增加,细胞活性降低,说明IL-1β 诱导可以引起NPC 炎性损伤,降低细胞活力,促进细胞凋亡。而使用不同浓度的ABS 进行干预后,NPC 的凋亡率显著下降,细胞活力显著上升,细胞凋亡率下降,说明ABS 能够对IL-1β 诱导的NPC产生保护作用,增强NPC 细胞活力,抑制NPC 细胞凋亡率。 在进一步探究其治疗机制过程中发现,IL-1β 诱导NPC 的Bcl-xl 蛋白的表达显著降低,Bax、Caspase-3、ADAMTS-5、MMP-3 及COX-2 蛋白的表达明显增加,说明IL-1β 诱导引起的炎性损伤过程中伴随着ADAMTS-5、MMP-3 等降解酶增加引起的ECM 降解,以及促凋亡因子Bax、Caspase-3 等的上升,抗凋亡因子Bcl-xl 的减少,而使用不同浓度的ABS 进行干预后,Bax、Caspase-3、ADAMTS-5、MMP-3 及COX-2 水平显著下降,Bcl-xl 显著上升,也说明ABS 可以通过抑制炎症反应、ECM 降解和细胞凋亡对NPC 产生保护作用。
综上所述,ABS 可以通过抑制由IL-1β 诱导引起的人源NPC 凋亡、炎性损伤、ECM 降解,增强细胞活性,对NPC 损伤产生保护作用,其机制可能与抑制Bax、Caspase-3、ADAMTS-5、MMP-3 及COX-2上升,促进Bcl-xl 表达有关。
