硫代氨基功能化粉煤灰空心微珠@碳纳米管吸附Cu2+研究
2023-09-25张晓民刘佳倩马健翔
王 柯,张晓民,张 良,刘佳倩,刘 冰,王 壮,马健翔
(1.西安建筑科技大学 资源工程学院,陕西 西安 710055;2.西安建筑科技大学 化学与化工学院,陕西 西安 710055)
0 引言
含铜废水主要来源于矿山开采、电镀、印染、有色金属冶炼、电子材料漂洗等领域[1]。铜离子渗透到生态环境中很难直接被自然界中的生物所降解,铜离子在污染水体中只会发生形态变化或迁移,最终进入食物链循环中,并在生物体内富集,进而破坏生物体的正常生理代谢活动[2]。吸附法具有成本低、操作简单、吸附选择性强等优点,被广泛应用于重金属离子吸附中[3]。碳材料体系是吸附法中最常用的吸附剂,碳纳米管因具有高比表面积、可控的结构以及易于表面改性的化学性质而备受学者关注,但也存在易团聚、难以在水相中分离等缺点[4]。粉煤灰中的空心微珠(CSs)表面含有适于碳纳米管生长的催化剂铁,且自身可作为载体减少碳纳米管的团聚,其作为燃煤废弃物有着极低的成本,是一种非常理想的材料。张晓民等[5]采用化学气相沉积(CVD)法在粉煤灰漂珠表面进行了碳纳米管的催化生长,并将其用于铅离子吸附,吸附容量为38.23 mg/g。
碳纳米管因表面缺乏活性基团,导致其亲水性、分散性很差,存在非常严重的团聚现象,这极大地限制了其在液相中的应用[6]。目前,对碳纳米管进行修饰的方法主要有两种:第一种方法是官能团与碳纳米管表面发生化学键合,从而被接枝到碳纳米管表面,这种方法被称为共价功能化;第二种方法是官能团与碳纳米管表面产生物理作用力,从而被吸附或包覆于碳纳米管表面,这种方法被称为非共价功能化[7-8]。相较于碳纳米管的非共价功能化改性,共价功能化改性后其特点更加突出,会显著提高其在液相溶剂中的分散性。碳纳米管的缺陷处具有很高的活性,这些高活性位点使碳纳米管具有更强的吸附能力[9],酸处理过程中的氧化反应多发生在此处,这种高缺陷密度的结构有利于引入更多的含氧官能团。而碳纳米管通过氧化纯化形成的羧基可以与其他官能团偶联,通常与亚硫酰氯反应以激活羧基,以便之后与胺或醇反应[10-12]。含有S和N的氨基硫脲(TSC)被认为是水溶液中过渡金属离子的理想络合剂,其为一种简单、有弹性的脂肪族结构,可使空间位阻最小化[13]。AHMAD等[14]利用TSC改性后的壳聚糖吸附Cu2+,结果表明,在吸附剂投加量为1.5 g/L、温度为25 ℃、吸附时间为20 min时,TSC对Cu2+的吸附率约为99%。根据软硬酸碱理论,刘畅[15]选择TSC作为改性剂来修饰多壁碳纳米管,TSC中的N、S易与Au(Ⅲ)形成稳定络合物,制备出对Au(Ⅲ)有强吸附作用的TSC-mSiO2@MWCNTs吸附剂,其对Au(Ⅲ)的最大吸附量为124.20 mg/g。
本文以粉煤灰空心微珠为载体,利用CVD法制备了粉煤灰空心微珠@碳纳米管(CSs@CNTs),并在其表面进一步接枝TSC官能团,制备出了硫代氨基功能化的粉煤灰空心微珠@碳纳米管(CSs@CNTs-TSC)吸附剂,并用于吸附水溶液中的Cu2+。通过pH、反应温度、反应时间、Cu2+初始浓度等条件探究Cu2+在CSs@CNTs-TSC表面的吸附行为与吸附机理。
1 材料与方法
1.1 原料
粉煤灰样品取自西安火力发电厂,呈灰白色颗粒状。对样品进行XRD分析,结果见图1。

图1 粉煤灰XRD图谱
由图1可知,粉煤灰主要由硅线石、莫来石、方石英以及少量赤铁矿等组成。在XRD图谱中0°~30°内存在宽化的驼峰,证明粉煤灰空心微珠中同时存在晶相和非晶相[16]。
粉煤灰是多种物质固体颗粒的混合物。未分选的粉煤灰颗粒物中包含了空心微珠、磁珠、未燃尽的碳颗粒以及不规则状硅铝酸盐,需要分选出其中的空心微珠。空心微珠的分选分为3步:①湿式筛分,本试验所使用的空心微珠粒径较小(2~10 μm),采用高频振动湿筛,利用1 000目筛网将粉煤灰样品筛出+13 μm 与-13 μm粒级产物;②磁选,将筛分后的粉煤灰与水混成浆料,通入磁选管中,在磁场作用下将磁珠分离,磁场强度设为0.25 T,磁选时间为30 min,磁选结束后收集产物在80 ℃下烘干3 h;③高温除碳,将磁选后的粉煤灰平铺于坩埚内,置于箱式电阻炉中高温(600 ℃)处理1 h。粉煤灰中不同颗粒物的EDX能谱分析结果见表1,分选前后的粉煤灰SEM图像见图2。
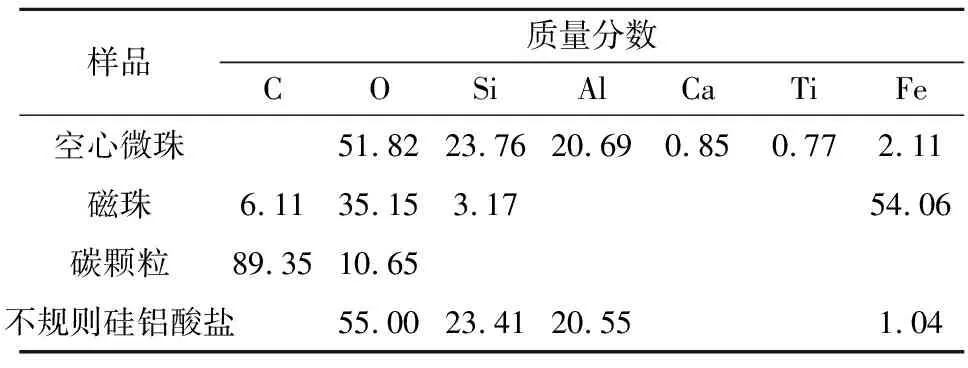
表1 粉煤灰中不同颗粒物的EDX能谱分析结果 单位:%

图2 粉煤灰分选前后SEM与光学显微镜图
结合表1和图2可知:粉煤灰中不同颗粒之间的元素组成差异较大,空心微珠中元素种类较多,主要为O、Si、Al,还有少量的Ca、Ti、Fe,部分空心微珠中因含Fe过多而呈棕色;磁珠颗粒中主要成分为O和Fe,还含有少量的C和Si;碳颗粒中主要为C,还有少量因氧化存在的O;不规则状硅铝酸盐颗粒中只含有O、Si、Al。由图2(c)和图2(d)可以看出,粉煤灰经过3步分选后可以有效选出其中的空心微珠,粒径集中在2~10 μm。空心微珠外观呈规则球状,少量呈椭球状,表面光滑,内部为中空。分选后的样品除空心微珠外,还有部分小颗粒硅铝酸盐碎片以及极少量的碳颗粒和磁性颗粒。
1.2 空心微珠@碳纳米管的制备
碳纳米管采用CVD法制备,制备过程分为4步:
a.升温阶段。将50 mg粉煤灰空心微珠均匀铺在石英方舟内,置于双温区管式炉的加热区,对管式炉进行真空排气,在N2气氛下以10 ℃/min的速率升温。
b.预处理阶段。当温度达到750 ℃后,向管式炉内通入流量为90 cm3/min的H2,持续30 min。
c.生长阶段。继续通入流量为150 cm3/min的C2H4和90 cm3/min的H2,碳纳米管开始生长,生长时间为30 min。
d.生长结束。停止加热,在N2气氛下冷却至室温,收集样品备用。
1.3 硫代氨基化空心微珠@碳纳米管的制备
取200 mg CSs@CNTs置于30 mL浓硝酸中进行酸化处理,在常温状态下磁力搅拌2 h,用蒸馏水将酸化好的样品反复冲洗至滤出液为中性,在烘箱中于80 ℃下干燥2 h,得到羧基化的CSs@CNTs。将100 mg 羧基化的CSs@CNTs分散在25 mL亚硫酰氯 (SOCl2) 中,超声处理5 min后,将混合物在70 ℃下加热24 h。减压浓缩反应混合物,然后用二氯甲烷(DCM)洗涤3次以除去过量的SOCl2,获得酰氯化的CSs@CNTs,放在真空中干燥,将干燥后的酰氯化CSs@CNTs样品再分散到50 mL无水二甲基甲酰胺(DMF)中。将3 g氨基硫脲加入反应混合物中并在100 ℃下搅拌48 h,混合物用0.45 μm聚四氟乙烯(PTFE)微孔过滤器过滤,然后用蒸馏水和乙醇洗涤固体3次,在真空状态下(80 ℃)干燥过夜,样品标记为CSs@CNTs-TSC。
1.4 吸附
取一定浓度的铜标准溶液50 mL置于100 mL锥形瓶中,加入50 mg CSs@CNTs-TSC,在恒温振荡器中振荡一定时间后,取上清液测定其浓度。吸附剂对Cu2+的吸附容量计算式为
(1)
式中:qe为Cu2+的吸附容量,mg/g;C0为溶液中Cu2+的初始质量浓度,mg/L;Ce为溶液中吸附Cu2+后的平衡质量浓度,mg/L;V为溶液体积,L;m为吸附剂的质量,g。
2 结果与讨论
2.1 材料表征
2.1.1 扫描电镜分析
图3为CSs、CSs@CNTs、CSs@CNTs-TSC的SEM图像。从图3可以看出:CSs为规则的球体颗粒,表面光滑;经过CVD法生长碳纳米管后,CSs@CNTs表面被一层厚约2 μm的碳纳米管覆盖,且同时存在少量的碳纤维,管径在20~50 nm,碳纳米管呈弯曲褶皱状,表面光滑清晰,且管体较长;而CSs@CNTs-TSC表面包覆一层沉积物,并且因导电性变差而导致图像模糊,碳纳米管管体也变短,这可能是因为酸处理对CSs@CNTs表面的碳纳米管起到了剪切作用,含氧官能团的引入以及氨基硫脲的接枝降低了碳纳米管的导电性。

图3 不同样品的SEM图
2.1.2 石墨化程度分析
图4为CSs@CNTs的Raman光谱图。两个波段的强度比(ID/IG)是描述碳纳米管石墨化程度的一个参数,D峰为碳的缺陷峰,G峰为碳的结晶峰[16]。CSs@CNTs的ID/IG为2.269,缺陷密度很高,而这种高密度的结构缺陷应该是由CNTs表面的五元环和七元环结构所致。同时,采用Boehm滴定法[17-18]测得酸化后CSs@CNTs中羧基的绝对质量分数为0.975%,证实了具有高缺陷密度的CSs@CNTs可以引入更多的含氧官能团,为后续氨基硫脲的接枝提供了更多的反应位点。
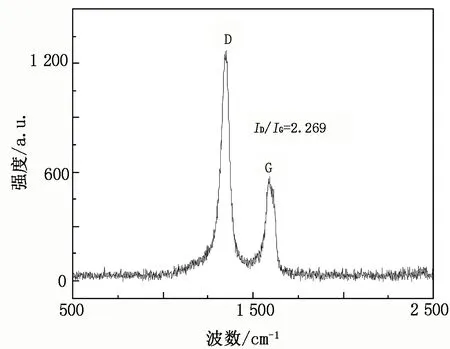
图4 CSs@CNTs的Raman光谱图
2.1.3 傅里叶红外光谱(FTIR)分析
图5为CSs@CNTs、CSs@CNTs-TSC的FTIR谱图。由图5可知:对于CSs@CNTs谱图的吸收峰,3 431 cm-1处的峰对应-OH的伸缩振动吸收峰,1 631、1 574 cm-1处出现的吸收峰是由羧基中的C=O伸缩振动引起的,并且分别在1 068 cm-1与551 cm-1处出现了微弱的Si-O、Al-O吸收峰;对于CSs@CNTs-TSC谱图的吸收峰,3 431 cm-1处的峰归属于-NH2的N-H拉伸和弯曲振动以及-OH的伸缩振动,1 631、1 574 cm-1处的吸收峰归因于羧基的C=O伸缩振动,1 025 cm-1处的吸收峰归因于C=S的伸缩振动,而Si-O、Al-O吸收峰消失。FTIR光谱分析结果表明,CSs@CNTs表面带有一定量的羧基、羟基等官能团,在TSC的修饰过程中引入了更多的羟基、羧基等官能团,并且出现了氨基、碳硫双键等新的官能团,这些官能团使得CSs@CNTs的亲水性得到了提升,同时CSs@CNTs表面也增加了可以与Cu2+发生络合作用的活性位点。
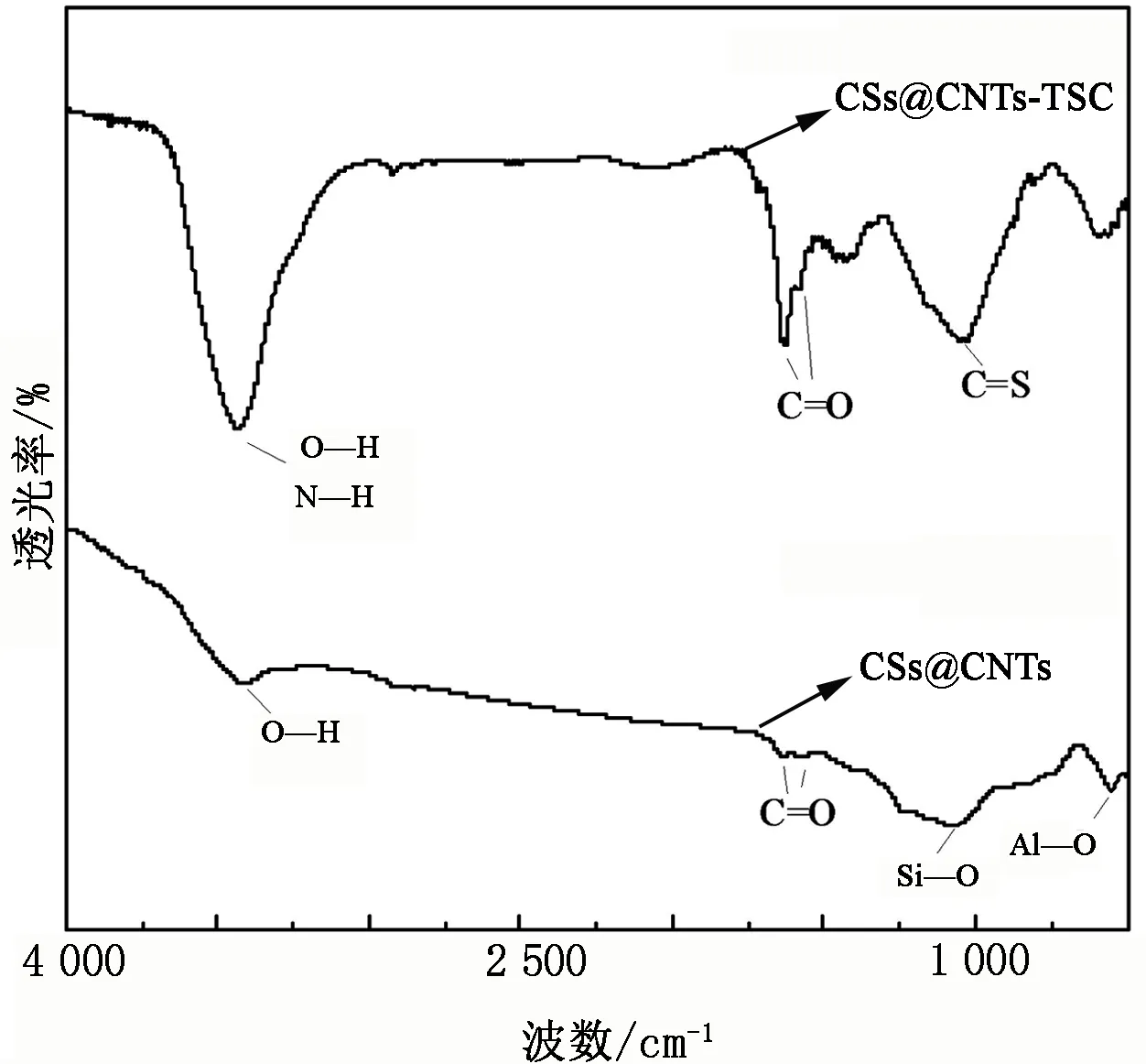
图5 CSs@CNTs、CSs@CNTs-TSC的FTIR谱图
2.1.4 Zeta电位测定
图6 为CSs@CNTs、CSs@CNTs-TSC的表面Zeta电位测定结果。由图6可知:CSs@CNTs和CSs@CNTs-TSC的表面Zeta电位均随着pH的增大而负向增加;当pH从2增至11时,CSs@CNTs的表面Zeta电位由8.82 mV降至-36.54 mV,CSs@CNTs-TSC的表面Zeta电位由4.88 mV降至-50.24 mV;两者的零电点分别位于pH为3.08、3.56处,表明两种材料在中性pH下均有很低的负电点,增大了其与阳离子的静电吸引作用;CSs@CNTs-TSC相对于CSs@CNTs而言,其表面Zeta电位整体较低,表明CSs@CNTs经过羧基化改性和接枝氨基硫脲官能团后,表面带有负电荷的基团数量增多。

图6 CSs@CNTs和CSs@CNTs-TSC的表面Zeta电位测定结果
2.2 吸附
2.2.1 对比试验
为探究CSs@CNTs接枝TSC官能团后对Cu2+吸附性能的影响,以及排除CSs@CNTs在接枝TSC时羧基化处理过程对Cu2+吸附性能的影响(将其标记为CSs@CNTs-COOH),开展了CSs@CNTs、CSs@CNTs-COOH、CSs@CNTs-TSC对Cu2+的吸附试验,结果见图7。由图7可知:3种材料对Cu2+均有一定的吸附能力,CSs@CNTs对Cu2+的吸附能力不强,吸附容量为10.59 mg/g;CSs@CNTs-COOH相较改性前对Cu2+的吸附能力有所提升,吸附容量为14.06 mg/g,这主要归因于羧基化后材料表面电位降低,与带正电的Cu2+静电相互作用加强,同时两者间质子交换作用增强;CSs@CNTs接枝氨基硫脲官能团后,吸附性能得到了大幅提高,吸附平衡时CSs@CNTs-TSC对Cu2+的吸附容量达34.00 mg/g;这是因为氨基硫脲被认为是水溶液中过渡金属离子的完美络合剂,氨基硫脲中的N=C=S杂原子共轭结构与过渡重金属离子有很强的配位络合作用[13],所以氨基硫脲官能团的接枝可以有效提高CSs@CNTs对Cu2+的吸附能力。
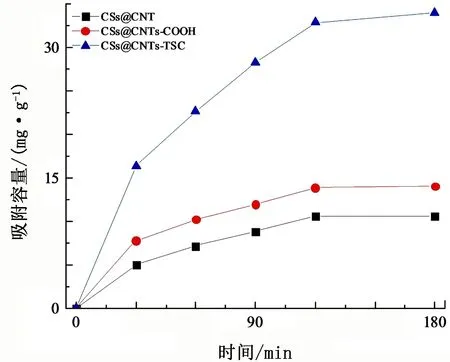
图7 CSs@CNTs、CSs@CNTs-COOH和CSs@CNTs-TSC对Cu2+的吸附试验结果
2.2.2 初始pH对吸附容量的影响
为研究pH对CSs@CNTs-TSC吸附性能的影响,选择了不同的pH进行吸附试验,测定Cu2+在pH为2~6时的吸附容量(pH大于6时有沉淀产生),温度为298 K,吸附时间为180 min,试验结果见图8。由图8可知:初始pH对CSs@CNTs-TSC吸附Cu2+的能力有十分显著的影响;pH在2~6范围内,达到吸附平衡时CSs@CNTs-TSC的Cu2+去除率随pH的增大而升高,从pH为2时的5.22 mg/g升至pH为5和6时的34.02、34.14 mg/g;当pH≤3时,溶液中存在大量的H+,此时氨基硫脲官能团质子化较严重,此时-NH2会与溶液中的H+结合形成-NH3+,吸附剂不利于与带正电的Cu2+结合,降低了CSs@CNTs-TSC对Cu2+的吸附能力。

图8 不同初始pH下达到吸附平衡时CSs@CNTs-TSC对Cu2+的吸附容量
2.2.3 吸附等温线
在25 ℃、pH为6、Cu2+质量浓度从5 mg/L升至125 mg/L的条件下,Cu2+初始质量浓度对CSs@CNTs-TSC吸附Cu2+的影响情况见图9。由图9可知:CSs@CNTs-TSC对Cu2+的吸附容量随着Cu2+初始质量浓度的升高而增大,当其升至100 mg/L时,吸附容量接近饱和;而当Cu2+质量浓度继续升高至125 mg/L时,吸附容量达到最大值。

图9 初始质量浓度对CSs@CNTs-TSC吸附Cu2+的影响情况
采用Langmuir、Freundlich吸附等温线模型描述吸附平衡数据,等温线方程分别为
(2)
(3)
式中,KL为Langmuir吸附常数;KF为Freundich吸附常数;qm为溶液中Cu2+吸附达到饱和时的吸附容量,mg/g;1/n表示偏离线性吸附的程度,当1/n=1时,为线性吸附等温线,当1/n<1时,为非线性吸附等温线。
分别采用Langmuir、Freundlich方程拟合数据,拟合曲线见图10,相关拟合参数见表2。

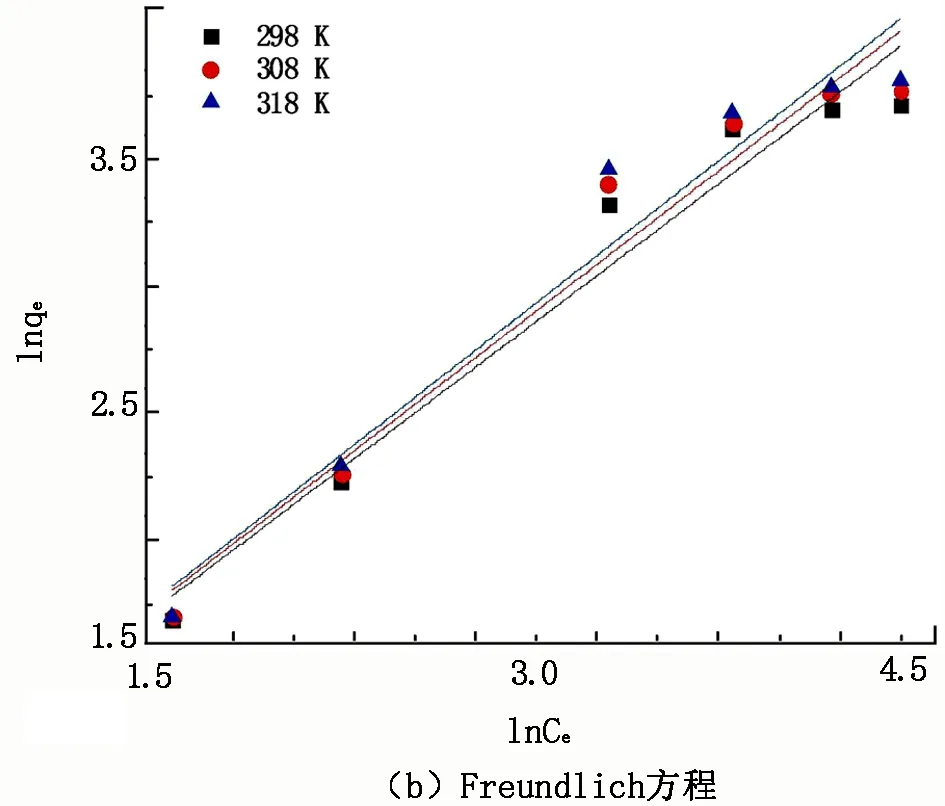
图10 不同温度下CSs@CNTs-TSC吸附Cu2+的吸附等温线模型拟合曲线

表2 CSs@CNTs-TSC对Cu2+的吸附等温线拟合参数
由图10和表2可知,Freundlich模型的线性相关系数(R2)分别为0.947 5、0.945 6、0.940 7,均大于Langmuir模型,表明Freundlich模型拟合结果与本试验数据更相符。同时说明Cu2+在CSs@CNTs-TSC表面的吸附过程是非均匀的,而Freundlich模型中的1/n值均小于1,表明吸附过程为非线性吸附。
2.2.4 吸附动力学
在25 ℃、pH为6、Cu2+质量浓度为50 mg/L的条件下,CSs@CNTs-TSC对Cu2+的吸附容量随时间的变化见图11。

图11 不同时间下CSs@CNTs-TSC对Cu2+的吸附容量
由图11可知:在5~60 min时间段,吸附容量明显增大,吸附速率逐渐降低;吸附量从5 min时的6.46 mg/g 迅速增至60 min时的29.78 mg/g;随后吸附量渐趋稳定,90 min时达到32.97 mg/g,120 min时达到34.00 mg/g,趋于吸附平衡。
通过准一阶、准二阶动力学模型来描述吸附剂CSs@CNTs-TSC对Cu2+的动力学数据,动力学方程为
log (qe-qt)=logqe-k1t,
(4)
(5)
式中:qt为t时刻对应的吸附容量,mg/g;k1为准一级吸附速率常数,min-1;k2为准二级吸附速率常数,min-1;t为吸附时间,min。
图12为298 K温度下CSs@CNTs-TSC吸附Cu2+数据准一级动力学方程和准二级动力学方程的拟合曲线,拟合结果见表3。

表3 准一级、准二级动力学方程的拟合结果
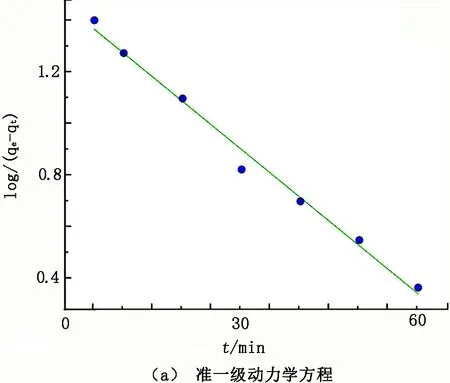
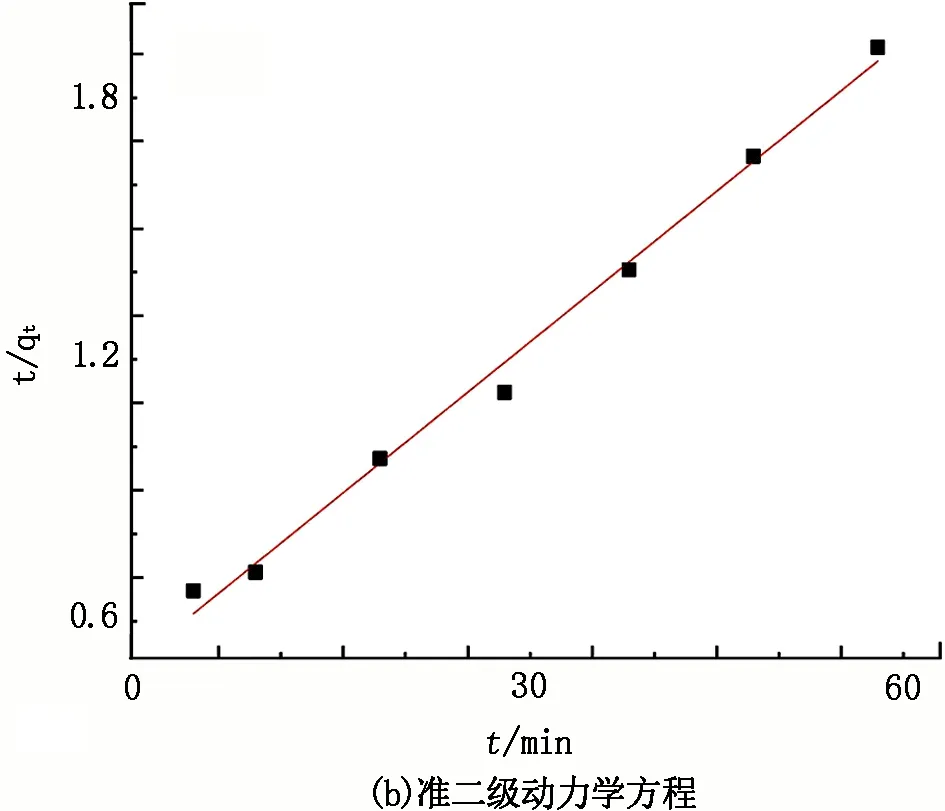
图12 CSs@CNTs-TSC吸附Cu2+动力学拟合曲线
由图12可知,CSs@CNTs-TSC吸附Cu2+的数据与两种吸附动力学模型相关性较高,准一级动力学方程和准二级动力学方程的相关系数(R2)分别为0.988 3和0.991 6,试验数据更符合准二级动力学方程。对于准二级动力学模型,其34.00 mg/g的试验吸附量与计算的32.26 mg/g吸附量接近,证实了准二级动力学模型能够较好地描述CSs@CNTs-TSC对Cu2+的吸附行为,且吸附过程主要受化学作用控制。
2.2.5 吸附热力学
通过吸附热力学研究可以进一步探讨温度对吸附性能的影响。吸附热力学参数如吉布斯自由能ΔG0、焓变ΔH0、熵变ΔS0计算公式分别为
ΔG0=ΔH0-TΔS0,
(6)
(7)
式中,Qe为平衡吸附量,mg/g;Ce为平衡质量浓度,mg/L;T为热力学温度,K;R为气体常数,取8.314 J/(mol·K)。
图13为CSs@CNTs-TSC吸附Cu2+的热力学方程拟合曲线,拟合结果见表4。
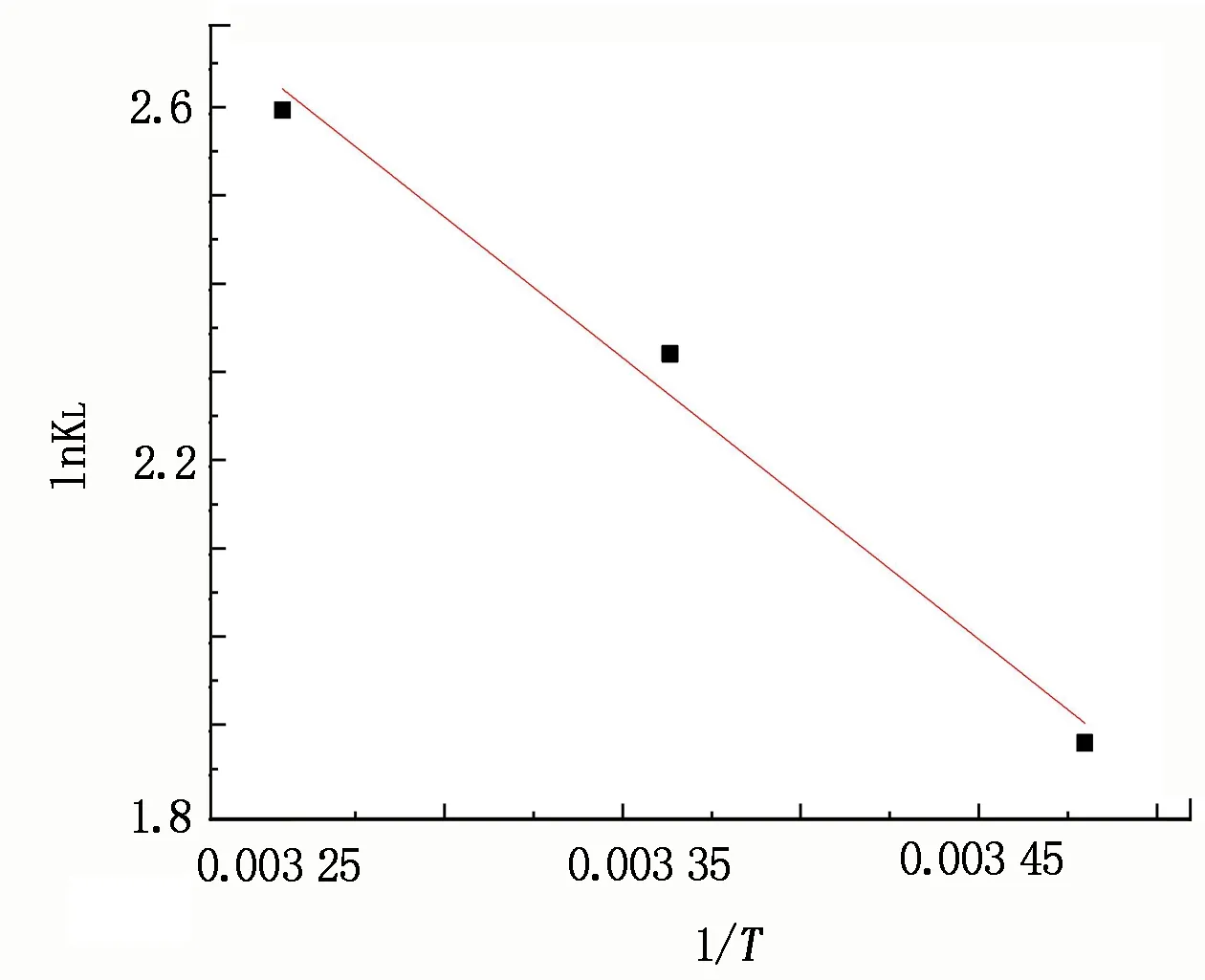
图13 CSs@CNTs-TSC吸附Cu2+的热力学拟合曲线
不同温度下,如ΔG0值为负值,表明吸附是可行且自发的;如ΔS0为正值,表示吸附过程中固溶界面处的无序性和随机性增大;如ΔH0为正值,表明吸附过程是吸热的,这意味着温度升高有利于吸附,这可能是吸附剂与Cu2+之间的有效接触机会随着温度升高而增加的缘故。

表4 CSs@CNTs-TSC吸附Cu2+的热力学参数
2.3 吸附机理
CSs@CNTs-TSC对Cu2+的吸附过程是物理吸附和化学吸附的结合,TSC官能团在吸附过程中起到了重要作用。CSs@CNTs具有高缺陷密度结构,从而含有更多的活性位点可以将Cu2+吸附至表面;其次,这种高缺陷密度的结构有利于引入大量的羧基官能团供TSC接枝。从FTIR谱图中可以看出:CSs@CNTs-TSC表面含有羧基化过程残留的羧基以及共价键合的TSC基团,残留的羧基可以通过离子交换捕获Cu2+,TSC官能团中的N和S上存在的电子可以与过渡金属离子建立配位键,形成稳定的配合物,有效地将Cu2+聚集在材料表面。从不同pH下CSs@CNTs-TSC的Zeta电位可以看出,在pH小于7时吸附剂表面电位为负,与Cu2+之间存在静电相互作用。因此,Cu2+的吸附过程包括离子交换、静电相互作用和表面络合。
3 结论
a.利用CVD法成功在粉煤灰空心微珠表面生长出了一层具有高密度缺陷的碳纳米管,CSs@CNTs的ID/IG为2.27,碳纳米管层厚约2 μm,管径在20~50 nm。
b.CSs@CNTs经过硫代氨基功能化得到了CSs@CNTs-TSC,FTIR光谱分析结果表明CSs@CNTs-TSC表面成功引入了氨基、羟基、羧基及碳硫双键等官能团,CSs@CNTs-TSC相较CSs@CNTs,其表面Zeta电位整体偏低。
c.在25 ℃、pH为5、吸附时间为120 min、Cu2+初始质量浓度为50 mg/L时,CSs@CNTs-TSC对Cu2+的吸附容量为34.00 mg/g,吸附过程符合Freundlich吸附等温线模型和准二级动力学模型,并且吸附过程为自发的吸热反应。
d.CSs@CNTs-TSC对Cu2+的吸附过程包括离子交换、静电相互作用和表面络合作用。
