猪伪狂犬病病毒变异株HN1201 gE蛋白单克隆抗体的制备与鉴定
2023-09-25牛欣蕊付朋飞鲁维飞褚贝贝
牛欣蕊,付朋飞,鲁维飞,张 超,褚贝贝,王 江*,曾 磊*
(1.河南农业大学 动物医学院,河南 郑州 450046;2.河南农业大学 农业农村部动物生化与营养重点实验室,河南 郑州 450046;3.河南农业大学 河南省动物生长发育调控重点实验室,河南 郑州 450046;4.河南城建学院 生命科学与工程学院,河南 平顶山 467036)
猪伪狂犬病(PR)是由猪伪狂犬病病毒(pseudorabies virus,PRV)引起的猪急性、致死性传染病。该病呈暴发性流行,可引起妊娠母猪流产、死胎,公猪不育,新生仔猪大量死亡,育肥猪呼吸困难、生长停滞等[1-2];该病传播速度快,20世纪60年代开始在全国范围内传播,给我国养猪业造成了巨大的经济损失[3-5]。为了控制该病传播,PRV Bartha弱毒疫苗在我国被广泛使用,部分猪场转变成PRV阴性场[6]。而2011年开始,我国北方多个猪场发生了严重的PR疫情,并迅速蔓延至我国北方大部分地区,在接种了PRV Bartha弱毒疫苗的猪场同样发生了疫情。与之前的PRV流行株相比,此次疫情的PRV基因组部分氨基酸发生突变、插入与缺失,表现出毒力增强的特点,PR疫苗对PRV变异株感染没有有效的保护作用[7]。本研究所用PRV变异株PRV HN1201与PRV Kaplan、Becker、Bartha基因组同源性分别为95.6%,95.9%和97.5%,表现出毒力增强的特点[8-9],因此,想要根除该病,除了疫苗免疫外,还应加强PRV野毒感染的检测并及时淘汰野毒感染猪。
PRV是线性双链DNA病毒,属疱疹病毒科(Herpesviridae)、α疱疹病毒亚科(Alphaherpesvirinae),病毒粒子呈球形,有囊膜和衣壳。基因组可编码约100种蛋白,其中gE基因位于PRV基因组的US区,长约1 740 bp,编码gE糖蛋白,在病毒入侵神经系统过程中发挥重要作用[10-12]。gE蛋白有4个不同的功能区,胞外域、跨膜域、胞内域和 N 端信号肽,gE 蛋白胞外区域由 438 个氨基酸组成,是病毒的主要抗原表位区,通常gE与gI通过非共价键结合,以异源二聚体的形式存在[13]。gE蛋白是病毒复制的非必须蛋白,缺失后不影响病毒的免疫原性,但毒力显著减弱。因此,PRV gE基因缺失疫苗被广泛使用[13-17],可通过检测gE蛋白来区分疫苗免疫和野毒感染[18]。本研究用PRV变异株HN1201灭活后免疫小鼠,经过一系列试验筛选出2株灵敏性高、特异性强的PRV gE蛋白单克隆抗体,并对其针对的抗原表位进行鉴定,为研究PRV感染机制、PRV gE蛋白优势抗原表位筛选以及建立快速、高效的PRV免疫学检测方法提供了依据。
1 材料与方法
1.1 细胞及主要试剂PRV HN1201、PRV QXX、PRV Bartha K61、293T细胞、PK-15细胞、SP2/0骨髓瘤细胞、pEGFP-C1质粒、重组质粒pCDNA3.0-gE-HA均由农业农村部动物生化与营养重点开放实验室保存;佐剂Quick Antibody-Mouse 5W购自Biodragon公司;HybGro培养基购自BasalMedia公司;β-丙内酯购自Solarbio公司;融合剂PEG1450、HAT/HT培养基、FITC标记山羊抗小鼠IgG(IgG-FITC)、弗氏不完全佐剂均购自Sigma公司;HRP标记山羊抗小鼠IgG购自北京鼎国昌盛生物技术责任有限公司;AEC酶底物试剂盒购自ZSGB-BIO公司;ProteinIso®Protein G Resin购自TransGen Biotech公司;Protein L Resin 购自金斯瑞生物科技股份有限公司;IgG抗体亚类鉴定试剂盒购自Sino Biological公司。
1.2 PRV HN1201病毒的增殖与纯化将PK-15细胞接种至T75细胞培养瓶,待细胞长至90%时接种PRV HN1201病毒液,细胞90%病变时,反复冻融3次,收集细胞培养物,8 000 r/min离心10 min去除细胞碎片,然后通过30%蔗糖层超速离心,纯化上清中的病毒。
1.3 小鼠免疫与抗体水平检测取PRV HN1201病毒浓缩液按500∶1比例加入β-丙内酯,混匀,4℃处理48 h对病毒进行灭活,之后按1∶1比例加入免疫佐剂Quick Antibody-Mouse 5W,混匀,按100 μL/只腿部肌肉注射免疫7周龄BALB/c小鼠。首免21 d后同剂量进行二次免疫,首免35 d后选择血清抗体水平较高的小鼠进行加强免疫。通过酶联免疫吸附试验(ELISA)检测免疫小鼠抗体水平:用PRV HN1201感染PK-15细胞约16 h,用含3%过氧化氢(H2O2)的甲醇固定细胞,取未免疫小鼠血清作为阴性对照,将免疫小鼠血清进行2倍系列连续稀释作为一抗,Goat anti mouse IgG-HRP作为二抗,按照ELISA反应条件进行筛选。
1.4 细胞融合取免疫后小鼠,无菌分离其脾脏细胞,在37℃将脾细胞与SP2/0细胞按10∶1的比例混合后1 200 r/min离心10 min,轻弹离心管使细胞沉淀混匀,加入1 mL 预热的PEG-1450,37℃作用90 s,然后连续加入DMEM至40 mL,1 000 r/min离心10 min,加入预热的含有HAT的培养基,混匀,铺细胞至96孔板进行培养。
1.5 单克隆抗体筛选
1.5.1免疫过氧化物酶单层细胞试验(immune peroxidase monolayer assay,IPMA)筛选分泌PRV抗体的杂交瘤细胞 铺PK-15细胞于96孔板,待细胞生长至70%~80%时,用PRV HN1201感染,同时设置正常细胞为阴性对照。感染16 h后,用预冷的含3% H2O2的甲醇室温固定细胞15 min,PBST洗2次;加入5%脱脂奶,37℃封闭2 h,PBST洗3次;加入杂交瘤细胞上清,37℃孵育2 h,PBST洗3次;加入1∶1 000稀释的HRP标记山羊抗小鼠IgG二抗,37℃孵育1 h,PBST洗3次;加入AEC显色液室温作用10~15 min,弃显色液,加入双蒸水终止显色反应,于显微镜下观察,筛选分泌PRV抗体的杂交瘤细胞。
1.5.2分泌PRV gE蛋白单克隆抗体的杂交瘤细胞筛选及亚克隆 将表达PRV HN1201 gE蛋白的真核重组质粒pCDNA3.0-gE-HA转染至293T细胞,通过Western blot试验进一步筛选分泌PRV gE蛋白抗体的杂交瘤细胞,利用有限稀释法进行亚克隆,直至得到能稳定分泌PRV gE蛋白单克隆抗体的杂交瘤细胞系。
1.6 单克隆抗体亚类鉴定按照IgG亚类鉴定试剂盒说明书操作,对PRV gE单克隆抗体亚类进行鉴定。
1.7 腹水制备及抗体纯化10~12周龄BALB/c雌鼠,腹腔注射300 μL弗氏不完全佐剂,7 d 后腹腔接种分泌PRV gE单克隆抗体的杂交瘤细胞(3×106/只),同时设置腹腔注射SP2/0细胞的阴性对照小鼠。待小鼠腹部明显胀大时采集腹水,10 000 r/min离心10 min,收集上清,即为单克隆抗体腹水。收集的腹水经饱和硫酸铵沉淀法和ProteinIso®Protein G Resin进行纯化,加甘油(终浓度为50%)-20℃保存,用SDS-PAGE对纯化后的抗体纯度进行检测。
1.8 抗体效价测定取腹水纯化所得抗体,采用固定病毒-稀释腹水抗体法,对其进行IFA抗体效价检测。另外对已纯化腹水抗体用于Western blot试验的最佳稀释度进行探索。
1.9 IFA鉴定抗体与不同 PRV毒株的反应性分别将PRV HN1201、PRV QXX、PRV Bartha K61接种于PK-15细胞,设置未接毒的细胞为阴性对照,16 h后,用4% PFA室温固定细胞30 min,杂交瘤细胞上清作为一抗,FITC标记山羊抗小鼠抗体作为二抗,按照IFA反应条件进行操作,于荧光显微镜下观察结果。
1.10 IFA检测单克隆抗体交叉反应性猪繁殖与呼吸综合征病毒(PRRSV)感染Marc-145细胞,猪流行性腹泻病毒(PEDV)感染Vero细胞,按照常规IFA方法操作,检测单克隆抗体与常见病毒的交叉反应性。
1.11 单克隆抗体识别PRV HN1201 gE抗原表位鉴定利用生物学软件SnapGene根据gE基因序列将gE基因截短为两段重合的片段,设计引物,扩增目的片段,连接到pEGFP-C1载体中,构建真核表达载体,通过Western blot检测,确定抗体针对的抗原表位所在片段,再对特异片段用同样的方法继续进行截短。
2 结果
2.1 免疫小鼠血清抗体水平通过ELISA方法测定灭活PRV HN1201免疫小鼠血清抗体效价,结果显示7只小鼠均产生PRV抗体,其中1号小鼠抗体效价最高为1∶102 400(图1),取1号小鼠加强免疫1次。

图1 间接ELISA检测首免35 d后小鼠血清中 PRV 抗体分泌水平
2.2 分泌PRV gE蛋白单克隆抗体杂交瘤细胞株的建立将灭活后的PRV HN1201病毒免疫小鼠,取其脾细胞与SP2/0细胞融合,经HAT培养基筛选5~7 d后,明显观察到杂交瘤细胞增殖(图2),经IPMA和Western blot对多株融合细胞进行筛选,最终得到2株稳定分泌PRV gE单克隆抗体的杂交瘤细胞株,分别命名为1-F11-3、3-E11-3。IPMA结果显示1-F11-3株单克隆抗体使感染PRV的PK-15细胞呈红棕色(图3),3-E11-3不能使感染PRV的PK-15细胞呈红棕色;Western blot结果显示,以1-F11-3、3-E11-3为一抗孵育PVDF膜,在相对分子质量100 kDa左右出现了特异性条带,表明2株抗体均可特异性识别PRV gE蛋白(图4)。

A.融合后5 d;B.融合后7 d
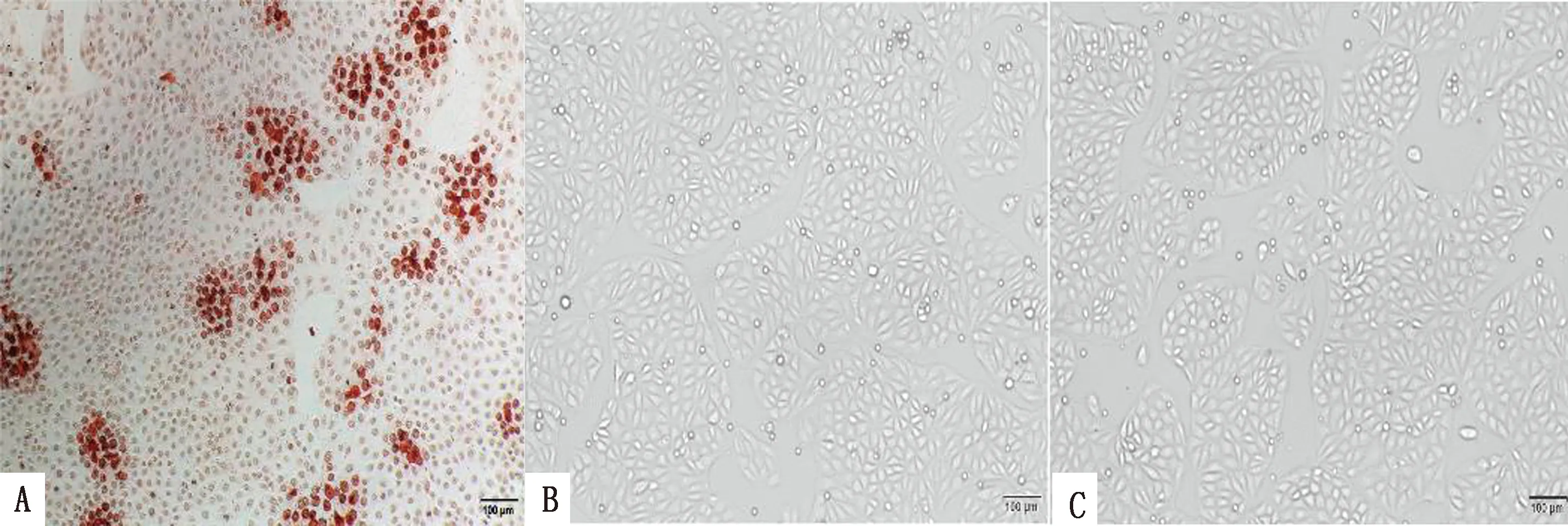
A.1-F11-3检测PRV HN1201感染的PK-15细胞;B.3-E11-3检测PRV HN1201感染的PK-15细胞;C.正常PK-15细胞

M.蛋白质Marker;1.PK-15细胞蛋白;2.PRV HN1201感染PK-15细胞蛋白;3.pCDNA3.0-gE-HA质粒转染293T细胞蛋白
2.3 PRV gE蛋白单克隆抗体Ig亚类鉴定按照IgG亚类鉴定试剂盒说明书操作,通过ELISA方法对PRV gE单克隆抗体亚类进行鉴定。结果显示,1-F11-3亚类为IgG2a,3-E11-3亚类为IgM,轻链均为Kappa链(图5)。

A.单克隆抗体1-F11-3的亚类鉴定(1~3.1-F11-3杂交瘤细胞上清;4.阳性对照;5.阴性对照);B.单克隆抗体3-E11-3的亚类鉴定(6~8.3-E11-3杂交瘤细胞上清;9.阳性对照;10.阴性对照)
2.4 PRV gE蛋白单克隆抗体纯化效果及抗体效价纯化后的抗体经SDS-PAGE凝胶电泳,1-F11-3在50,25 kDa处分别为抗体的重链和轻链,3-E11-3在75,25 kDa处分别为抗体的重链和轻链(图6)。纯化后的1-F11-3、3-E11-3抗体用于Western blot检测的最高稀释比分别为1∶14 000和1∶12 000。1-F11-3抗体IFA检测效价为2-14(图7)。
2.5 IFA检测单克隆抗体与不同PRV毒株反应及其交叉反应性IFA结果显示,1-F11-3抗体能与不同PRV毒株反应,但不与PRV Bartha-K61反应(图8A),且不与其他病毒发生交叉反应(图8B)。
2.6 单克隆抗体识别PRV HN1201 gE抗原表位鉴定将PRV gE片段截短真核表达后,通过Western blot试验,鉴定1-F11-3株PRV gE抗体识别gE抗原序列为64GDDRRAGFGSALASLR79,3-E11-3株PRV gE抗体识别gE抗原序列为156PPEVPRLRRGPPIVTPERWS175(图9)。

M.蛋白质Marker;1.纯化前小鼠腹水;2.小鼠腹水纯化后抗体

图7 IFA检测小鼠腹水纯化后PRV gE蛋白抗体效价

A.单克隆抗体1-F11-3与不同PRV毒株反应;B.单克隆抗体1-F11-3与其他病毒的交叉反应
3 讨论
1947年,我国东部地区首次报道了PRV引起的病例[19]。1970年,PR在我国大部分地区广泛流行,给我国养猪业造成了巨大的经济损失[20-21]。gE蛋白是PRV主要的毒力蛋白,但缺失gE蛋白不影响病毒的免疫原性。为控制和根除PR,人们广泛使用gE基因缺失疫苗,至1990年以后该病得到了有效控制[22-23]。然而,2011年底,PRV变异株再次引起了PR的暴发,gE基因缺失疫苗(Bartha-K61)已不能提供有效的免疫保护[24-26],因此,在PR的防控工作中,除疫苗免疫外,还应加强PRV野毒感染的检测并及时淘汰野毒感染猪。
由于市面上的PRV疫苗多为gE基因缺失疫苗,因此gE被认为是野生PRV毒株感染的指标,可以通过检测血清中gE抗原或gE抗体来区分野毒感染猪和疫苗免疫猪。因此,PRV gE单克隆抗体在PR的防治和净化过程中具有重要作用。
通过原核表达gE蛋白为免疫原制备的gE单克隆抗体,在识别天然gE蛋白时的特异性和亲和力较差,这可能与原核表达gE蛋白缺乏天然构象和糖基化修饰有关。而以PRV全病毒颗粒为免疫原制备的gE单克隆抗体能有效识别天然gE蛋白,故本研究使用PRV抗原免疫小鼠。用ELISA方法检测小鼠血清,选取抗体水平最高的小鼠脾脏进行细胞融合,然后,通过IPMA、Weatern blot和亚克隆等方法筛选获得了2株能分泌PRV gE抗体的杂交瘤细胞,分别命名为1-F11-3和3-E11-3,亚类鉴定分别为IgG2a和IgM。
接下来用IFA方法进一步评估其特异性,1-F11-3单克隆抗体与含有gE的PRV特异性结合,不与gE缺失的PRV发生反应,说明该单克隆抗体特异性识别gE蛋白,且与PRV的其他结构蛋白无交叉反应;此外,通过IFA试验确定该单克隆抗体不与PRRSV、PEDV、PCV-2、PPV发生交叉反应。3-E11-3单克隆抗体仅能通过Western blot方法识别gE蛋白,这可能与其识别的抗原表位的类型有关。通过抗原表位鉴定,2株抗体识别不同的gE抗原序列,分别为64GDDRRAGFGSALASLR79和156PPEVPRLRRGPPIVTPERWS175。纯化后的1-F11-3、3-E11-3抗体用于Western blot检测的最高稀释比分别为1∶14 000和1∶12 000;1-F11-3株IFA效价达2-14,抗体灵敏度较高。

A.1-F11-3株单克隆抗体识别gE抗原表位的8个重叠的多肽示意图;B.Western blot鉴定1-F11-3株单克隆抗体识别gE抗原表位;C.表达gE截短的蛋白的GFP标签鉴定;D.3-E11-3株单克隆抗体识别gE抗原表位的6个重叠的多肽示意图;E.Western blot鉴定3-E11-3株单克隆抗体识别gE抗原表位;F.表达gE截短的蛋白的GFP标签鉴定
PRV gE蛋白作为具有重要的生物学和免疫学功能的蛋白,是制备单克隆抗体、疫苗研制、诊断试剂等方面研究的靶标物质。本研究成功制备了特异性强、灵敏度高的2株PRV gE单克隆抗体,并探究了单克隆抗体识别的特异性抗原表位。为建立快速、特异的PR血清学诊断方法和免疫预防等研究奠定了基础。
