基于NLRP3炎症小体探讨活血荣络方对大鼠脑缺血再灌注损伤的影响及机制
2023-09-25尹倩周德生陈瑶申毅张宇星曾富康苏晓舟刘利娟
尹倩,周德生 ,陈瑶 ,申毅 张宇星 ,曾富康 ,苏晓舟 ,刘利娟
1.邵东市人民医院,湖南 邵东 422800; 2.湖南中医药大学,湖南 长沙 410208;3.湖南中医药大学第一附属医院,湖南 长沙 410007
脑梗死又称缺血性卒中,是卒中的常见类型,约占全部卒中的69.6%,是卒中患者死亡的主要原因[1]。使用重组组织型纤溶酶原激活剂(rt-PA)溶栓是当前首选治疗方案[2]。使用rt-PA的时间应在3 h内,最迟不超过4.5 h,使用尿激酶溶栓的时间窗可适当放宽至6 h内。然而由于严格的时间窗限制,使获得溶栓治疗的急性脑梗死患者比例极低。外科机械取栓也有时间窗限制,前循环大血管闭塞的取栓时间为6 h,后循环动脉闭塞时间窗可延至24 h[3]。尽管药物溶栓或机械取栓恢复部分或全部血流灌注,一定程度上可恢复组织功能,但是可能出现脑组织损伤加重、功能进一步恶化等病理生理过程,即脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI)[4-5]。因此,考虑到目前急性脑梗死发病特点及治疗手段限制,理想的治疗方案是在恢复缺血组织血氧供应同时尽可能避免或减轻再灌注所致二次损伤。
CIRI形成涉及一系列病理过程,如氧化应激障碍、细胞凋亡、线粒体自噬、炎症反应、细胞焦亡等[6-10],其中炎症反应在CIRI中扮演重要角色[11-12]。NLRP3炎症小体由NLRP3蛋白、胱天蛋白酶-1(Caspase-1)和凋亡相关斑点样蛋白(ASC)构成,其激活后会诱导脑内小胶质细胞合成炎症因子,并加速释放,诱发中枢系统炎症反应,加重CIRI。
脑梗死属中医学“中风”范畴。荣气为气血阴阳津液的综合功能[13],既具精微物质属性,又兼气化运动功能,精微耗损易致荣气虚,气化失司、运动失常易发荣气滞,而荣气虚滞互为因果,导致机体内邪交互、神机失用,发为此病[14-15]。活血荣络方是湖南中医药大学第一附属医院院内制剂,基于荣气虚滞理论创制,临床疗效显著、安全性好。课题组前期研究显示,活血荣络方能通过激活自噬减轻CIRI炎症过程和氧化应激反应,抑制炎症因子分泌,促进神经功能恢复[16-18]。本实验以NLRP3炎症小体介导的细胞焦亡为切入点,深入研究活血荣络方对CIRI的保护机制。
1 实验材料
1.1 动物
72只健康雄性SD大鼠,体质量(260±20)g,购自湖南斯莱克景达实验动物有限公司。饲养于湖南中医药大学实验动物中心,使用许可证号SYXK(湘)2020-0010,温度(24±2)℃,湿度60%±10%,12 h明暗交替。本实验经湖南中医药大学动物伦理委员会审查批准(20201010-13)。
1.2 药物及制备
活血荣络方由鸡血藤、石楠藤、生地黄、黄精、玄参、川芎、乳香、没药按6∶6∶3∶3∶2∶2∶2∶2比例组成,饮片购自湖南中医药大学第一附属医院中药房,常规煎煮,水浴浓缩成原药材浓度为2.34 g/mL药液。灌胃前取适量药液,用蒸馏水分别稀释成0.585、1.17 g/mL。尼莫地平片,正大青春宝药业有限公司,20 mg/片,批号1912012,用蒸馏水配制成浓度为1.1 mg/mL药液。
1.3 主要试剂与仪器
水合氯醛(麦克林,货号C804539),TTC粉末(Sigma公司,货号T8877-10G),BCA蛋白定量试剂盒(联科生物,货号70-PQ0012),大鼠白细胞介素(IL)-1β、IL-18 ELISA试剂盒(伊莱瑞特,货号分别为E-EL-R0012c、E-EL-0567c),pro-Caspase-1、NLRP3一抗(三鹰生物,货号分别为22915-1-AP、19771-1-AP),Cleaved-Caspase-1(万类生物,货号为WL02996a),TUNEL试剂盒(Roche,货号11684817910),DAPI(碧云天,货号C1002),抗荧光淬灭封片剂(SouthBiotech,货号0100-1),Caspase-1一抗(PTG,货号22915-1-AP),CY3标记山羊抗兔荧光二抗(JACKSON,货号111-165-003)。
栓线(型号2838-A4,北京西浓),低温高速离心机(型号H1850,湖南湘仪),多功能酶标仪(型号Enspire,美国Perkinelmer),病理切片机(型号RM2016,上海徕卡仪器),电热恒温水槽(型号DK-8AD,上海一恒),HE成像仪(型号Nikon DS-U3,日本尼康)。
2 实验方法
2.1 造模
大鼠适应性喂养7 d后分为假手术组和造模组,参照Longa等[19]方法制备CIRI大鼠模型。术前12 h禁食不禁水,10%水合氯醛腹腔注射3 mL/kg麻醉大鼠,将大鼠固定,术区消毒,于颈前纵向剪一2.5 cm切口,分离皮肤、筋膜、肌肉等组织,暴露右侧颈总动脉及颈内动脉、颈外动脉分叉,缝线结扎颈总动脉近心端及颈外动脉近分叉处,颈内动脉近分叉处挂一缝线备用,动脉夹夹闭颈内动脉近心端,用眼科剪距分叉下约4 mm剪一小口,将栓线从开口处插入,沿颈总动脉推进,至分叉处松开动脉夹,沿颈内动脉插入,插入距分叉处约18 mm停止,将栓线连同颈内动脉结扎。伤口处撒适量青霉素,逐层缝合并常规消毒,分笼饲养。2 h后将栓线拔出实现再灌注。假手术组仅分离颈总动脉,不插入栓线,其余操作相同。术后6 h恢复进食。采用Zea-Longa评分法进行神经功能缺损评分[19],评分1~3分大鼠为造模成功。
2.2 分组及给药
将成模大鼠随机分为模型组、尼莫地平组和活血荣络方低、中、高剂量组,每组9只。按人与动物体表面积换算给药剂量,活血荣络方低、中、高剂量组给药剂量分别为5.85、11.7、23.4 g/kg,尼莫地平组给药剂量为11 mg/kg,灌胃体积1 mL/100 g,假手术组和模型组灌胃等体积蒸馏水,造模前36 h第1次灌胃,之后每24 h灌胃1次,共3次。
2.3 神经功能缺损评分
再灌注24 h后,采用Zea-Longa评分法[19]对大鼠进行神经功能缺损评分。
2.4 脑梗死体积测定
神经功能缺损评分后,各组随机选取3只大鼠行TTC染色。先以水合氯醛腹腔注射3 mL/kg麻醉,快速断头取脑,-20 ℃冰箱速冻约20 min。沿冠状面将大脑连续切片,厚约2 mm,将脑组织放入2%TTC染液中,37 ℃水浴锅避光染色30 min。生理盐水冲洗后,加入4%多聚甲醛浸泡固定。脑组织染色后,正常区域呈红色,梗死区呈白色。用Image-Pro Plus 6.0软件测量各脑片总面积及梗死面积,计算脑梗死体积百分比(梗死区体积÷正常侧大脑体积×100%)。
2.5 HE染色
取大鼠脑组织行石蜡包埋,经切片、脱蜡、染色、脱水、封片等步骤后,于400倍光学显微镜下分别观察海马及皮质区病理形态。
2.6 ELISA检测
大鼠腹腔注射水合氯醛麻醉后,腹主动脉采血,室温静置1 h,3500 r/min离心15 min,取血清,按试剂盒说明书检测IL-1β、IL-18含量。
2.7 Western blot检测
再灌注24 h后,麻醉大鼠取脑,冰上剥取海马组织,洗涤后放入冻存管,液氮中速冻,于-80 ℃冰箱保存。海马组织加入1 mL裂解液,匀浆后于冰上静置30 min,4 ℃、12000 r/min离心5 min,分离上清,BCA法测定蛋白浓度。每孔上样量10 μg,凝胶电泳,转膜后用5%脱脂奶粉封闭1 h,滴加一抗(β-actin 1∶8000、NLRP31∶1000、pro-Casepase-11∶2000、Cleaved-Caspase-11∶1000),4 ℃孵育过夜,TBST洗膜3次,每次10 min。加山羊抗兔二抗(1∶8000),37 ℃孵育1 h,洗膜,ECL化学发光剂显影,用Image Lab软件检测条带灰度值,以目的蛋白/β-actin灰度值表示蛋白相对表达量。
2.8 免疫组化检测
取脑组织石蜡切片,抗原修复,封闭,滴加Caspase-1一抗(1∶100),4 ℃孵育过夜,二抗孵育,DAB显色,脱水封片后,显微镜下观察,阳性表达为棕黄色,观察相同部位海马及皮质区5个非重叠视野,计算平均光密度。
2.9 免疫荧光双染
取石蜡切片,抗原修复,封闭,洗涤,滴加Cleaved-Caspase-1一抗和TUNEL染液,4 ℃孵育过夜,荧光二抗孵育,洗涤,DAPI染细胞核,抗荧光衰减封片剂封片,荧光显微镜下观察并采集图像。Cleaved-Caspase-1阳性呈红色荧光,TUNEL阳性呈绿色荧光,DAPI阳性呈蓝色荧光,取皮质区相同部位,计算焦亡阳性细胞率[(Cleaved-Caspase-1+TUNEL+DAPI)阳性细胞÷DAPI阳性细胞]。
3 统计学方法
采用SPSS24.0统计软件进行分析。计量资料以±s表示,经正态分析及方差齐性检验后,方差齐用方差分析,多组间比较用LSD检验,方差不齐用Dunnett’s T3检验。P<0.05表示差异有统计学意义。
4 结果
4.1 活血荣络方对模型大鼠神经功能缺损评分的影响
与假手术组比较,模型组大鼠神经功能缺损评分明显升高(P<0.01);与模型组比较,活血荣络方中、高剂量组和尼莫地平组神经功能缺损评分明显降低(P<0.05,P<0.01)。见表1。
表1 各组大鼠神经功能缺损评分比较(±s,分)

表1 各组大鼠神经功能缺损评分比较(±s,分)
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
组别假手术组模型组活血荣络方低剂量组活血荣络方中剂量组活血荣络方高剂量组尼莫地平组神经功能缺损评分02.56±0.53**2.44±0.531.56±0.53#1.67±0.50#1.44±0.52##只数剂量/(g/kg)9999995.8511.723.40.011
4.2 活血荣络方对模型大鼠脑梗死体积的影响
与假手术组比较,模型组大鼠脑梗死体积百分比明显增加(P<0.01);与模型组比较,活血荣络方中、高剂量组及尼莫地平组大鼠脑梗死体积百分比明显减少(P<0.01);与活血荣络方中剂量组比较,活血荣络方高剂量组大鼠脑梗死体积百分比明显增加(P<0.01)。见图1、表2。

图1 各组大鼠脑片比较(TTC染色)
表2 各组大鼠脑梗死体积比较(±s,%)

表2 各组大鼠脑梗死体积比较(±s,%)
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01;与活血荣络方中剂量组比较,△△P<0.01
组别假手术组模型组活血荣络方低剂量组活血荣络方中剂量组活血荣络方高剂量组尼莫地平组脑梗死体积百分比019.43±2.38**17.24±1.166.40±1.10##11.04±2.79##△△6.26±1.42##只数剂量/(g/kg)3333335.8511.723.40.011
4.3 活血荣络方对模型大鼠海马及皮质区形态的影响
假手术组大鼠海马及皮质区神经元排列整齐、分布均匀,胞体未见明显空泡;模型组大鼠海马及皮质区神经元分布散乱,胞体缩小变形,核固缩明显,核仁裂解消失;活血荣络方低剂量组大鼠海马及皮质区神经元胞核固缩、胞体变形,部分神经元坏死;活血荣络方中剂量组和尼莫地平组大鼠海马及皮质区神经元损伤明显好转,神经元排列规则,可见少许变性神经元;活血荣络方高剂量组大鼠海马及皮质区部分细胞空泡化,较活血荣络方中剂量组神经元密度减少,细胞碎片增多。见图2、图3。

图2 各组大鼠海马区形态(HE染色,标尺=50 μm)
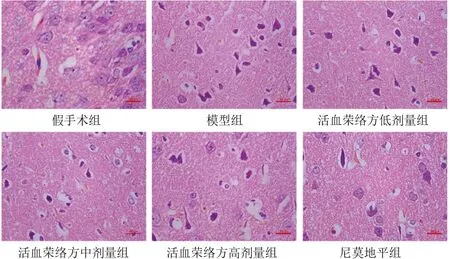
图3 各组大鼠皮质区形态(HE染色,标尺=50 μm)
4.4 活血荣络方对模型大鼠血清白细胞介素-1β、白细胞介素-18含量的影响
与假手术组比较,模型组大鼠血清IL-1β、IL-18含量明显增加(P<0.01);与模型组比较,活血荣络方中、高剂量组和尼莫地平组大鼠血清IL-1β、IL-18含量明显减少(P<0.01),且活血荣络方中剂量组作用更明显(P<0.01)。见表3。
表3 各组大鼠血清IL-1β、IL-18含量比较(±s,pg/mL)

表3 各组大鼠血清IL-1β、IL-18含量比较(±s,pg/mL)
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01;与活血荣络方中剂量组比较,△△P<0.01
组别假手术组模型组活血荣络方低剂量组活血荣络方中剂量组活血荣络方高剂量组尼莫地平组剂量/(g/kg)只数3333335.8511.723.40.011 IL-1818.69±2.6873.50±3.15**68.78±1.7032.36±3.05##44.87±4.17##△△28.62±4.31##IL-1β 65.06± 6.19173.98±14.61**158.98± 5.2884.37± 1.11##109.07±12.07##△△75.96± 6.30##
4.5 活血荣络方对模型大鼠海马组织NLRP3、pro-Caspase-1、Cleaved-Caspase-1蛋白表达的影响
与假手术组比较,模型组大鼠海马组织NLRP3、pro-Caspase-1、Cleaved-Caspase-1蛋白表达明显升高(P<0.01);与模型组比较,活血荣络方中、高剂量组和尼莫地平组大鼠海马组织NLRP3、pro-Caspase-1、Cleaved- Caspase-1蛋白表达明显降低(P<0.01);与活血荣络方中剂量组比较,活血荣络方高剂量组pro-Caspase-1、Cleaved-Caspase-1蛋白表达明显升高(P<0.05)。见图4、表4。
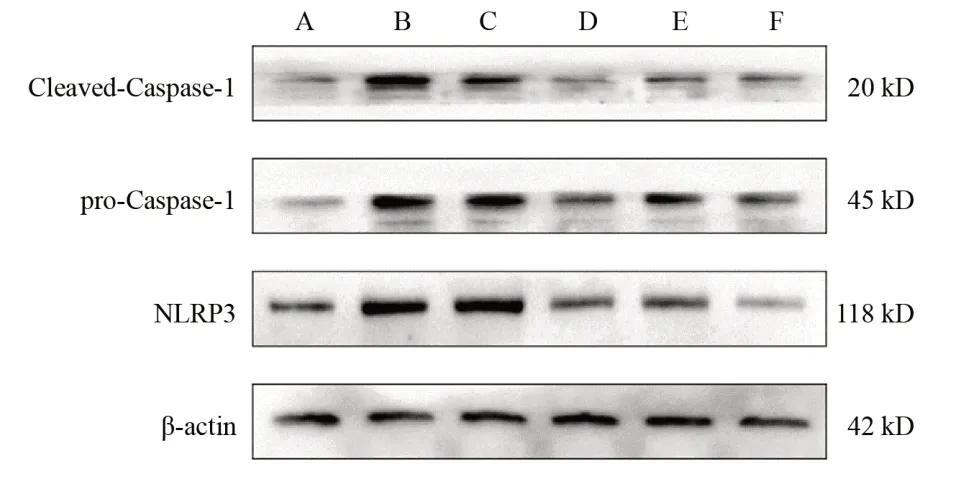
图4 各组大鼠海马组织NLRP3、pro-Caspase-1、Cleaved-Caspase-1蛋白免疫印迹
表4 各组大鼠海马组织NLRP3、pro-Caspase-1、Cleaved-Caspase-1蛋白表达比较(±s)

表4 各组大鼠海马组织NLRP3、pro-Caspase-1、Cleaved-Caspase-1蛋白表达比较(±s)
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与活血荣络方中剂量组比较,△P<0.05
Cleaved-Caspase-11.00±0.152.90±0.38**2.44±0.231.34±0.25##1.97±0.30##△1.53±0.26##组别假手术组模型组活血荣络方低剂量组活血荣络方中剂量组活血荣络方高剂量组尼莫地平组只数剂量/(g/kg)3333335.8511.723.40.011 NLRP31.00±0.282.77±0.19**2.66±0.381.50±0.07##1.84±0.07##1.32±0.30##pro-Caspase-11.00±0.263.00±0.29**2.38±0.33#1.18±0.23##1.89±0.29##△1.58±0.29##
4.6 活血荣络方对模型大鼠海马及皮质区Caspase-1表达的影响
与假手术组比较,模型组大鼠海马CA1区及皮质区Caspase-1表达明显升高(P<0.01);与模型组比较,活血荣络方中、高剂量组和尼莫地平组大鼠海马CA1区及皮质区Caspase-1表达明显降低(P<0.05),以活血荣络方中剂量组变化最明显(P<0.05,P<0.01)。见图5、表5。

图5 各组大鼠海马及皮质区Caspase-1阳性表达(免疫组化染色,×400)
表5 各组大鼠海马CA1区和皮质区Caspase-1表达比较(±s,×10-2)

表5 各组大鼠海马CA1区和皮质区Caspase-1表达比较(±s,×10-2)
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01;与活血荣络方中剂量组比较,△P<0.05,△△P<0.01
组别假手术组模型组活血荣络方低剂量组活血荣络方中剂量组活血荣络方高剂量组尼莫地平组剂量/(g/kg)皮质区0.31±0.061.39±0.11**1.25±0.160.58±0.08##0.85±0.07##△△0.44±0.09##只数3333335.8511.723.40.011海马CA1区2.50±0.5510.14±0.57**9.18±1.044.11±0.39##5.47±0.08##△3.86±0.67##
4.7 活血荣络方对模型大鼠皮质区细胞焦亡的影响
焦亡细胞表现为Cleaved-Caspase-1+TUNEL+DAPI阳性。假手术组皮质区可见少量凋亡细胞(绿色荧光),未见焦亡阳性细胞。与假手术组比较,模型组大鼠皮质区焦亡阳性细胞率明显升高(P<0.01);与模型组比较,活血荣络方中、高剂量组和尼莫地平组大鼠皮质区焦亡阳性细胞率明显降低(P<0.01);与活血荣络方中剂量组比较,活血荣络方高剂量组焦亡阳性细胞率明显升高(P<0.05)。见表6、图6。
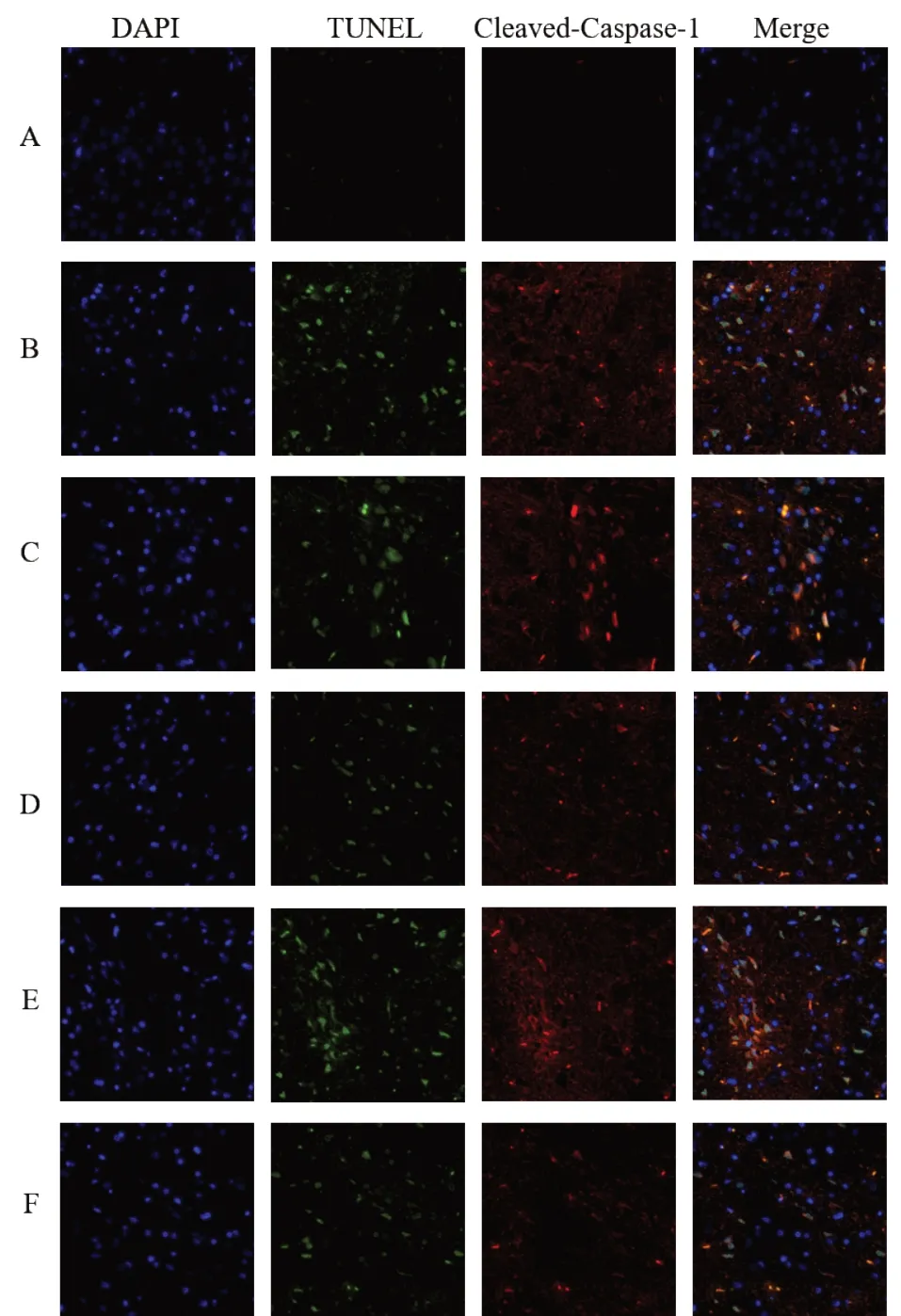
图6 各组大鼠皮质区细胞焦亡阳性表达(免疫荧光染色,×400)
表6 各组大鼠皮质区焦亡阳性细胞率比较(±s)

表6 各组大鼠皮质区焦亡阳性细胞率比较(±s)
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01;与活血荣络方中剂量组比较,△P<0.05
组别假手术组模型组活血荣络方低剂量组活血荣络方中剂量组活血荣络方高剂量组尼莫地平组焦亡阳性细胞率00.17±0.28**0.15±0.160.06±0.01##0.10±0.02##△0.05±0.02##只数剂量/(g/kg)3333335.8511.723.40.011
5 讨论
细胞焦亡作为炎症细胞的死亡方式,能扩大炎症反应,加剧CIRI。NLRP3炎症小体在介导细胞焦亡中发挥重要作用[20-21]。细胞受外界刺激后,激活炎症复合物,活化Caspase-1,其既能作为直接激动剂使IL-1β和IL-18前体自身切割,释放出胞外募集其他炎症细胞,加重炎症反应,又能剪切GSDMD,释放出活性N端(GSDMD-N)与质膜内层磷脂结合,加速核孔形成,释放成熟形式的炎症因子诱导焦亡[22-25]。炎症反应又进一步促进NLRP3炎症小体激活,形成恶性循环,加重疾病。CIRI发生时,机体血脑屏障功能减弱,外周炎症细胞及中枢神经系统活化的小胶质细胞释放出促炎因子,造成NLRP3、Caspase-1、IL-1β等炎症介质高表达,使胶质细胞和神经元死亡。
本实验通过建立CIRI大鼠模型,观察NLRP3炎症小体在CIRI中的作用及活血荣络方的调控机制。神经功能缺损评分发现,模型组大鼠神经功能缺损评分显著增加,而活血荣络方各剂量组能不同程度降低神经功能缺损评分,减轻脑损伤。结合大鼠脑梗死体积分析,说明活血荣络方对模型大鼠有神经保护作用。通过HE染色和免疫组化染色发现,模型组大鼠海马及皮质区神经元减少,核仁消失、核固缩明显,Caspase-1表达明显升高,而活血荣络方对模型大鼠病理形态和Caspase-1表达均有一定程度改善,且活血荣络方中、高剂量组改善较为明显。Western blot及ELISA结果显示,模型组大鼠海马组织NLRP3、pro-Caspase-1、Cleaved-Caspase-1和血清IL-1β、IL-18水平明显升高,提示脑缺血后NLRP3炎症小体通过活化Caspase-1与下游细胞因子共同作用,介导经典焦亡途径的激活,进一步加重缺血性脑损伤。活血荣络方中、高剂量组海马组织NLRP3、pro-Caspase-1、Cleaved-Caspase-1蛋白表达降低,血清IL-18、IL-1β含量减少,说明活血荣络方可能通过该途径发挥脑保护作用。最后通过免疫荧光染色检测细胞焦亡,结合焦亡经典途径验证活血荣络方可能通过抑制NLRP3炎症小体介导的细胞焦亡减轻CIRI,且中剂量活血荣络方效果最显著,与尼莫地平相当。
综上,活血荣络方能改善大鼠CIRI,发挥神经保护作用,其机制与抑制NLRP3炎症小体介导的细胞焦亡、减轻炎症级联反应相关。本研究阐明了活血荣络方治疗CIRI的部分机制,今后将继续深入探索其潜在靶点及作用机制。
